首页 > 医疗资讯/ 正文
肝细胞癌(HCC)是全球范围内主要的肝脏原发性恶性肿瘤,占全部肝癌的约90%,并且是癌症相关死亡的主要原因之一。由于HCC的多样病因,包括乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、代谢相关脂肪肝病(MASLD,前称非酒精性脂肪肝病NAFLD)、代谢相关脂肪性肝炎(MASH,前称非酒精性脂肪性肝炎NASH)以及酒精性肝病,患者的临床表现和治疗反应存在显著异质性。多数HCC患者在晚期才被诊断,手术或肝移植等根治性治疗机会有限,5年生存率不足20%。传统一线靶向药索拉非尼(sorafenib)开启了系统治疗时代,但其疗效有限,且常出现耐药。

免疫检查点抑制剂与联合治疗的兴起
近年来,免疫检查点抑制剂(ICIs)如PD-1/PD-L1和CTLA-4抑制剂在HCC系统治疗中占据核心地位。然而,单药ICIs的客观缓解率仅约15%-20%,疗效有限。鉴于HCC肿瘤微环境(Tumor microenvironment, TME)复杂且高度免疫抑制,单一免疫治疗难以奏效。因而,ICIs与其他治疗手段如酪氨酸激酶抑制剂(Tyrosine kinase inhibitors, TKIs)、化疗药物的联合应用受到广泛关注。例如,IMbrave150研究显示,抗PD-L1的阿特珠单抗(atezolizumab)联合抗VEGF的贝伐珠单抗(bevacizumab)显著延长患者总生存期和无进展生存期,成为一线治疗新标准。
肝细胞癌的免疫微环境特点
HCC的免疫微环境具有高度的免疫抑制特性,主要表现为细胞毒性CD8+ T细胞的功能性耗竭,伴随PD-1、CTLA-4、LAG-3、TIM-3等多重免疫检查点的表达上调。此外,调节性T细胞(Tregs)、骨髓来源抑制细胞(MDSCs)和肿瘤相关巨噬细胞(TAMs,尤其是M2型)大量浸润,分泌IL-10、TGF-β等抑制性细胞因子,加剧免疫逃逸。肿瘤间质的纤维化重塑则形成物理屏障,阻碍免疫细胞进入肿瘤内部,进一步限制免疫治疗效果。
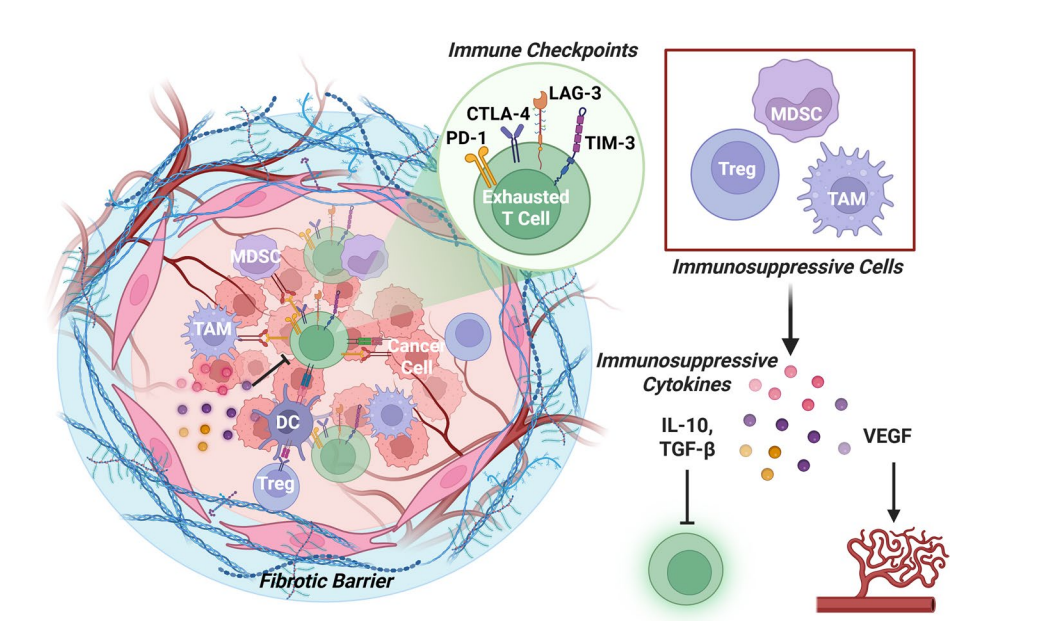
图:HCC中免疫抑制作用的肿瘤微环境
免疫检查点抑制剂的作用机制
ICIs通过阻断PD-1/PD-L1和CTLA-4信号通路,恢复T细胞活性,逆转细胞功能耗竭,从而促进抗肿瘤免疫反应。PD-1抑制剂(如纳武利尤单抗nivolumab、帕博利珠单抗pembrolizumab)解除T细胞抑制,增强细胞毒活性。CTLA-4抑制剂(如伊匹单抗ipilimumab、曲美木单抗tremelimumab)主要促进初始T细胞活化和抗原递呈,减少Tregs介导的免疫抑制。尽管单药ICIs疗效有限,但它们可通过减弱免疫抑制细胞,增加效应性CD8+ T细胞浸润,对肿瘤产生免疫调节作用。
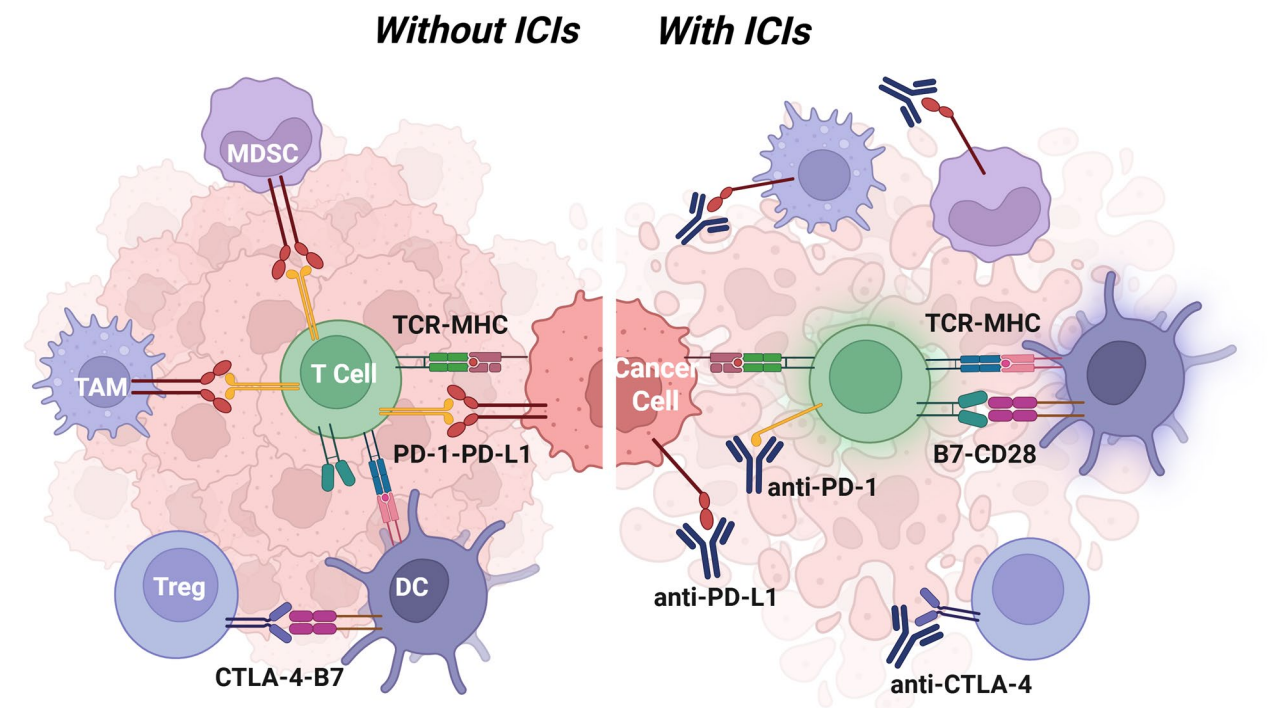
图:ICIs在HCC中的作用机制
联合免疫治疗策略及其细胞机制
ICIs与TKIs联合
HCC肿瘤高度血管化,异常的血管生成导致肿瘤缺氧,促进免疫抑制。TKIs如仑伐替尼(lenvatinib)、卡博替尼(cabozantinib)通过抑制VEGF信号,部分恢复肿瘤血管正常化,缓解缺氧,促进免疫细胞浸润,同时抑制MDSCs和Tregs的积累,减少免疫抑制性细胞因子(IL-10、TGF-β)水平。此外,TKIs可促进树突状细胞(DCs)成熟,增强抗原递呈,提高T细胞激活。TKIs还能抑制MET、AXL等与肿瘤侵袭和免疫逃逸相关的通路。临床试验如IMbrave150、ORIENT-32、CARES-310和CheckMate 040 cohort 6均证实了ICIs与TKIs联合的临床获益。
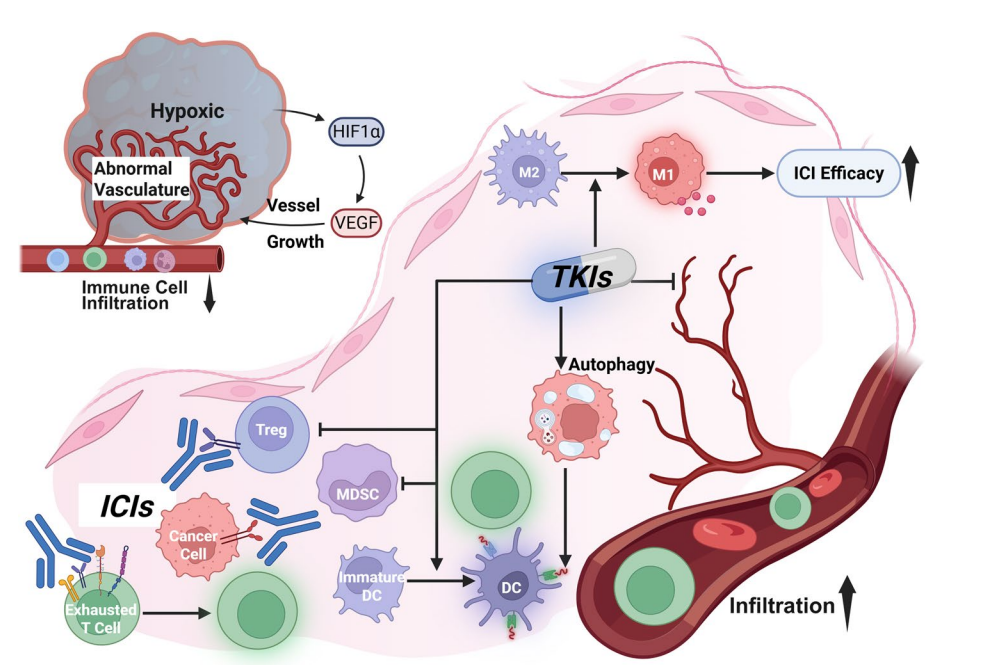
图:ICI与TKI联合治疗的协同作用机制
ICIs与化疗联合
部分化疗药物可诱导免疫原性细胞死亡(ICD),释放肿瘤相关抗原和危险信号,激活DCs和效应性T细胞。药物如奥沙利铂(oxaliplatin)、5-氟尿嘧啶(5-FU)、多柔比星等可减少MDSCs和Tregs,改变免疫微环境,提升免疫治疗效果。化疗还可以重塑肿瘤间质,降低纤维化,促进免疫细胞渗透。临床研究显示,ICIs与化疗联合治疗可提高肿瘤缓解率,安全性可控,但不同药物和剂量对免疫影响存在差异,需进一步优化方案。
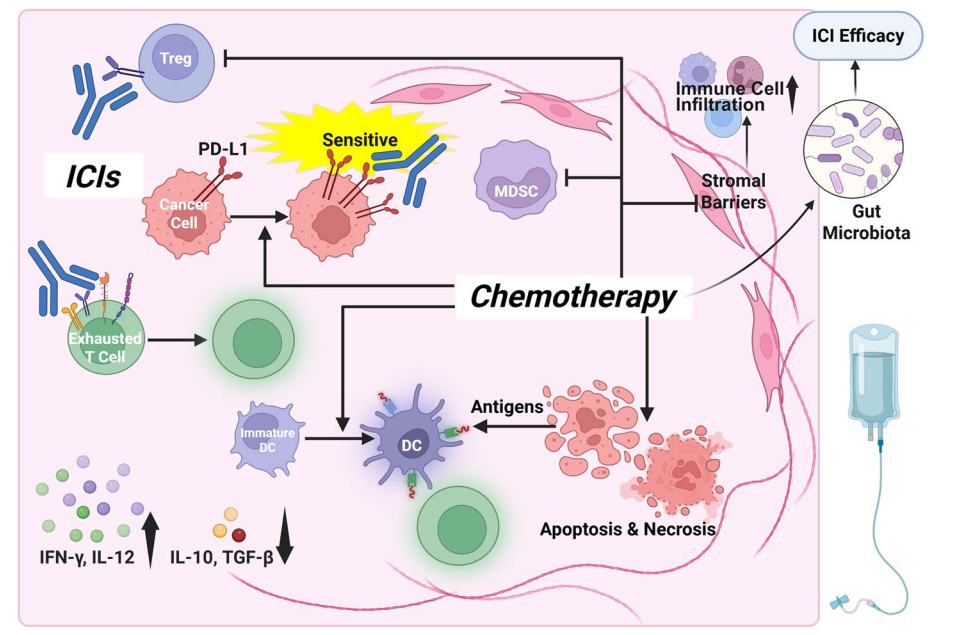
图:ICD与ICI联合化疗的协同作用
双免疫检查点抑制剂联合
PD-1/PD-L1与CTLA-4在T细胞活化的不同阶段发挥抑制作用。双重阻断能同时增强T细胞初始激活和恢复效应细胞功能,促进更持久的抗肿瘤免疫。临床试验如CheckMate 9DW和HIMALAYA支持双免疫检查点联合治疗具有更高疗效,但免疫相关不良事件较单药多,需合理调整给药方案。新一代双特异性抗体正在研发,以期降低毒性,提高选择性。
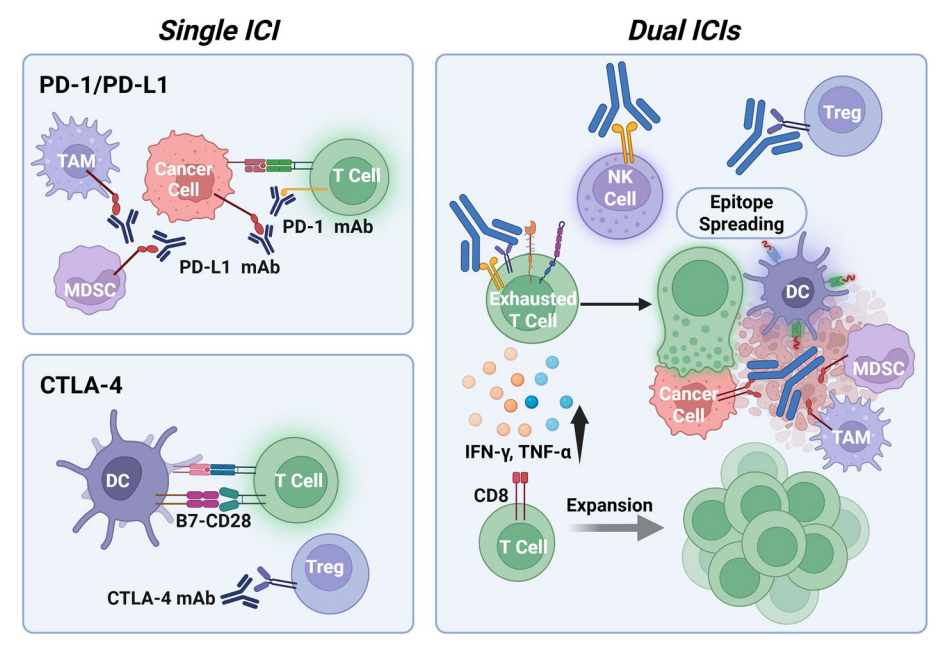
图:HCC中双重免疫检查点阻断的机制协同作用
肿瘤异质性与免疫表型对治疗响应的影响
HCC因病因(病毒性、代谢性、酒精性等)、基因突变(如CTNNB1)及免疫微环境差异表现出高度异质性。根据免疫细胞浸润程度,HCC肿瘤可分为免疫炎症型、免疫排斥型和免疫荒漠型,分别对应不同的免疫治疗响应。病毒相关HCC相较于代谢相关HCC在免疫治疗中通常反应更佳。多组学技术如单细胞RNA测序和空间组学助力揭示肿瘤免疫环境及异质性,为精准治疗提供依据。
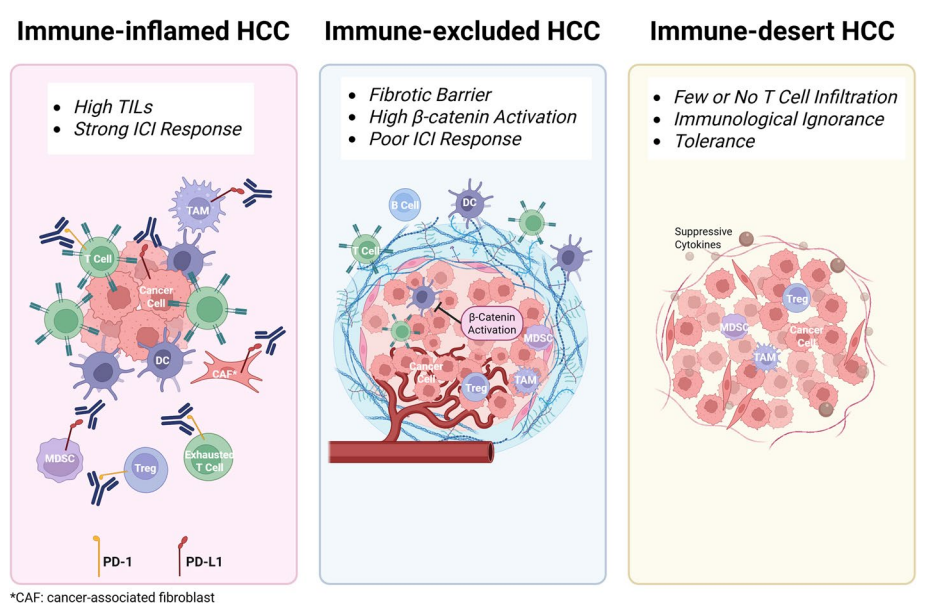
图:HCC的免疫表型及其对ICI治疗反应的影响
表观遗传调控与免疫逃逸
表观遗传改变如DNA甲基化和组蛋白修饰可抑制抗原呈递相关基因表达,增强PD-L1表达,促进免疫逃逸。长非编码RNA(lncRNA)也参与调控免疫抑制通路。表观遗传药物(DNMT抑制剂、HDAC抑制剂)显示出逆转免疫耐药、增强免疫治疗效果的潜力,部分已进入临床试验阶段。
肠道微生物组与免疫治疗
肠道菌群通过产生短链脂肪酸(SCFAs)、维持肠道屏障及调控免疫信号,影响肝脏的免疫环境和ICIs疗效。益生菌如Akkermansia muciniphila与免疫治疗响应相关。肠道菌群失调则可降低免疫治疗效果。粪菌移植(FMT)等策略正被探索以改善免疫治疗反应。
新兴免疫检查点及靶向策略
LAG-3、TIM-3、TIGIT和VISTA等新兴免疫检查点被发现与PD-1/CTLA-4耐药相关,成为潜在联合治疗的新靶点。多项临床试验正在评估这些靶点抑制剂与现有免疫治疗的联合应用。
肿瘤间质与纤维化屏障
HCC肿瘤富含纤维化的肿瘤间质(TME),形成免疫细胞进入的物理屏障。TGF-β、CXCR4-CXCL12轴及LOXL2等信号通路促进纤维化及免疫抑制。抑制这些路径有望改善免疫细胞渗透,提高免疫治疗疗效。
临床挑战与未来展望
尽管联合免疫治疗在HCC中展现出突破性进展,疗效仍受限于患者异质性、肿瘤免疫表型及耐药性。传统生物标志物如PD-L1表达和肿瘤突变负荷(TMB)预测力有限。未来需要结合多维生物标志物、多组学数据和人工智能辅助诊断,实现个体化治疗方案设计。此外,现有动物及体外模型难以完全模拟人类HCC复杂的免疫和纤维化微环境,促使研发更具代表性和预测价值的模型成为当务之急。
结语
肝细胞癌联合免疫治疗正迈入精准医疗新时代。深入理解免疫微环境、肿瘤异质性及耐药机制,结合创新的生物标志物和人工智能技术,将推动个体化组合治疗策略的优化,提升患者预后。未来研究应聚焦机制驱动的治疗设计,促进基础研究与临床实践的紧密结合,真正实现HCC免疫治疗的突破。 --- 梅斯编辑点评:这篇综述系统梳理了肝细胞癌联合免疫治疗的最新进展,内容丰富、细致,涵盖了从基础机制到临床试验的全景视角。值得关注的是,免疫微环境的复杂性以及肿瘤异质性对治疗响应影响巨大,未来个体化治疗依赖于精准的生物标志物和动态监测。面对现有模型的局限,如何构建更贴近临床的预临床模型是研究的关键。期待未来更多多学科交叉合作,推动HCC治疗新突破。
原始出处
Dai, S., Chen, Y., Cai, W. et al. Combination immunotherapy in hepatocellular carcinoma: synergies among immune checkpoints, TKIs, and chemotherapy. J Hematol Oncol 18, 85 (2025). https://doi.org/10.1186/s13045-025-01739-6
本文相关学术信息由梅斯医学提供,基于自主研发的人工智能学术机器人完成翻译后邀请临床医师进行再次校对。如有内容上的不准确请留言给我们。
猜你喜欢
- 正常女性白带颜色和白带异常治疗注意事项
- 这些食物是幽门螺杆菌的天敌,平时常吃有好处
- 【CCR】伊布替尼联合R-GemOx治疗non-GCB R/R DLBCL的II期研究
- Lancet子刊:老年女性收缩压低于120 mmHg,更有益大脑健康,减少认知障碍!
- 国家卫健委:7月7日新增新冠肺炎确诊病例97例其中本土病例47例
- 慢性光化性皮炎发病机制及治疗
- 【PNAS】肥胖促进血管生成,唤醒休眠肿瘤!最新研究揭示为何肥胖增加癌症风险
- 国庆假期临近,疫情防控政策划重点!
- 栗子的营养价值有哪些?栗子能用来煲什么汤?
- Clin Infect Dis:艾滋病病毒(HIV)感染儿童治疗非重症结核(TB)的治疗结果
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)