首页 > 医疗资讯/ 正文
原发性高草酸尿症1型是一种罕见的遗传性代谢疾病,由于肝脏特异性过氧化物酶体酶丙氨酸乙醛酸氨基转移酶缺陷导致内源性草酸过度产生,进而引发肾结石、肾钙质沉着和肾功能衰竭。超过60%的患者会发展为肾衰竭,这些患者由于草酸在多种组织中沉积而面临危及生命的全身性疾病风险。目前肝移植是唯一的治愈方法,而lumasiran作为一种RNA干扰疗法,通过阻断乙醇酸氧化酶的产生来减少草酸底物乙醛酸的生产,于2020年11月获得美国食品药品监督管理局和欧洲药品管理局的批准。基于一项三期试验的积极结果,但由于患者数量有限、高昂成本以及长期临床获益的不确定性,许多国家的医保系统难以迅速报销,导致全球范围内甚至欧洲国家内部在获取这种潜在有效药物方面存在显著差异。

这种情况并非lumasiran独有,许多有前景的昂贵孤儿药都面临类似障碍,包括目标患者群体小、临床多样性大、引入时真实世界长期临床获益不确定以及高成本。这些问题限制了在批准适应症范围内明确治疗对象和时机的知识,高成本往往需要漫长的价格谈判,进一步限制和延迟治疗可及性。这一现状促使包括临床医生、健康保险公司和患者代表在内的利益相关者开发了一种条件性和控制性访问孤儿药的协议,即孤儿药访问协议。该协议旨在为未满足需求且临床特征表明可能获益最大的选定患者提供相对快速的治疗和支付,同时收集额外的标准化数据以监测真实世界的临床有效性和副作用,从而使有前景的药物更早、更可控地惠及患者。lumasiran被选为ODAP的试点项目,本文旨在对该试点研究进行首次两年评估。
在方法上,国家ODAP指导小组与阿姆斯特丹大学医学中心的专家合作开发了针对儿童和成人原发性1型高草酸尿症(PH1)患者使用lumasiran的控制性和条件性治疗协议。该协议包含疾病信息、新药与其他疗法的比较、启动和停止标准以及评估标准。设立了一个指征委员会,包括来自荷兰各学术医疗中心的一名儿科和一名成人肾病学家。潜在符合条件的PH1患者由执行委员会讨论,该委员会由六名指征委员会成员组成,所有成员均为具有PH1经验的成人或儿科肾病学家。委员会工作均为自愿性质,每月举行会议讨论患者特征,需一致同意才能做出积极推荐。lumasiran的给药仅限于阿姆斯特丹的专家中心,并通过集群两名或以上患者来限制药物浪费。患者访视由研究护士和博士研究生执行。
表1:ODAP中的启动和停止标准
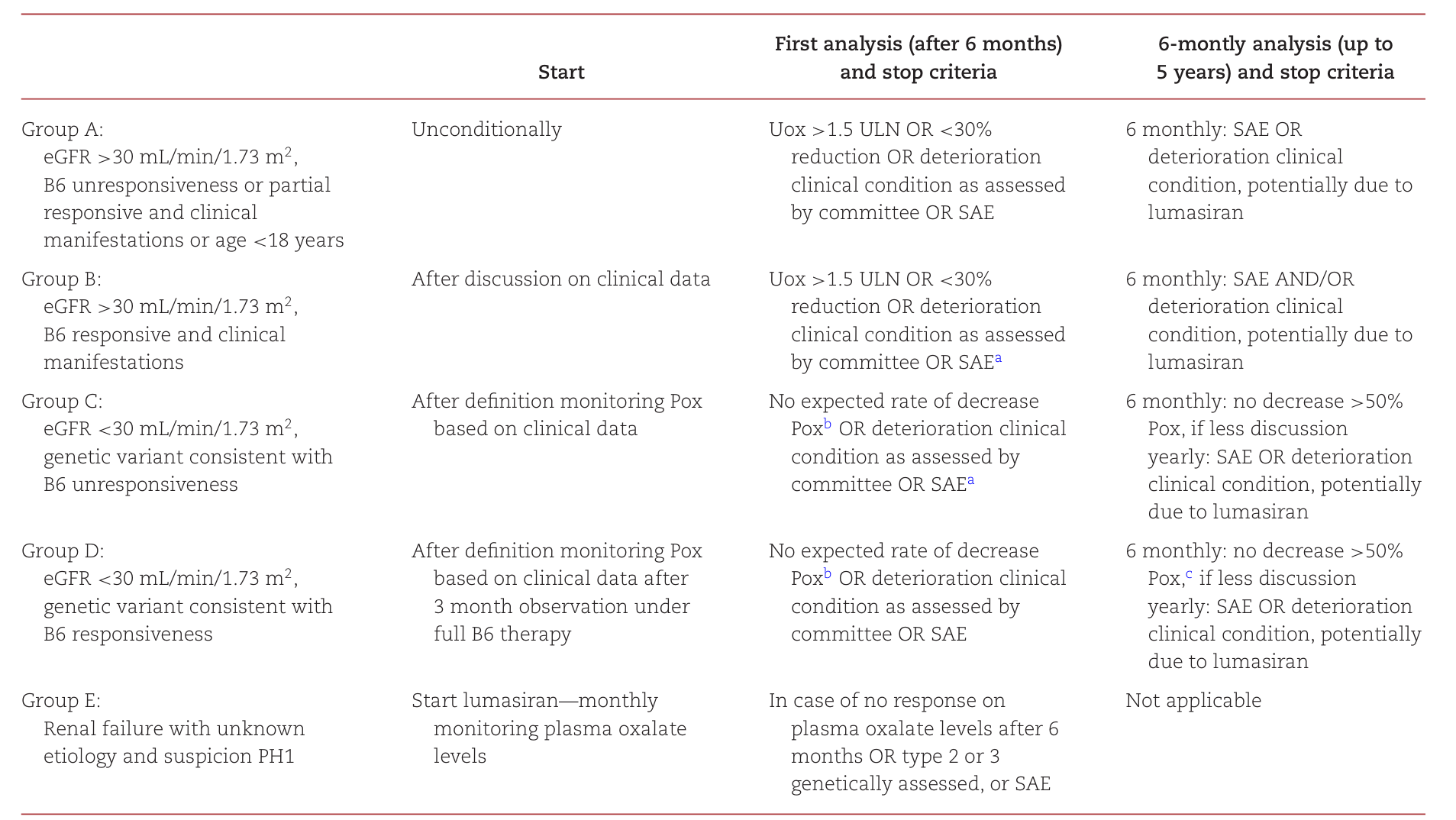
该协议基于最新的国际原发性高草酸尿症指南,包括区分维生素B6应答和非应答PH1患者。根据临床和生化特征决定是否在ODAP协议内启动lumasiran。患者必须加入ODAP并同意定期医疗数据收集,以监测治疗安全性和有效性,且需获得当地法规和阿姆斯特丹UMC机构审查委员会的批准,且未接受成功肝移植。监测包括肾功能、生命体征、尿液和血浆草酸、肾脏和尿路超声以及系统性草酸沉着症筛查。所有数据通过GCP认证的在线平台Castor EDC捕获在OxalEurope数据库中。患者需每三个月访问阿姆斯特丹UMC进行皮下lumasiran给药和监测。治疗剂量符合推荐剂量,协议随时间基于委员会经验进行了微小修改。
试点协议包括三个阶段。阶段一为0至6个月,基于生化效应评估药物有效性。阶段二为6个月至5年,基于临床状况监测治疗效果,由指征委员会根据预定义标准和不同患者类别进行评估。这两个阶段健康保险公司和制造商之间适用不同的保密价格协议,反映各阶段药物有效性的确定性。患者无自付费用。五年后最终数据将分析治疗效果,健康保险公司决定lumasiran是否永久报销,称为阶段三。分析中平均尿草酸和血浆草酸水平计算为启动lumasiran后6个月以上至最后一次随访测量的平均值。草酸减少计算为基线水平与平均随访水平之间的百分比减少。尿草酸正常化定义为小于0.5 mmol/24 h/1.73 m²或草酸与肌酐比值小于等于0.06 mmol/mmol,血浆草酸正常化定义为小于6.8 μmol/L。所有测量在同一实验室进行。成本节约使用荷兰标价计算,并通过加拿大药物和技术健康机构数据验证。药物准备采用小瓶共享协议,经药师审查后推荐在开启后24小时内使用无菌程序用于多剂量。
在结果方面,2022年9月1日至2024年9月1日期间,委员会审查了21名PH1患者,13名符合启动lumasiran治疗的标准。不合格原因包括对维生素B6治疗有充分应答和已接受成功肝移植。四名患者在最后一次随访时仍在评估中,需随访信息以做最终决定。七名患者从ILLUMINATE A和ILLUMINATE C试验过渡,三名患者从早期访问计划过渡到ODAP阶段二而无治疗中断。三名患者为RNAi初治并从ODAP阶段一开始lumasiran。在17名有明确决定的患者中,13名被批准使用lumasiran,包括七名RNAi初治患者中的三名。所有治疗患者均遵守协议访视,ODAP内随访时间为0.1至1.9年。
分组结果显示,A组七名患者eGFR大于30 mL/min/1.73 m²且致病变异与无或不充分维生素B6应答一致,全部符合治疗条件并直接进入阶段二。尿草酸平均减少与随访结果一致,0%至4%差异。最后一次随访时三名患者尿草酸水平正常化,四名低于1.5倍正常上限。eGFR随时间保持稳定,最大下降为5年内6 mL/min/1.73 m²。所有患者报告结石事件和尿路感染显著减少。B组四名患者eGFR大于30 mL/min/1.73 m²且为纯合子维生素B6应答致病变异,两名因对维生素B6应答良好被拒绝,肾功能稳定且无结石,另两名被批准。其中一名最初因维生素B6应答和尿草酸水平接近正常被拒绝,但后来发生梗阻性结石事件伴肾功能下降和草酸排泄增加,导致启动lumasiran。另一名尽管为纯合子c.508G>A变异,但持续高草酸尿症且维生素B6应答不足,对lumasiran反应良好。
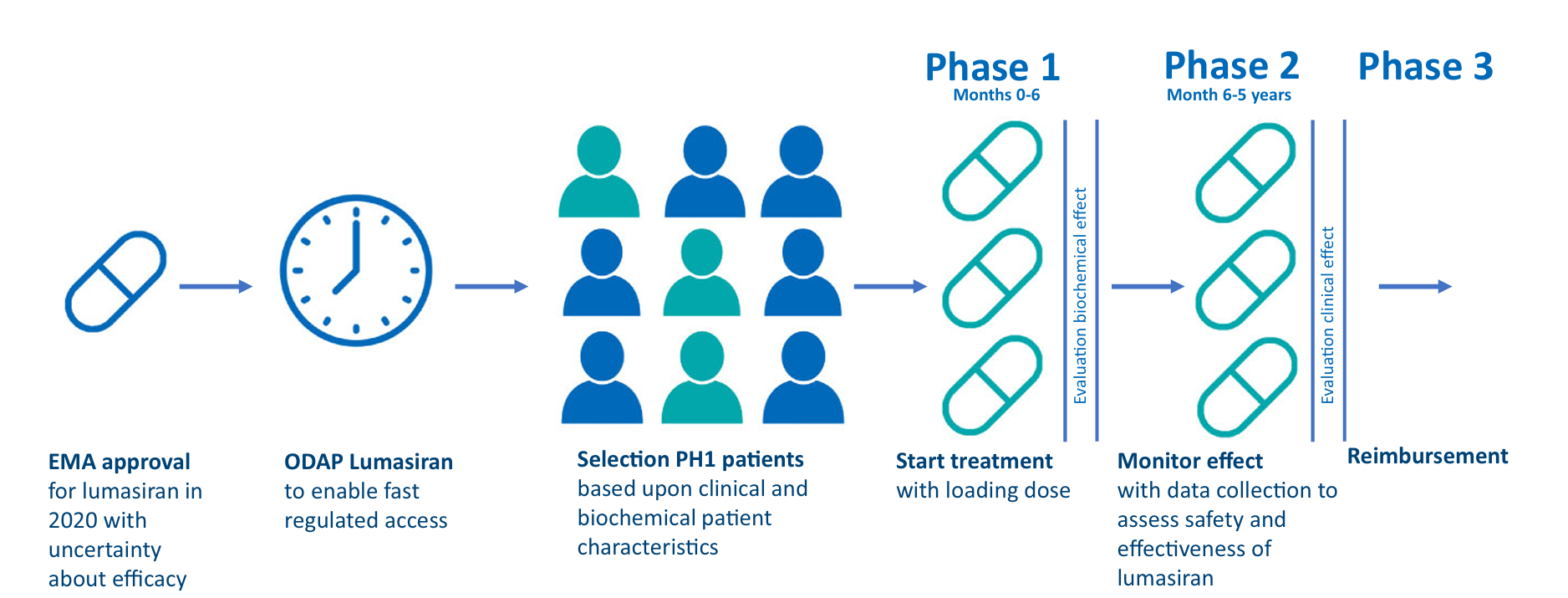
图1:ODAP协议概述
C/E组四名患者表现为肾衰竭且致病变异与维生素B6无应答相关,两名先前在早期访问计划中治疗并进入阶段二。第三名为4个月大婴儿,基于血浆草酸和乙醇酸水平在疑似PH1一周内治疗,诊断后经基因确认。所有三名患者接受肾移植,但两名患者单用lumasiran不足以达到肾移植安全值。一名患者联合使用nedosiran,另一名接受肝移植。一名患者尽管高草酸尿症和低eGFR被拒绝,因已接受肝移植,高草酸尿症归因于先前储存的系统性草酸。D组两名患者eGFR小于30 mL/min/1.73 m²且为复合杂合子c.508G>A和c.454T>A变异,一名因对维生素B6治疗应答良好被拒绝,尽管低eGFR源于晚期诊断。他接受成功单独肾移植,两年后eGFR为78且尿草酸排泄正常。另一名被批准因血浆草酸水平过高不适合肾移植,其lumasiran治疗反应仍在评估中。
总体随访显示,eGFR大于30患者尿草酸水平平均减少44%至84%,eGFR小于30患者血浆草酸水平减少30%至66%。所有ODAP前RNAi初治患者在最后一次随访时对lumasiran有良好生化反应,但未正常化。三名患者报告短暂注射部位反应,无其他副作用报告,无感染爆发。两年评估时13名患者中12名处于阶段二,一名处于阶段一因仅入组两个月。除接受肝移植患者外,无患者符合预设停止标准并中止治疗。成本方面,四名被拒绝患者中三名在其他欧洲国家可能符合治疗条件,其估计治疗成本为每年1,746,756至2,620,134欧元,导致当前两年ODAP轨迹估计成本减少2,953,201欧元。同时通过最小化浪费,每三个月节省约五个药瓶,基于两年ODAP随访结束时的患者数量,每年可节省约1,480,309欧元。所有患者前往阿姆斯特丹UMC的旅行时间单程小于两小时。
综上所述,ODAP lumasiran试点证明是优化罕见病护理和高效个性化使用昂贵孤儿药的成功形式。它为特定条件下lumasiran在PH1患者中的有效性提供了额外信息,并可作为独立的上市后监测,可能导致适应症调整。此外,ODAP提高了参与医生对PH1的普遍知识,因此该模型可作为未来罕见病领域其他新昂贵孤儿治疗访问路径的范例。该协议确保重症PH1患者快速访问和个性化管理,提供新见解于真实世界药物有效性,并通过控制访问仅治疗需要患者导致成本大幅减少。所有但一名基于临床确立良好维生素B6应答被拒绝患者有良好临床结局,而一名患者通过密切监测在重新评估后启动lumasiran。
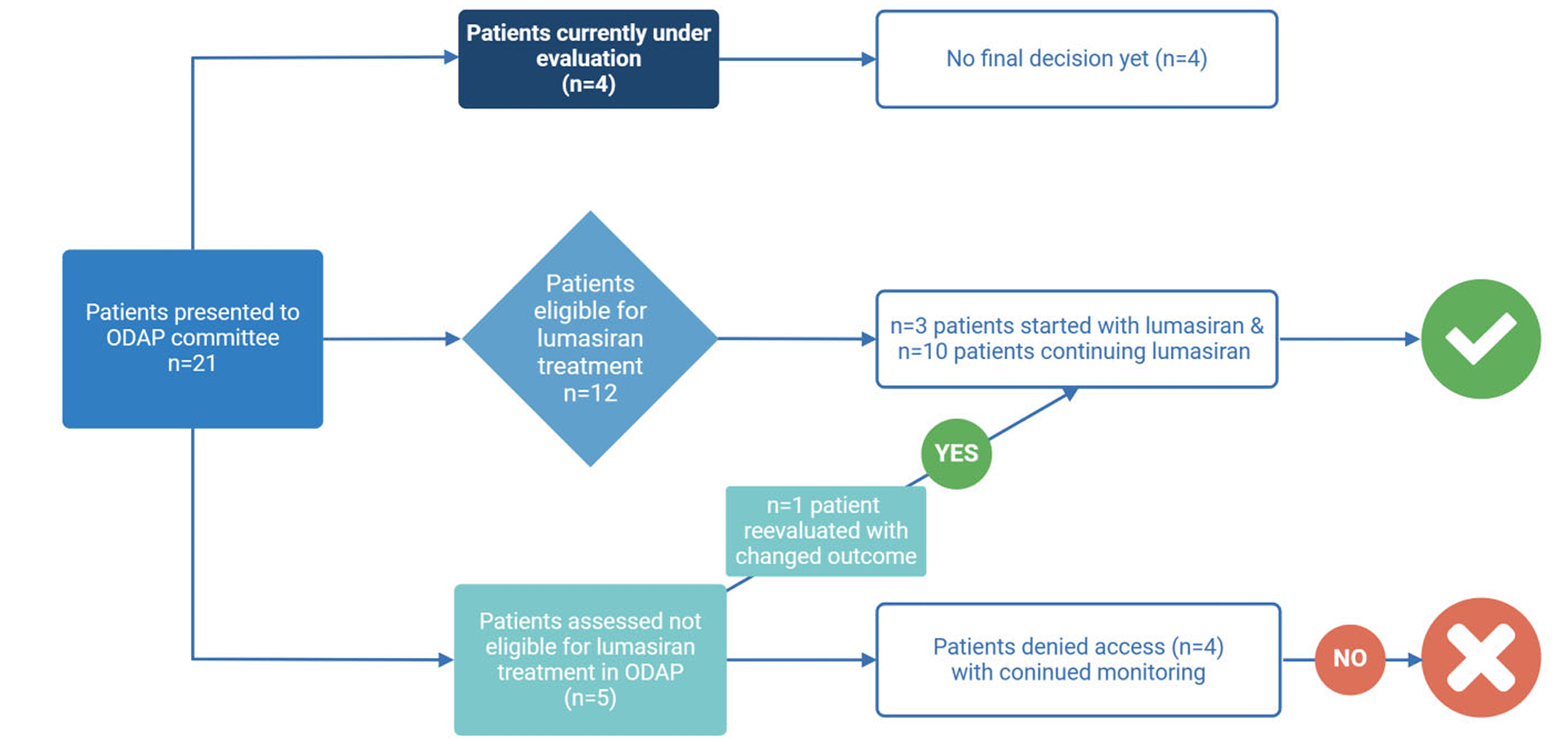
图2:ODAP协议中的患者流程图
ODAP在荷兰提供的快速访问使一名婴儿患者受益,其在诊断一周内开始治疗,避免延迟。协议通过专家个案评估确保最优个性化护理,仅对优化常规治疗应答不足患者给予lumasiran,24% PH1患者未给药。所有患者经多专家审查增强数据可靠性,持续警惕允许修订治疗建议。ODAP作为罕见肾病最优管理模型,通过专家组密切随访和与当地医生合作,贡献高质量PH1特定护理并增加医生知识。除患者获益外,协议有潜在社会效益,确保仅未满足需求和预期显著临床获益患者治疗,与较少严格协议国家对比。严格资格标准确保昂贵治疗仅用于强指征患者,导致成本减少。ODAP还保证对该昂贵疗法使用的洞察和监测,通过要求所有患者数据监测,收集高质量数据。所有评估在同一中心实验室进行,提供可靠可比数据,如四期试验。
在lumasiran获批时,PH1临床有效性数据稀缺,药物在维生素B6应答患者中影响未完全理解。目前了解到部分但非所有维生素B6应答变异患者可能对维生素B6应答至lumasiran无额外有益减少草酸生产程度。lumasiran在所有治疗患者中显示生化效应,但仅eGFR大于30患者中三名尿草酸水平完全正常化。ODAP中观察效应与扩展ILLUMINATE-A试验一致,无随访结果差异。还了解到lumasiran可作为对lumasiran应答良好但不完全患者的肝移植桥接治疗。额外数据将在五年ODAP试点剩余时间收集分析,包括额外临床终点。ODAP显示患者护理益处,但也有局限。主要临床局限是患者需遵守协议和严格门诊计划以集群患者避免浪费。从医生视角,参与ODAP耗时,但无疑对获得国家支持协议化使用lumasiran重要。
除lumasiran外,其他PH新治疗即将进入市场。当前ODAP轨迹试点可作为案例研究为这些未来新治疗吸取教训,并整合真实世界数据收集在早期阶段。未来进一步了解lumasiran成本有效给药方案将有趣。ODAP lumasiran试点成功格式为最优罕见病护理和高效个性化使用昂贵孤儿药,提供lumasiran在特定条件下有效性额外信息,可作为独立上市后监测可能导致适应症调整,增加医生对PH1普遍知识。因此该模型可作为未来罕见病领域其他新昂贵孤儿治疗访问路径范例。
原始出处:
Deesker LJ, Franssen CFM, Dorresteijn E, van de Kar NCAJ, Nurmohamed SA, Severs D, Garrelfs SF, Pisters-van Roy AAMG, Hollak CEM, Groothoff JW. Controlled access to lumasiran in primary hyperoxaluria type 1: evaluation of a new access route for orphan drugs in the Netherlands. Nephrol Dial Transplant. 2025;40:1887-1896. doi:10.1093/ndt/gfaf060
本文相关学术信息由梅斯医学提供,基于自主研发的人工智能学术机器人完成翻译后邀请临床医师进行再次校对。如有内容上的不准确请留言给我们。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)