首页 > 医疗资讯/ 正文
筛状桑葚状甲状腺癌(筛状桑葚样甲状腺癌,CMTC)是一种罕见的甲状腺恶性肿瘤,其组织发生尚不明确。它主要影响年轻女性,且与家族性腺瘤性息肉病密切相关。本文报告一例罕见的散发性筛状桑葚状甲状腺癌病例,患者为一名 50 岁出头的女性,体细胞检测显示存在KMT2C基因突变。患者表现为局限于右侧甲状腺叶的孤立性病变,无家族性腺瘤性息肉病家族史。结肠镜检查和胚系检测均未发现异常。这一发现提示KMT2C基因突变与散发性筛状桑葚状甲状腺癌之间可能存在关联。该恶性肿瘤的临床及影像学表现缺乏特异性,最终诊断依赖于常规病理检查和免疫组化分析。本报告提示临床需询问家族史并进行遗传学检测,从而有助于临床实现标准化的随访监测与管理。

▲摘自《2022年第五版WHO内分泌器官肿瘤分类》
背 景
筛状-桑葚型甲状腺癌是一种罕见的甲状腺恶性肿瘤,主要影响年轻女性,平均发病年龄为24岁,男女比例高达 61:1。1它与家族性腺瘤性息肉病(FAP)密切相关,但也可散发性出现。Harach等人 2 于 1994 年首次描述了这种肿瘤类型;他们将表现出滤泡状、筛状、实性和乳头状结构特征的甲状腺癌描述为一种独特的实体,并揭示了其与FAP的相关性。随后,1999 年,Cameselle-Teijeiro等人提出了甲状腺乳头状癌的筛状桑葚状亚型。2017 年,世界卫生组织(WHO)在《WHO内分泌器官肿瘤分类》中将筛状桑葚状亚型归类为甲状腺乳头状癌(PTC)的一种罕见亚型。然而,在 2022 年第五版《WHO内分泌与神经内分泌肿瘤分类》中,筛状桑葚状甲状腺癌从PTC亚型重新归类为细胞谱系不确定的肿瘤。据研究人员所知,目前尚无已记录的病例将KMT2C基因突变与散发性筛状桑葚状甲状腺癌相关联。本文报告一例伴有KMT2C突变的女性散发性筛状桑葚状甲状腺癌病例,并回顾相关文献,以加深对这种罕见疾病的认识。
病 例
患者女,50 岁,2024 年 1 月 29 日入院,一年前在常规体检中发现右侧甲状腺结节。患者无明显症状,未接受任何治疗。患者无颈部放疗史,也无甲状腺癌家族史。入院查体:颈部柔软,气管居中。右侧甲状腺叶可触及一大小约 2.5×1.5 cm的肿块,质地硬,无压痛,与周围组织无粘连,随吞咽活动。颈部未触及明显肿大淋巴结。彩色多普勒超声检查示:右侧甲状腺叶中部可见一低回声结节,大小约 17×17×26 mm(图1a、b)。结节边界不清,边缘不规则,弹性成像评分 3 分(图1c)。彩色多普勒血流显像示结节内部及周边可见丰富血流信号(图1d)。颈部计算机断层扫描(CT)示:右侧甲状腺叶可见一大小约 2.4×1.6 cm的稍低密度结节,伴有点状钙化(图1e),增强扫描呈不均匀强化(图1f)。肿瘤无甲状腺外侵犯,双侧未见明显淋巴结肿大。2024 年 2 月 1 日,患者行右侧甲状腺叶及峡部切除术。术中冰冻切片检查提示肿瘤为微小浸润性滤泡癌或玻璃样变梁状肿瘤,遂行右侧中央区淋巴结清扫术。
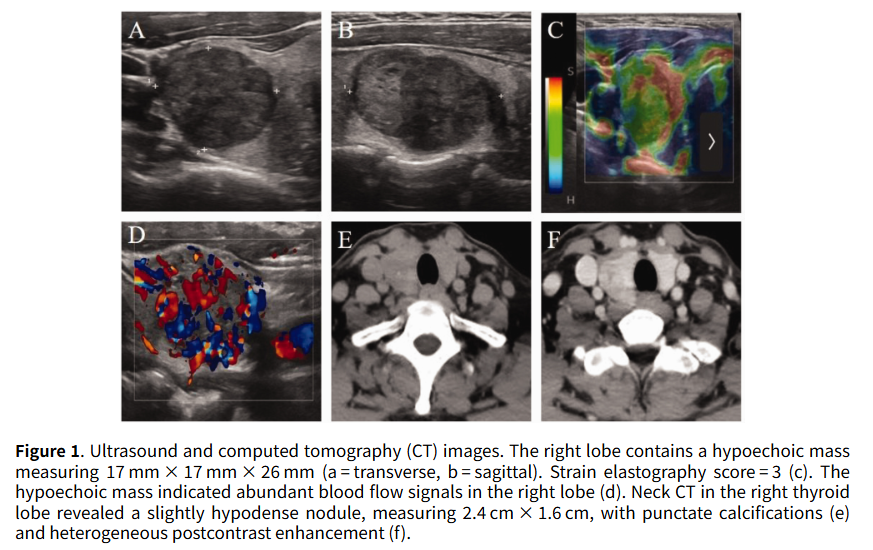
▲图1 超声和CT影像
术后病理显示甲状腺组织标本大小为 2.5×1.5×1.5 cm。切面呈灰白色至灰红色,实性、质硬,可见包膜,边界清晰(图2a)。镜下观察,肿瘤呈滤泡状、管状、筛状及实性巢状生长方式,伴显著的桑葚样结构及玻璃样变性区域(图2b、c)。肿瘤细胞呈轻至中度异型性,伴核拥挤(图2d)。可见血管侵犯(少于 4 个病灶);但未发现包膜侵犯、包膜外侵犯、腺内播散、神经侵犯或坏死。右侧中央区淋巴结未见转移。
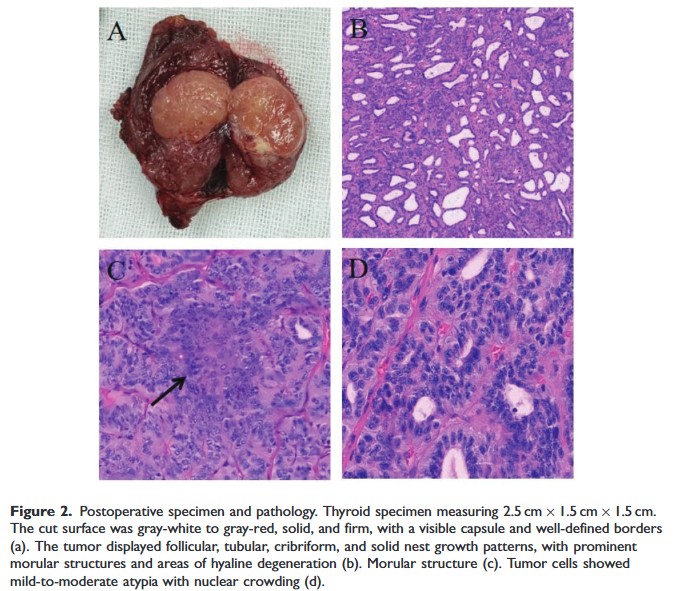
▲图2 术后标本和病理结果
免疫组化染色结果如下:β-连环蛋白在核和胞质区域均呈阳性(图3(a))。配对盒基因8(PAX8)呈部分弱阳性。嗜铬粒蛋白A(CgA)、突触素(Sy)、甲状腺球蛋白(TG)、降钙素(CT)及甲状旁腺激素(PTH)均呈阴性。Ki-67抗原呈阳性(2%–3%)。甲状腺转录因子1(TTF1)(图3b)、雌激素受体(ER)(图3c)、孕激素受体(PR)(图3d)及细胞角蛋白19(CK19)在筛状区域呈阳性,在桑葚样区域呈阴性。CD56抗原在少数细胞中呈阳性。尾型同源盒转录因子2(CDX2)(图3e)在桑葚样区域呈阳性,在筛状区域呈阴性。CD10抗原(图3(f))在筛状区域呈局灶阳性,在桑葚样区域呈阳性。
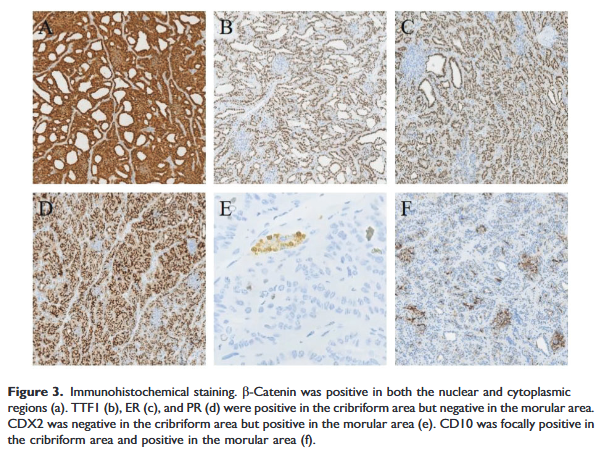
▲图3 免疫组化结果
胚系基因检测未发现相关突变。体细胞基因检测发现TERT启动子突变(c.-124C>T,C228T,突变丰度:12.06%)和KMT2C第32外显子突变(c.4664A>G,p.D1554G,突变丰度:53.36%)。根据病理及免疫组化结果,最终诊断为筛状桑葚状甲状腺癌,分期为pT2N0M0。患者对自身病情知情,并积极参与治疗方案制定。患者遵循随访计划,定期接受评估并监测治疗效果。术后,患者接受促甲状腺激素(TSH)抑制性左甲状腺素治疗,将血清TSH水平维持在正常或偏低范围。鉴于患者甲状腺球蛋白阴性且无淋巴结转移,未行放射性碘治疗。患者及其儿子均进行家族性腺瘤性息肉病(FAP)筛查并接受结肠镜检查,结果均为阴性。过去 11 个月,患者定期通过甲状腺功能检查、血清甲状腺球蛋白、抗甲状腺球蛋白抗体及颈部超声进行监测,均未显示复发或转移迹象。目前,患者仍在随访中。
讨 论
筛状桑葚状甲状腺癌是一种极为罕见的甲状腺恶性肿瘤,常表现为无痛性甲状腺肿大或在常规体检中偶然发现。大多数患者术前甲状腺功能正常,临床症状无特异性。超声检查通常显示良性特征,如边界清晰、椭圆形、低回声实性结节,常无低回声晕环或钙化,因此常被误诊为甲状腺滤泡性肿瘤或结节性甲状腺肿。确诊依赖于常规病理检查和免疫组化分析。
大体病理检查中,筛状桑葚状甲状腺癌通常表现为边界清晰、灰白色、质硬、质地坚韧的有包膜肿瘤,一般无坏死或出血,但偶尔可见囊性区域。组织学上,肿瘤呈乳头状、滤泡状、筛状、梁状及实性生长方式,伴同心圆桑葚样结构,类似鳞状上皮化生,但无角质珠或细胞间桥。乳头表面被覆柱状细胞,筛状区域由假复层排列的高柱状细胞构成,管腔内无胶质。尽管无核分裂象且砂粒体罕见,但肿瘤细胞核可表现出乳头状癌的特征,包括核拥挤、核重叠、核沟及核内假包涵体。本例肿瘤具有筛状桑葚状甲状腺癌的典型大体特征。然而,术中冰冻切片分析提示诊断为微小浸润性滤泡癌或玻璃样变梁状肿瘤,导致诊断不足。这凸显了临床医生和病理医生需要提高对这种罕见肿瘤的认识。
免疫组化染色在筛状桑葚状甲状腺癌的诊断中起关键作用,其特征为β-连环蛋白在细胞核和细胞质中强阳性表达。肿瘤细胞通常表达甲状腺转录因子1(TTF1)、雌激素受体(ER)和孕激素受体(PR),而甲状腺球蛋白(TG)部分阳性或阴性,降钙素阴性,Ki-67增殖指数通常<5%。桑葚样结构表达CD5、CD10、CDX2、CK5、半乳糖凝集素-3、E-钙黏蛋白及B细胞淋巴瘤2阳性,但TTF1、TG、ER和PR阴性。CDX2和CD10是识别桑葚样结构的关键标志物。本例中,β-连环蛋白在细胞核和细胞质中强阳性,TG阴性,Ki-67指数为 2%–3%。非桑葚样肿瘤细胞TTF1、ER、PR及CK19阳性,而桑葚样区域CDX2和CD10阳性。这些发现与文献报道一致。
筛状桑葚状甲状腺癌具有独特的分子遗传学特征。其与WNT/β-连环蛋白信号通路的激活相关,该通路激活由胚系或体细胞APC基因突变驱动,或由CTNNB1、AXIN1等基因的双等位基因失活引起。与乳头状甲状腺癌(PTC)及滤泡源性肿瘤不同,筛状桑葚状甲状腺癌主要发生于年轻女性,这可能与ER、PR和WNT/β-连环蛋白通路的相互作用有关,提示内分泌治疗的潜在途径,值得进一步研究。丝裂原活化蛋白激酶通路(如BRAF和RAS)突变在PTC中常见,但在筛状桑葚状甲状腺癌中罕见,凸显其与PTC的分子差异,支持将其重新分类为独立的肿瘤实体。本例中,考虑到该患者为 50 多岁女性,已绝经 10 年,女性激素可能未在其癌症进展中发挥作用。基因分析未发现BRAF、RAS或PIK3CA突变,进一步证实了筛状桑葚状甲状腺癌与其他甲状腺癌相比具有独特的分子特征。同时,基因检测未发现APC和CTNNB1突变,但患者未行AXIN1检测。鉴于AXIN1与WNT/β-连环蛋白通路的关联,不能排除该基因突变对患者病情的潜在影响。
区分家族性与散发性筛状桑葚状甲状腺癌对有效临床监测至关重要。家族性筛状桑葚状甲状腺癌通常表现为累及双侧甲状腺叶的多灶性肿瘤,而散发性筛状桑葚状甲状腺癌通常表现为局限于单侧叶的孤立性结节。疑似家族性筛状桑葚状甲状腺癌的患者应尽早进行家族性腺瘤性息肉病(FAP)筛查并积极随访。FAP是一种由APC基因突变引起的常染色体显性遗传病,可导致WNT/β-连环蛋白信号通路激活,促进肿瘤发生。约 50% 的筛状桑葚状甲状腺癌病例与FAP相关,大多数最初表现为筛状桑葚状甲状腺癌,尽管也存在散发病例。Cameselle-Teijeiro等人和Aydemirli等人的研究报道了散发性筛状桑葚状甲状腺癌中存在APC突变。因此,家族性和散发性筛状-桑葚型甲状腺癌均常存在APC基因突变。区别在于,在FAP和家族性筛状桑葚状甲状腺癌中,APC突变为胚系突变,导致APC蛋白缺失或功能异常。相反,散发性筛状桑葚状甲状腺癌由APC、CTNNB1、AXIN1和/或KMT2D的体细胞突变引起。因此,胚系APC突变检测被认为是诊断家族性筛状桑葚状甲状腺癌的金标准。本例患者表现为局限于右侧甲状腺叶的孤立性病变,无FAP家族史。结肠镜检查及胚系基因检测均未发现异常,有效排除了FAP,提示为散发性筛状桑葚状甲状腺癌。
KMT2C是KMT2基因家族的成员,该基因突变与多种肿瘤密切相关。表1中,我们总结了KMT2C突变在常见癌症中的潜在机制,包括乳腺癌、肺癌、结直肠癌及神经系统肿瘤。此外,Nieminen等人研究了与家族性腺瘤性息肉病(FAP)相关的筛状桑葚状甲状腺癌病例中KMT2D和KMT2C体细胞突变的共存情况。他们提出,这些突变通过WNT信号通路促进肿瘤发生,从而成为甲状腺癌的驱动因素。在本文散发性筛状桑葚状甲状腺癌病例中,检测了多个基因,包括APC和KMT2D。尽管这两个基因均为阴性,但检测到了KMT2C的体细胞突变。本报告首次描述了散发性筛状桑葚状甲状腺癌病例中KMT2C的体细胞突变。该患者中KMT2C体细胞突变的检测提示其可能与散发性筛状桑葚状甲状腺癌相关,其潜在机制可能涉及WNT/β-连环蛋白通路。尽管单病例检测存在局限性,但该发现为进一步研究KMT2C在散发性筛状-桑葚型甲状腺癌发病机制中的作用提供了有价值的见解。然而,仍需进一步研究以证实其广泛适用性。
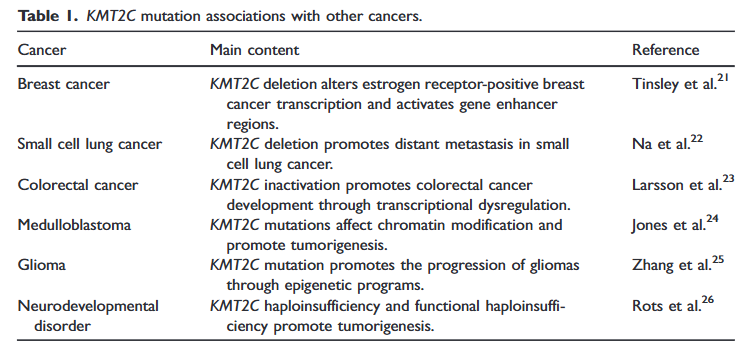
▲表1 KMT2C突变与其他癌症的关联
筛状桑葚状甲状腺癌的当前治疗方案在很大程度上遵循分化型甲状腺癌的指南。对于无高危因素的散发性筛状桑葚状甲状腺癌,甲状腺腺叶切除术已足够且可接受。然而,高危病例(包括高级别或广泛浸润性肿瘤、广泛脉管浸润或甲状腺外侵犯)需行甲状腺全切术。对于家族性腺瘤性息肉病(FAP)相关的筛状桑葚状甲状腺癌,由于常存在多中心性和双侧性,甲状腺全切术是必须的。必要时进行淋巴结清扫术,放射性碘治疗可用于处理残余病灶。筛状桑葚状甲状腺癌的初始淋巴结转移率为 12%,远处转移罕见,但已有肺转移的报道。总体而言,预后通常良好,手术切除后复发率和死亡率较低。本例患者表现为单侧甲状腺叶的孤立性病变,分期为T2N0M0。患者接受了右侧腺叶切除术、峡部切除术及右侧中央区淋巴结清扫术。术后 11 个月的随访未发现复发或转移。然而,与甲状腺癌的中位生存期相比,总体随访时间仍相对较短,需关注长期随访结果。
总之,本文报告了一例罕见的中年女性散发性筛状桑葚状甲状腺癌病例,体细胞检测显示KMT2C突变。这一发现提示KMT2C突变与散发性筛状桑葚状甲状腺癌之间存在潜在关联,强调了基因检测在这种罕见恶性肿瘤诊断中的重要性。对于筛状桑葚状甲状腺癌的诊断和管理,尤其是在具有非特异性临床和影像学特征的病例中,病理形态学和免疫组化染色仍是防止术前超声或术中冰冻切片分析低估的关键。然而,仅依赖这些诊断方法可能不足以进行准确诊断和预后评估,尤其是随着基因突变在预测癌症进展中日益发挥关键作用。本病例强调,临床医生和病理医生需提高对这种罕见恶性肿瘤的临床病理特征、治疗和预后的认识(如更新的WHO分类所述),并将基因检测视为综合诊断和管理策略的一部分。研究人员建议将家族史评估和基因检测纳入常规临床实践,以指导筛状桑葚状甲状腺癌患者的随访和管理。
实体瘤全外显子组基因检测项目覆盖文中提到的KMT2C、APC、CTNNB1、AXIN1、KMT2D基因,可辅助临床诊疗,预测可能获益的靶向、免疫、化疗等治疗方案,辅助预后和遗传评估。
参考文献:
Gao Y, Ding J, Xu J, Chen J, Du W. KMT2C mutation in sporadic cribriform morular thyroid carcinoma: A rare case report and review of literature. Journal of International Medical Research. 2025;53(4). doi:10.1177/0300060525132678
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)