首页 > 医疗资讯/ 正文
摘要
目的 探讨癫痫持续状态患者共患病对其预后的影响因素,改良共患病负担指数评分(ICBI)并分析其在中国西部地区以及非惊厥性癫痫持续状态的实用性。方法 收集2016年12月—2022年12月四川大学华西医院神经内科、ICU、急诊科共396例癫痫持续状态患者,所有患者均符合国际抗癫痫联盟(ILAE)最新的癫痫持续状态诊断标准(2015年)。采用SPSS 22.0进行统计学分析,使用Logistic回归分析患者住院死亡及预后不佳(GOS评分为1~3分)的影响因素;将共患病负担指数(CBI)评分改良为ICBI评分,增加免疫系统疾病、甲状腺功能疾病、低蛋白血症3种共患病,并将重复项进行合并,每一项共患病得1分,计算总分;MedCalc ROC曲线对其进行预测价值分析,采用ROC曲线下面积大小(AUC)反映ICBI量表的诊断价值。结果 纳入该研究的396例癫痫持续状态患者中有43例(10.9%)住院死亡,114例(28.8%)预后不良。消化系统、呼吸系统、肾脏及泌尿系统、电解质/酸碱平衡失调、感染、免疫系统疾病是癫痫持续状态发生住院死亡的危险因素。消化系统、呼吸系统、肾脏/泌尿系统、电解质/酸碱平衡失调、低血糖/高血糖、感染、凝血和血液疾病、神经系统疾病、心血管系统疾病、免疫系统疾病、肌肉骨骼相关疾病是癫痫持续状态患者预后不良的危险因素。使用ROC曲线分析,当ICBI>3,住院死亡ROC曲线下面积为0.914,特异度为71.37%,敏感度为97.67%,P<0.000 1;当ICBI>3时,预后不良ROC曲线下面积为0.882,特异度为81.56%,敏感度为79.82%,P值<0.000 1。惊厥性癫痫持续状态共327例,其中死亡41例,当ICBI>3,住院死亡曲线下面积为0.915,P<0.000 1。预后不良共100例,当ICBI>3,预后不良曲线下面积为0.867,P<0.000 1。结论 中国四川地区癫痫持续状态患者住院病死率约10.9%,ICBI >3分对于预测癫痫持续状态的住院死亡及预后不良均具有一定意义。对于惊厥性癫痫持续状态和非惊厥性癫痫持续状态,ICBI评分无明显差异。
关键词:癫痫持续状态;共患病;预后;改良共患病负担指数评分
Key words:Status epilepticus;Comorbidities;Prognosis;Improved Comorbidity Burden Index
癫痫持续状态(status epilepticus,SE)是神经内科最常见的危急重症之一[1],其主要特征是持续的癫痫发作持续5 min以上或多次发作期间意识未恢复[2],具有难以预测、病情复杂、进展迅速的特点,有很高的致残率及致死率[1,3,4]。据报道,SE病死率在3%~33%[5,6],中国西南地区的惊厥性SE病死率为15.4%~15.8%[6]。近年来,关于SE的预后研究很多,包括多种量表和生物学标志物[3,7-9]。有研究评估了社会人口学和临床特征中死亡率、神经功能障碍和与SE相关的预后因素的差异,表明新发SE与大量死亡和残疾有关[7]。虽然SE相关的死亡率在成年人中较高,但残疾在儿童和青少年中发展得更为普遍[7,10]。全身共患病在SE患者中很常见[9,11],共患病的种类和数量对患者的预后可能都有一定影响[8,9,12],但关于共患病对癫痫持续患者预后的研究仍较少,因此本研究旨在探讨SE患者共患病对其预后的影响因素。
与此同时,Leena等[13]提出了共患病负担指数(Complication Burden Index,CBI),并对患者进行了13种共患病类别的评估,利用受试者工作特征(receiver operating characteristic curve,ROC)曲线得出最大的CBI评分为13分,平均CBI为3.8分,预测功能结果差的截点为大于3分。由于其建立的CBI评分纳入患者数量较少,且只纳入了发作时间>30 min的惊厥性SE患者[13]。因此本研究亦期望同时探讨改良共患病负担指数 (Improved Complication Burden Index,ICBI)评分并评估是否适用于中国四川人群,以及在非惊厥性SE中的可行性。现报告如下。
1 资料与方法
1.1 研究对象
选择2016年12月—2022年12月四川大学华西医院来自急诊、神经重症监护室(neurological intensive care unit,NICU)、神经内科、神经外科的SE患者。纳入标准(全部满足):(1)符合国际抗癫痫联盟(International League Against Epilepsy,ILAE)最新的SE诊断标准(2015年)[1]:超过5 min的连续癫痫发作或2次或更多次分散的癫痫发作,其间意识不完全恢复;(2)自愿并获得其知情同意权的SE患者;(3)年龄≥18岁;(4)已接受脑电图检查的患者;(5)所有患者的治疗均按照2016年美国抗癫痫协会癫痫持续治疗流程来治疗[14]。排除标准(任意满足一条):(1)脑电图为发作间期脑电图的SE患者;(2)既往有严重的精神病患者;(3)未取得完整数据的患者。
1.2 研究方法
1.2.1 分组
将所有SE患者分为住院死亡、预后不良、预后良好3组,预后不良的评价指标定义为格拉斯哥评分(Glasgow Outcome Scale,GOS)评分1~3分(1分:死亡,2分:植物生存仅有最小反应,3分:重度残疾,日常生活需要照料)。
1.2.2 ICBI评分的定义
研究包括St.Germaine-Smith推荐的33种共患病[12]及CBI评分纳入的13种共患病[13]:呼吸系统、心血管系统、神经系统、肾脏、肝脏、凝血功能、胃肠道和骨骼肌肉系统、电解质/酸碱平衡,感染,低血糖/高血糖,皮肤/过敏反应和精神障碍,将其进行归纳、筛选,如高血糖及低血糖可算为一类,电解质失衡、酸碱平衡紊乱可算为一类,同时需去除SE病因。因此共患病的定义为在SE期间共患的疾病但不包括引起癫痫持续的因素,包括皮肤过敏反应、肌肉骨骼相关疾病、消化系统疾病、甲状腺功能疾病、呼吸系统疾病、免疫系统疾病、肾脏及泌尿系统疾病、电解质/酸碱平衡紊乱、低血糖/高血糖、低蛋白血症、感染、血液系统疾病、精神疾病、神经系统疾病(不包括SE病因如脑肿瘤、急性脑卒中等)、心血管系统疾病。无论共患病的严重程度或累及多个系统,均只计算1次,共患病最多为15种(见表1)。

1.3 观察指标
1.3.1 结局指标
本研究的主要结局指标为住院死亡,次要结局指标为预后不良。
1.3.2 定义与分类
脑电图异常为局灶性癫痫或者癫痫样放电,弥漫或者多灶分布的慢波节律)。SE包含惊厥性SE及非惊厥性SE。惊厥性SE可分为早期SE、确定性SE、难治性SE、超级难治性SE。
SE的分类[1]:(1)非惊厥性 SE是指持续脑电发作导致的非惊厥性临床症状,通常定义为发作>30 min,诊断非惊厥性SE需具有明确的、可证实的超过30 min的行为、意识状态或感知觉改变;并具有脑电图持续或接近持续的阵发性放电。(2)全面性惊厥性SE进行分类。早期SE,癫痫发作>5 min;确定性 SE,癫痫发作>30 min;难治性SE,发作通常>60 min,对二线药物治疗无效,需全身麻醉治疗;超级难治性SE,全身麻醉治疗24 h仍不能终止发作,其中包括减停麻醉药物过程中复发。
1.4 统计学分析
符合正态分布的计量资料采用(x̅±s)表示,预后良好与预后不良2组间比较采用完全随机的方差分析;不符合正态分布的计量资料采用中位数(最小值,最大值)表示,预后良好与预后不良2组间比较采用Mann-Whitney U非参数检验进行。计数资料采用例数和百分比表示,预后良好与预后不良2组间比较采用χ2检验。等级资料采用Kruskal-Wallis H秩和检验。SE患者共患病对其预后的危险因素的筛查采用Pearson χ2检验进行单因素分析,P<0.05具有统计学意义。将单因素分析中P<0.20的影响因素纳入多因素二分类Logistic回归分析,评估并发症发生的危险因素,计算比值比(odds ratio,OR)及其 95% 置信区间(confidence interval,CI)。双侧检验水准α=0.05。
采用MedCalc统计分析软件,ROC曲线下面积[15]反映量表的诊断价值大小:(0.50,0.70]表示诊断价值较低;(0.70,0.90]表示诊断价值中等;>0.90表示诊断价值较高,但P<0.05为有统计学意义。ROC图是以敏感度(真阳性率)为纵坐标,1-特异度(假阳性率)为横坐标,可以得到量表的最佳诊断标准,以及在该标准下诊断试验的灵敏度和特异度。
2 结果
2.1 一般资料
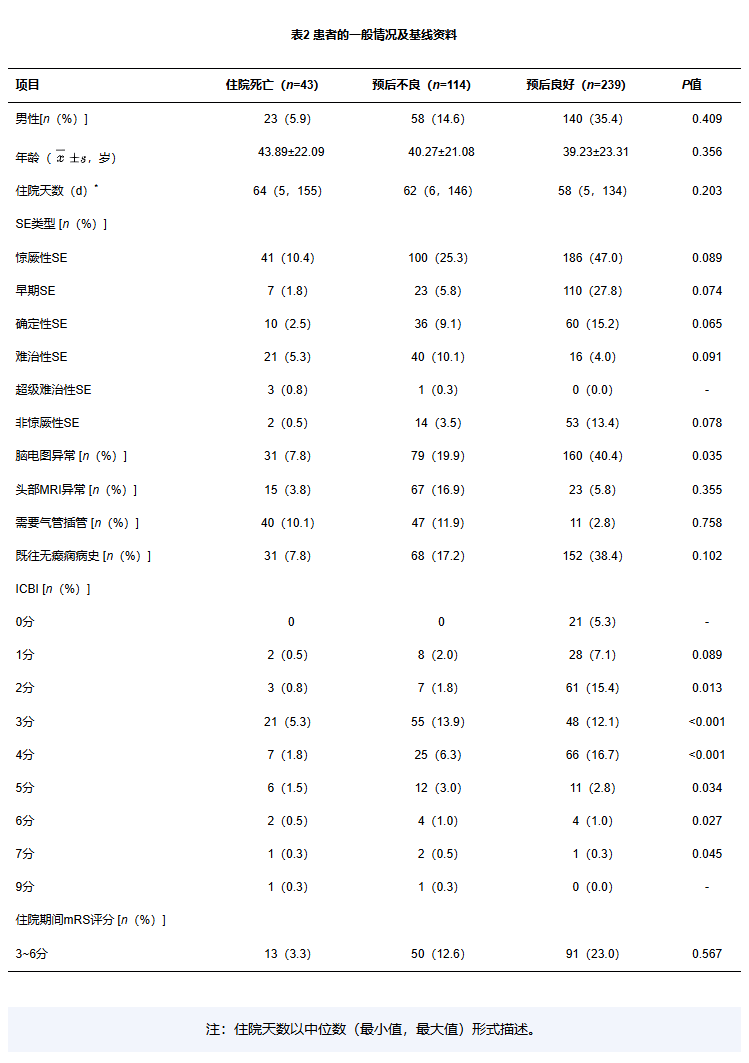
共纳入患者396例。其中,男221例(55.8%),女175例(44.2%),年龄(42.89±21.09)岁;住院死亡43例(10.9%),预后不良114例(28.8%),预后良好239例(60.4%)(见表2)。
2.2 SE住院死亡及预后不良危险因素分析
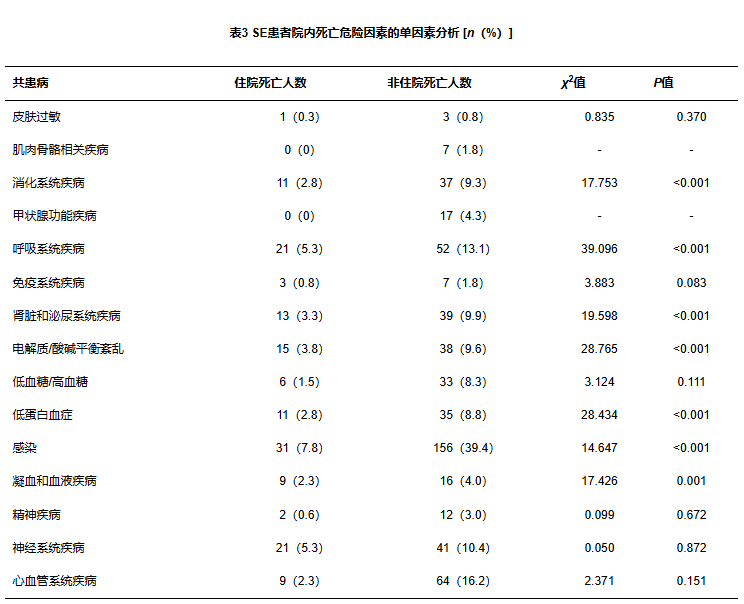
在396例SE患者中,发生皮肤过敏反应4例、肌肉骨骼相关疾病7例、消化系统疾病48例、甲状腺功能疾病17例、呼吸系统疾病73例、免疫系统疾病10例、肾脏及泌尿系统疾病52例、电解质/酸碱平衡紊乱53例、低血糖/高血糖39例、低蛋白血症46例、感染187例、凝血及血液疾病25例、精神疾病14例、神经系统疾病62例、心血管系统疾病73例,共死亡43例。
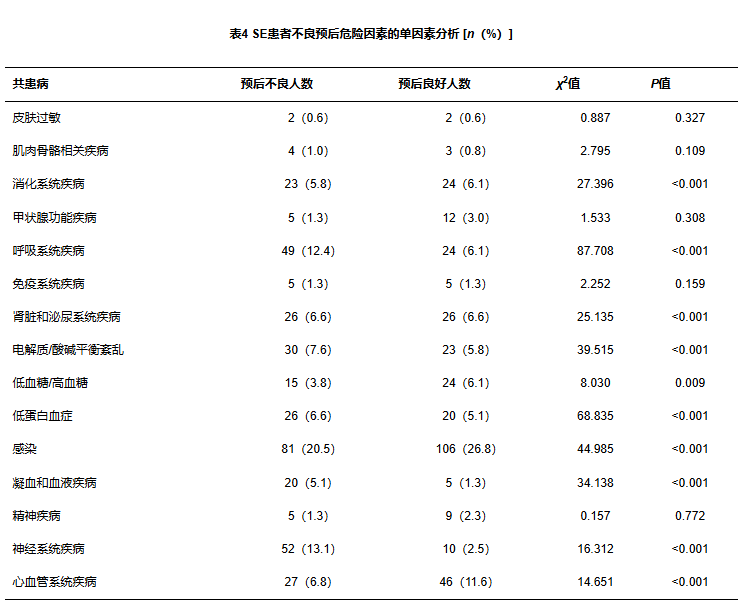
由表3可见,单因素分析显示消化系统、呼吸系统、低蛋白血症、肾脏及泌尿系统、电解质/酸碱平衡失调、感染、凝血和血液疾病、低蛋白血症是SE发生住院死亡的危险因素;表4可见消化系统、呼吸系统、肾脏/泌尿系统、电解质/酸碱平衡失调、低血糖/高血糖、感染、凝血和血液疾病、神经系统疾病、心血管系统疾病、低蛋白血症是SE患者预后不良的危险因素。
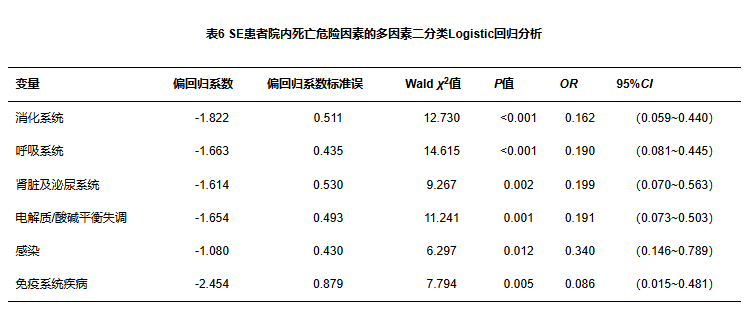
将单因素分析表3中P<0.20的因素纳入多因素二分类Logistic回归分析,以是否死亡为因变量,以单因素分析中P<0.20的因素为自变量,赋值情况见表5。由表6可见,消化系统、呼吸系统、肾脏及泌尿系统、电解质/酸碱平衡失调、感染、免疫系统疾病与住院死亡的危险性相关(P<0.05);模型检验结果表明自变量和因变量关系显著(P>0.05),拟合优度评价结果:Hosmer-Lemeshow χ2=1.000,P=0.910。

将单因素分析表4中P<0.20的因素纳入多因素二分类Logistic回归分析,以预后是否良好为因变量,以单因素分析中P<0.20的因素为自变量,赋值情况见表7。由表8可见,消化系统、呼吸系统、肾脏/泌尿系统、电解质/酸碱平衡失调、低血糖/高血糖、感染、凝血和血液疾病、神经系统疾病、心血管系统疾病、免疫系统疾病、肌肉骨骼相关疾病与预后不良的危险性相关(P<0.05);模型检验结果表明自变量和因变量关系显著(P>0.05),拟合优度评价结果:Hosmer-Lemeshow χ2=4.559,P=0.601。

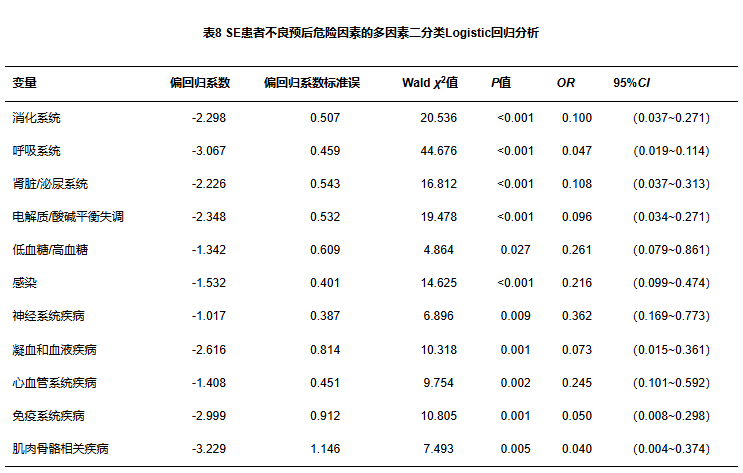
2.3 SE患者共患病分析
396例患者中平均共患病数量为2.98种(具体见表2及表8)。共死亡43例,使用MedCalc ROC曲线进行分析,当ICBI>3时,准确性为高等(见图1A)。预后不良共114人,当ICBI>3时,准确性为中等(见图1B)。
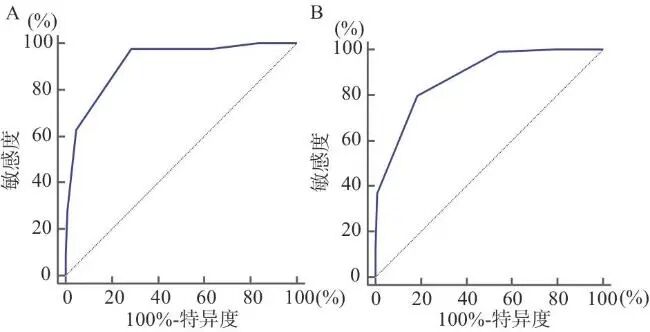
图1 ICBC评估SE患者的ROC曲线
注:A,住院死亡;B,预后不良。
2.4 惊厥性SE与非惊厥SE比较分析
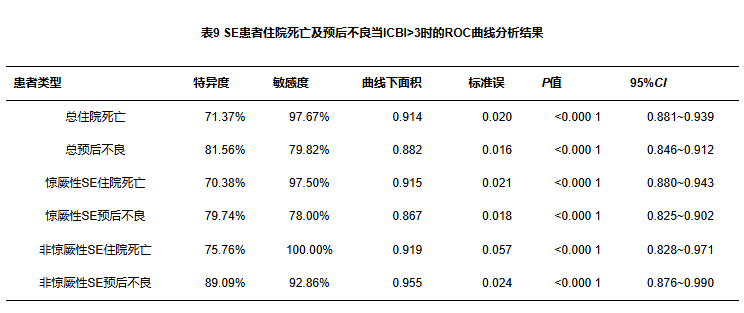
惊厥性SE共327例,其中死亡41例,当ICBI>3时,准确性为高等(见图2A);预后不良共100例,当ICBI>3时,准确性为中等(见图2B)。非惊厥性SE共43例,其中死亡2例,当ICBI>3时,准确性为高等(见图3A);预后不良共14例,当ICBI>3时,准确性为高等(见图3B)(见表9)。
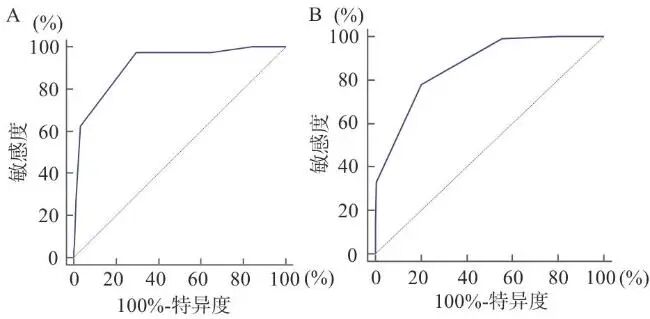
图2 ICBC评估惊厥性SE患者的ROC曲线
注:A,住院死亡;B, 预后不良。
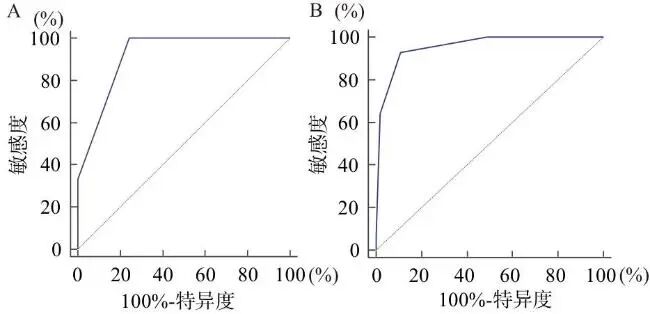
图3 ICBC评估非惊厥性SE患者的ROC曲线
注:A, 住院死亡;B, 预后不良。
3 讨论
SE是常见的神经科危急重症之一[4,16],常常会导致永久性的神经系统损[17-19],具有高发病率、高致残率和高病死率的特点[20,21]。因此,快速对患者进行病情评定和病死率的预测尤为重要,可以客观的制定和修正医疗护理计划,提高医疗质量,合理利用医疗资源。中国西南地区的惊厥性SE病死率为15.4%~15.8%[6]。本研究纳入396例患者中有43例为住院死亡,死亡率约10.9%,与既往中国西南地区研究的死亡率基本一致。
本研究显示消化系统、呼吸系统、肾脏及泌尿系统、电解质/酸碱平衡失调、感染、免疫系统疾病是SE发生住院死亡的危险因素。消化系统、呼吸系统、肾脏/泌尿系统、电解质/酸碱平衡失调、低血糖/高血糖、感染、凝血和血液疾病、神经系统疾病、心血管系统疾病、免疫系统疾病、肌肉骨骼相关疾病是SE患者预后不良的危险因素,与既往研究结果基本一致。目前国际上常用的5个预测SE患者预后的评分量表,包括基于流行病学死亡率的SE评分(Epidemiology-Based Mortality Score in Status Epilepticus,EMSE)[3,22],END-IT评分(END-Tracheal Intubation-Score)[6],SE严重程度评分(Status Epilepticus Severity Score,STESS)[2,22],改良STESS评分(modified Rankin Score-Status Epilepticus Severity Score,mSTESS)[23]和共患病负担指数评分(Complication Burden Index,CBI)[13]。
EMSE评分是由Leitinger等[3]于2015年根据流行病学资料设计的预测住院期间死亡率的评分,选取病因、年龄、合并症以及脑电图特征作为评价项目,每个项目里面包含4~15个分值不等的细化指标。END-IT评分由Gao等[6]发表于2016年,是目前唯一一个预测SE患者出院3个月后肢体功能恢复情况的评分,包括脑炎与否、是否合并非惊厥性SE、是否有地西泮抵抗、神经影像学特征以及是否进行气管插管5项内容END-IT评分总分为6分,其节点值(3分)的敏感度为83.87%,特异度为68.57%。
STESS是针对SE预后的第一个评分,由Rossetti等[2]发表于2006年,STESS评分主要包括4个入院指标:意识水平、发作类型、年龄以及癫痫病史,总分6分,STESS≤2分时,预后良好,死亡风险低。mSTESS将入院时的改良Rankin评分(modified Rankin Scale,mRS)与STESS评分相结合,并且将年龄的节点值提高到70岁,提高了STESS评分预测的准确性,降低了对年龄超过65岁且无癫痫史患者的预测误差[23]。
2018年,Leena等[13]提出了CBI,对患者进行了13种共患病类别的评估。而我们将CBI评分加以改良,新增加了免疫系统疾病、甲状腺功能疾病、低蛋白血症等3种共患病,因这三类疾病对患者预后也存在一定影响,如系统性红斑狼疮、甲状腺功能亢进/减退等。并且将肝脏系统与胃肠道疾病合并为消化系统,避免重复计算;凝血功能拓展为血液系统,需包括白血病、特发性血小板减少等对患者预后影响较大的因素;泌尿系统合并纳入进肾脏系统,如泌尿道损伤等。本研究未将肿瘤(已排除SE病因)这一明显影响患者预后不佳因素单独列入考量是因为已将其分系统纳入消化系统、呼吸系统等。
目前,本研究所纳入SE患者平均共患病数量为2.98种,这与Leena等[13]得出的平均CBI为3.8分存在一定差异。究其原因可能存在以下几个方面:(1)本研究纳入的SE患者均按照最新SE定义[1],将持续时间为5~30 min即早期SE患者纳入研究,纳入患者样本量及范围较既往研究扩大,且T1时间SE患者共患病数量较少,住院时间较短,预后较好;(2)本研究纳入了非惊厥性SE患者;(3)随着医疗技术的不断发展,医疗人员在防治共患病方面的意识及改善都在不断进步,共患病总体有减少趋势;(4)本研究对可能是SE病因的因素全部排除共患病的计算,如肿瘤、代谢性脑部、自身免疫性脑炎及急性脑卒中等;(5)当共患病累及多个系统时严格按照只计算一次的标准执行,如患者同时发生尿路感染、肺部感染、血液系统感染时只计算1次。本研究显示SE患者ICBI评分用于预测住院死亡和预后不良的截点为3,与Kämppi等[13]得出结果相一致。
对于惊厥性SE,预测住院死亡及预后不良的截点为3,而对于非惊厥性SE,预测住院死亡预后不良的截点同样为3。本研究将非惊厥性SE患者进行单独分析,证明其对非惊厥性SE患者的住院死亡及预后不良也存在一定的预测价值,与惊厥性SE相比无显著差异。改良ICBI评分操作简单,能在较短时间内完成,较既往的EMSE及STESS评分更加侧重于SE患者住院期间出现并发症对预后的影响,使得预测SE预后的评分更加丰富,且填补了非惊厥性SE预测量表方面的空白。
本研究纳入的患者均来自同一医疗机构,可能存在一定选择偏倚。本研究由1位医生判断评分,可能存在一定的偏移,在之后的研究中希望有2位医生同时评分,尽量取得较为准确的评分结果。因此,评估SE患者的预后可能还需要更多的量表或指标,并且还需要进行更大规模的多中心研究以进一步验证。
综上所述,中国四川地区SE患者住院病死率约10.9%,ICBI>3分,对于预测SE的住院死亡及预后不良均具有一定意义。关于惊厥性SE及非惊厥性SE,ICBI在预测其住院死亡及预后不良无显著差异。
参考文献
[1] Trinka E, Cock H, Hesdorffer D, et al. A definition and classification of status epilepticus--Report of the ILAE Task Force on Classification of Status Epilepticus[J]. Epilepsia, 2015, 56(10): 1515-1523.
[2] Rossetti AO, Logroscino G, Milligan TA, et al. Status epilepticus severity score (STESS): a tool to orient early treatment strategy[J]. J Neurol, 2008, 255(10): 1561-1566.
[3] Leitinger M, Höller Y, Kalss G, et al. Epidemiology-based mortality score in status epilepticus (EMSE)[J]. Neurocrit Care, 2015, 22(2): 273-282.
[4] Rosenow F, Hamer HM, Knake S. The epidemiology of convulsive and nonconvulsive status epilepticus[J]. Epilepsia, 2007, 48(Suppl 8): 82-84.
[5] Sutter R, Tschudin-Sutter S, Grize L, et al. Associations between infections and clinical outcome parameters in status epilepticus: a retrospective 5-year cohort study[J]. Epilepsia, 2012, 53(9): 1489-1497.
[6] Gao Q, Ou-Yang TP, Sun XL, et al. Prediction of functional outcome in patients with convulsive status epilepticus: the END-IT score[J]. Crit Care, 2016, 20: 46.
[7] Choi SA, Lee H, Kim K, et al. Mortality, disability, and prognostic factors of status epilepticus: A nationwide population-based retrospective cohort study[J]. Neurology, 2022, 99(13): e1393-e1401.
[8] Alvarez V, Januel JM, Burnand B, et al. Role of comorbidities in outcome prediction after status epilepticus[J]. Epilepsia, 2012, 53(5): e89-e92.
[9] Belluzzo M, Furlanis G, Stragapede L, et al. Role of comorbidities and in-hospital complications in short-term status epilepticus outcome[J]. Clin Neurol Neurosurg, 2017, 154: 13-18.
[10] Zelano J, Möller F, Dobesberger J, et al. Infections in status epilepticus: a retrospective 5-year cohort study[J]. Seizure, 2014, 23(8): 603-606.
[11] Hocker S. Systemic complications of status epilepticus--An update[J]. Epilepsy Behav, 2015, 49: 83-87.
[12] St Germaine-Smith C, Liu M, Quan H, et al. Development of an epilepsy-specific risk adjustment comorbidity index[J]. Epilepsia, 2011, 52(12): 2161-2167.
[13] Kämppi L, Ritvanen J, Strbian D, et al. Complication Burden Index-A tool for comprehensive evaluation of the effect of complications on functional outcome after status epilepticus[J]. Epilepsia, 2018, 59(Suppl 2): 176-181.
[14] Glauser T, Shinnar S, Gloss D, et al. Evidence-based guideline: Treatment of convulsive status epilepticus in children and adults: Report of the Guideline Committee of the American Epilepsy Society[J]. Epilepsy Curr, 2016, 16(1): 48-61.
[15] Hanley JA, McNeil BJ. The meaning and use of the area under a receiver operating characteristic (ROC) curve[J]. Radiology, 1982, 143(1): 29-36.
[16] Sokic DV, Jankovic SM, Vojvodic NM, et al. Etiology of a short-term mortality in the group of 750 patients with 920 episodes of status epilepticus within a period of 10 years (1988-1997)[J]. Seizure, 2009, 18(3): 215-219.
[17] Madžar D, Geyer A, Knappe RU, et al. Association of seizure duration and outcome in refractory status epilepticus[J]. J Neurol, 2016, 263(3): 485-491.
[18] Lai A, Outin HD, Jabot J, et al. Functional outcome of prolonged refractory status epilepticus[J]. Crit Care, 2015, 19(1): 199.
[19] Kowalski RG, Ziai WC, Rees RN, et al. Third-line antiepileptic therapy and outcome in status epilepticus: the impact of vasopressor use and prolonged mechanical ventilation[J]. Crit Care Med, 2012, 40(9): 2677-2684.
[20] Hocker SE, Britton JW, Mandrekar JN, et al. Predictors of outcome in refractory status epilepticus[J]. JAMA Neurol, 2013, 70(1): 72-77.
[21] Koubeissi M, Alshekhlee A. In-hospital mortality of generalized convulsive status epilepticus: a large US sample[J]. Neurology, 2007, 69(9): 886-893.
[22] Kang BS, Kim DW, Kim KK, et al. Prediction of mortality and functional outcome from status epilepticus and independent external validation of STESS and EMSE scores[J]. Crit Care, 2016, 20: 25.
[23] González-Cuevas M, Santamarina E, Toledo M, et al. A new clinical score for the prognosis of status epilepticus in adults[J]. Eur J Neurol, 2016, 23(10): 1534-1540.
猜你喜欢
- 配液时,到底需不需要消毒瓶口?
- 先引流后卖课 在线“诊断”心理问题潜藏风险
- Lupus Sci Med:系统性红斑狼疮合并肺动脉高压的预警信号:雷诺现象是强预测因子,联合抗RNP抗体及NVC的SD模式可显著提升筛查效能
- 眼干、眼涩就点眼药水?专家澄清误区:单滴眼药水不能根治干眼
- JAMA Pediatrics:补充维生素D对婴儿骨量的影响
- 警惕“泥石流”—急性前壁心肌梗死支架术后慢血流1例
- 胡萝卜炒黑木耳的做法-家常味炒菜谱
- 银保监会:警惕“投资养老”“以房养老”诈骗
- 骨科 NSAIDs 药物合理应用解析
- Circ-Cardiovasc Qual:代谢功能障碍相关脂肪变性肝病家庭成员主要不良心血管结局风险
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)