首页 > 医疗资讯/ 正文
炎症性肠病(IBD)是一类以慢性、复发缓解性肠道炎症为特征的疾病,主要包括克罗恩病(CD)和溃疡ative colitis(UC)。尽管现有生物制剂的应用改善了部分患者的预后,但仍有相当比例患者疗效不佳或出现耐药,凸显了探索新治疗靶点的重要性。近年研究表明,肿瘤坏死因子样配体1A(TL1A)与其受体死亡受体3(DR3)在IBD发病中发挥关键作用,尤其通过调控T细胞平衡影响疾病进程。然而,TL1A/DR3信号是否以及如何参与Th9细胞(一类以分泌IL-9为特征的辅助T细胞)的致病性调控,尤其是在CD中的作用,尚不明确。

近期,发表于Gastroenterology杂志的一项研究,系统探讨了TL1A/DR3信号在实验性CD样回肠炎中对Th9细胞分化与致病性的调控作用。研究者以自发发展为CD样回肠炎的SAMP1/YitFc(SAMP)小鼠为核心模型,通过构建DR3基因敲除的SAMP小鼠(DR3⁻/⁻×SAMP),并结合体外极化Th9细胞、转录组与磷酸化蛋白质组分析、细胞过继转移及IL-9阻断实验,揭示了该信号轴在Th9细胞介导的肠道炎症中的核心地位。
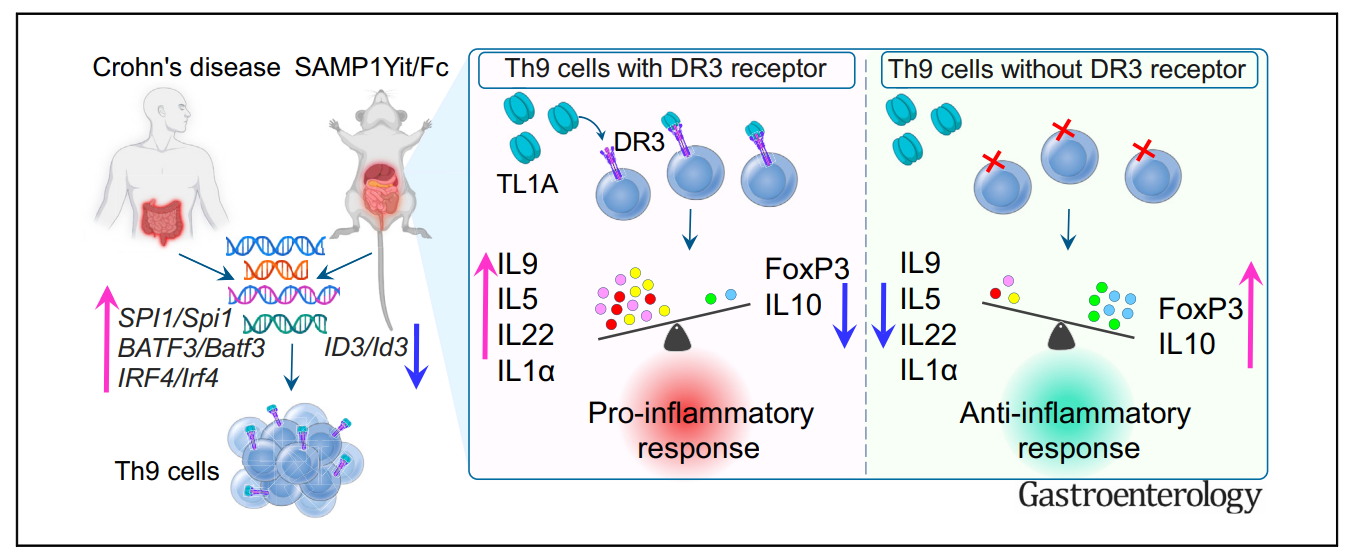
研究首先证实,DR3缺失显著减轻了SAMP小鼠的肠道炎症程度,并伴随回肠组织中IL-9 mRNA和蛋白水平的下降。关键Th9分化正调控因子(如 SpI1、Batf3)表达下调,而抑制性基因(如 Id3、Tal1)表达上升,提示DR3信号是Th9细胞分化及其效应功能所必需的。在体外实验中,TL1A的加入显著增强了野生型SAMP来源的Th9细胞(Th9WT)中IL-9的分泌,而该效应在DR3⁻/⁻×SAMP来源的Th9细胞(Th9KO)中消失,进一步确立了TL1A/DR3轴对Th9极化的直接促进作用。
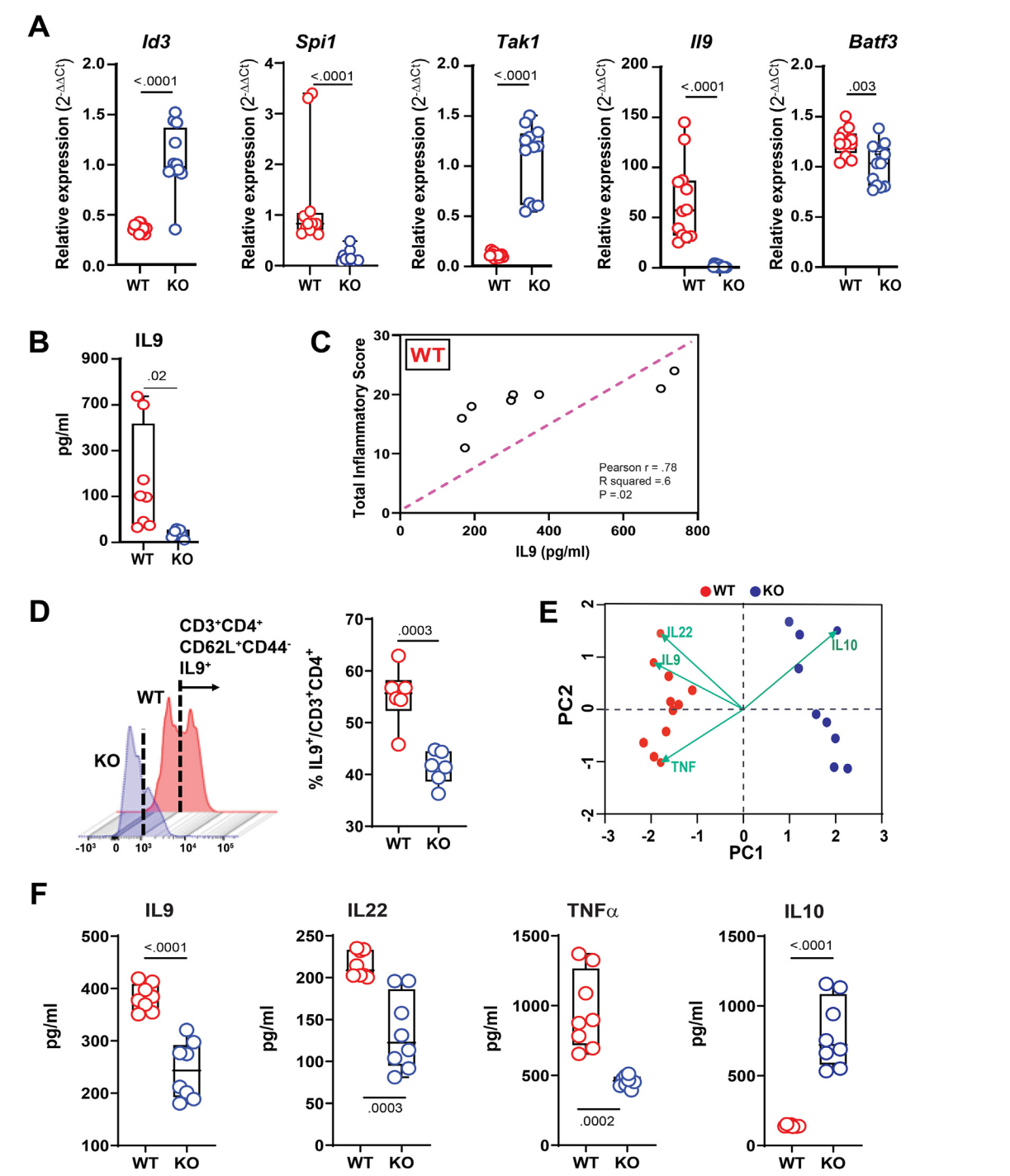
图:在SAMP小鼠中,DR3基因的缺失会降低IL-9的水平
进一步通过RNA测序(RNA-seq)分析发现,与Th9WT相比,Th9KO细胞中有741个基因表达发生显著改变,其中437个上调、315个下调。通路富集分析显示,IBD相关通路、JAK-STAT信号、趋化因子信号、T细胞受体(TCR)信号等关键炎症通路在Th9KO中显著受抑。具体而言,多个促炎因子(如 Il1α、Il5、Il12α)及趋化因子(如 Ccl24、Ccl17)表达下降,而抗炎因子 Il10 及调节性T细胞(Treg)关键转录因子 Foxp3 表达上升,提示DR3缺陷使Th9细胞由促炎表型向抗炎/调节性表型转变。
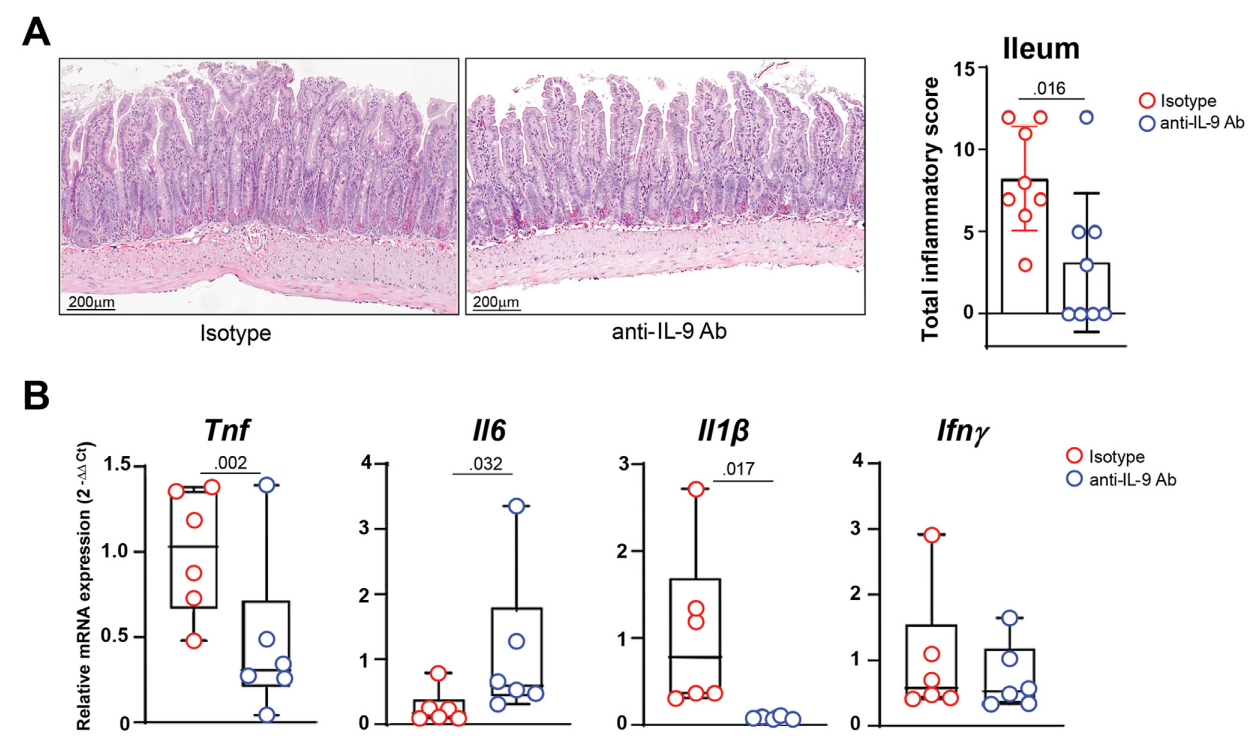
图:阻断IL-9能够改善SAMP小鼠的CD样回肠炎
磷酸化蛋白质组学分析进一步揭示,Th9WT细胞中多个与细胞因子信号、免疫应答、细胞增殖相关的通路被显著激活,包括Hippo通路关键分子(如STK4、YAP/TAZ复合体调控蛋白)的磷酸化状态发生改变,进而可能影响肠道屏障修复与免疫细胞极化。此外,Th9WT中IL-8、CCR3等趋化因子通路激活,而IL-10、IL-17等通路被抑制,进一步强化了其促炎特性。
为验证Th9细胞的体内致病性,研究者将Th9WT与Th9KO细胞分别过继转移至免疫缺陷型Rag2⁻/⁻及SAMP×Rag2⁻/⁻受体小鼠。结果显示,接受Th9WT细胞的小鼠出现更严重的结肠炎与回肠炎症,伴随更高水平的 Il9、Tnf、Il18 等促炎因子表达;而Th9KO受体鼠则表现出较轻的病理损伤和更高的 Il10 表达。该结果明确表明,DR3信号是Th9细胞在体内发挥致病性的关键。
在治疗转化层面,研究者进一步在SAMP小鼠中施用抗IL-9中和抗体,发现其可显著减轻回肠炎症程度,并伴随多个促炎因子基因表达的下降,提示靶向IL-9可能成为CD治疗的新策略。
最后,为验证该机制在人类疾病中的相关性,研究者分析了IBD患者肠道活检样本及公共数据库(Mount Sinai IBD Registry)的RNA-seq数据。结果显示,CD和UC患者炎症黏膜中Th9特征基因(如 SPI1、BATF3、IRF4)表达上调,而抑制性基因 ID3 表达下降,与SAMP小鼠中的表达模式高度一致,进一步支持了该动物模型与研究结论的临床转化价值。
综上,本研究首次系统阐明了TL1A/DR3信号通过促进Th9细胞极化、增强其促炎表型,进而驱动CD样肠道炎症的分子与细胞机制。该发现不仅深化了对IBD免疫病理机制的理解,也为开发针对TL1A/DR3/Th9轴的新型治疗策略提供了坚实的实验依据。未来,针对该通路的多靶点干预(如抗TL1A、抗DR3或抗IL-9疗法)有望为难治性CD患者带来新的希望。
原始出处
Menghini P, Buttó LF, Gomez-Nguyen A, et al. Tumor Necrosis Factor-Like Ligand 1A/Death Receptor 3 Signaling Regulates the Generation of Pathogenic T Helper 9 Cells in Experimental Crohn's Disease. Gastroenterology. 2025;169(5):892-908. doi:10.1053/j.gastro.2025.03.035
本文相关学术信息由梅斯医学提供,基于自主研发的人工智能学术机器人完成翻译后邀请临床医师进行再次校对。如有内容上的不准确请留言给我们。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)