首页 > 医疗资讯/ 正文
腹膜后高分化脂肪肉瘤(WDLS)的多种组织学亚型已被描述,但这些亚型与临床结局、潜在基因组差异及向去分化脂肪肉瘤(DDLS)转化的相关性尚未明确。 本研究纳入1982年7月至2021年7月在该院接受手术切除的276例原发性腹膜后WDLS患者和353例原发性腹膜后DDLS患者。由肉瘤病理学家对WDLS组织学特征进行回顾性分析,将其分为三种亚型:脂肪瘤样型、硬化/黏液样型、早期/初发去分化型WDLS。此外,对140例有可用下一代靶向测序数据(通过MSK-IMPACT平台生成)的患者亚组进行探索性基因组分析。
在校正肿瘤大小、手术切缘等其他预后因素后,与脂肪瘤样亚型相比,硬化/黏液样亚型(风险比[HR]=3.2)、早期/初发去分化亚型(HR=5.3)及DDLS(HR=9.6)与更高的疾病特异性死亡率独立相关。与脂肪瘤样亚型相比,硬化/黏液样亚型(HR=2.9)和早期/初发去分化亚型(HR=5.4)后续发生去分化的风险也更高。基因组探索性分析显示,与脂肪瘤样样本相比,硬化/黏液样和早期/初发去分化样本中MDM2和CDK4的拷贝数对数比(CNLR)显著更高,且早期/初发去分化样本的MDM2和CDK4拷贝数对数比与DDLS样本相近。
WDLS亚型在WDLS向DDLS的疾病谱系中,表现出形态学和基因组层面的渐进性进展。区分这些亚型具有重要临床意义,可为患者提供精准咨询,并助力未来临床试验的入组与分层设计。
研究背景
腹膜后高分化脂肪肉瘤(WDLS)是一种局部侵袭性强但极少转移的恶性肿瘤,其特征是12号染色体q13-15区域扩增,该区域包含癌基因MDM2、CDK4和HMGA2。手术切除仍是主要治疗手段,但局部复发(LR)率在5年时高达40%,15年时达60%,这导致15年疾病特异性死亡率最高可达30%,主要由无法控制的局部病变所致。WDLS在后续复发过程中还可能进展为临床侵袭性更强的去分化脂肪肉瘤(DDLS)。
越来越多的证据表明,WDLS肿瘤在组织病理学特征和临床结局方面比以往认知的更具异质性。既往研究提示,腹膜后及四肢/躯干WDLS的硬化程度可能与更差的预后相关。然而,腹膜后WDLS特定组织病理学特征的全部临床和预后意义尚未得到充分阐明,潜在的基因组差异也尚未被探究。此外,尽管已知WDLS和DDLS属于同一疾病谱系,且常共存于同一肿瘤中,但目前尚不清楚不同WDLS亚型是否与DDLS共享某些基因组特征,以及/或是否预示着不同的后续去分化风险。鉴于精准预后评估对临床实践、未来临床试验的合理入组及患者分层至关重要,本研究旨在WDLS-DDLS疾病谱系的背景下,进一步探讨不同WDLS亚型的预后价值。
研究结果
1982年7月至2021年7月期间,本研究共纳入276例接受手术切除的原发性腹膜后WDLS患者和353例原发性腹膜后DDLS患者,确诊时中位年龄为62岁(四分位距[IQR]:53-70岁),中位肿瘤大小为23cm(IQR:16-32cm)。62例患者(22%)为纯脂肪瘤样型WDLS,大多数WDLS患者的肿瘤包含非脂肪瘤样区域。各WDLS亚型组及DDLS组的患者特征见表1。
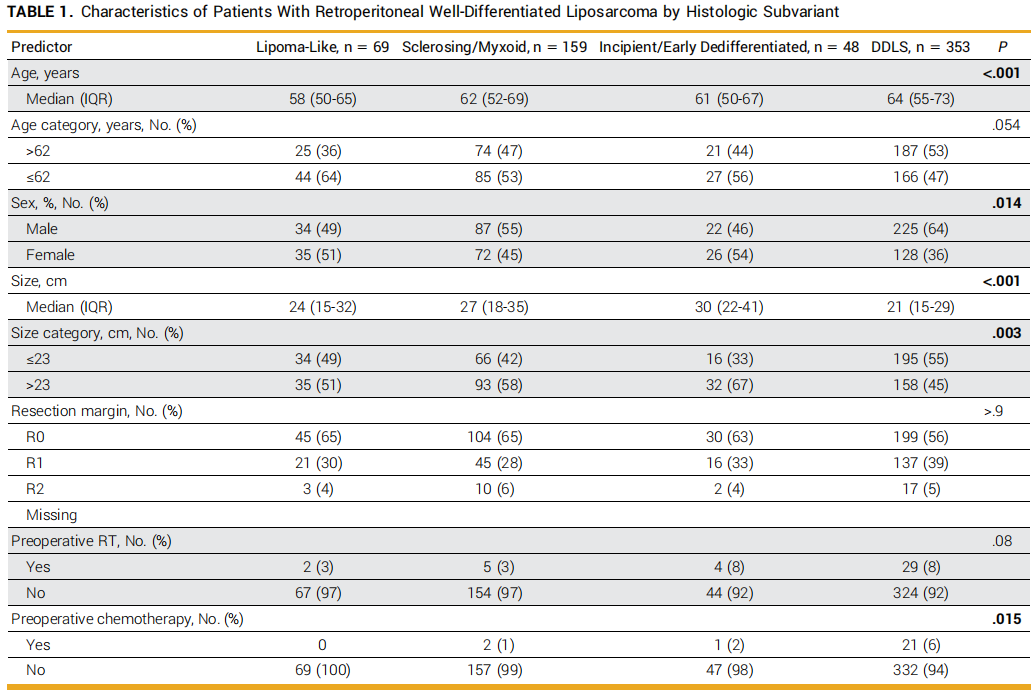
表1
疾病特异性死亡(DSD):
中位随访8.1年(95%置信区间[CI]:7.2-9.2年)后,221例患者(35%)死于疾病,78例患者(12%)死于其他原因或未知原因。单变量分析显示,与脂肪瘤样型肿瘤相比,硬化/黏液样型肿瘤(风险比[HR]=2.9;P=0.011)、早期/初发去分化型肿瘤(HR=4.7;P<0.001)及DDLS肿瘤(HR=8.1;P<0.001)与更高的DSD风险显著相关(图1A、表2)。与DSD相关的其他因素包括R1切除vs R0切除、R2切除vs R0切除。在仅WDLS队列中,R1切除与R0切除的DSD发生率无显著差异(HR=0.8;95%CI:0.4-1.3;P=0.3)。在调整肿瘤大小和手术切缘的多变量竞争风险回归模型中,与脂肪瘤样型肿瘤相比,硬化/黏液样型肿瘤(HR=3.2;P=0.005)、早期/初发去分化型肿瘤(HR=5.3;P<0.001)及DDLS肿瘤(HR=9.6;P<0.001)仍与更高的DSD发生率独立相关。切缘状态和肿瘤大小>23cm也与更高的DSD发生率独立相关(表2)。
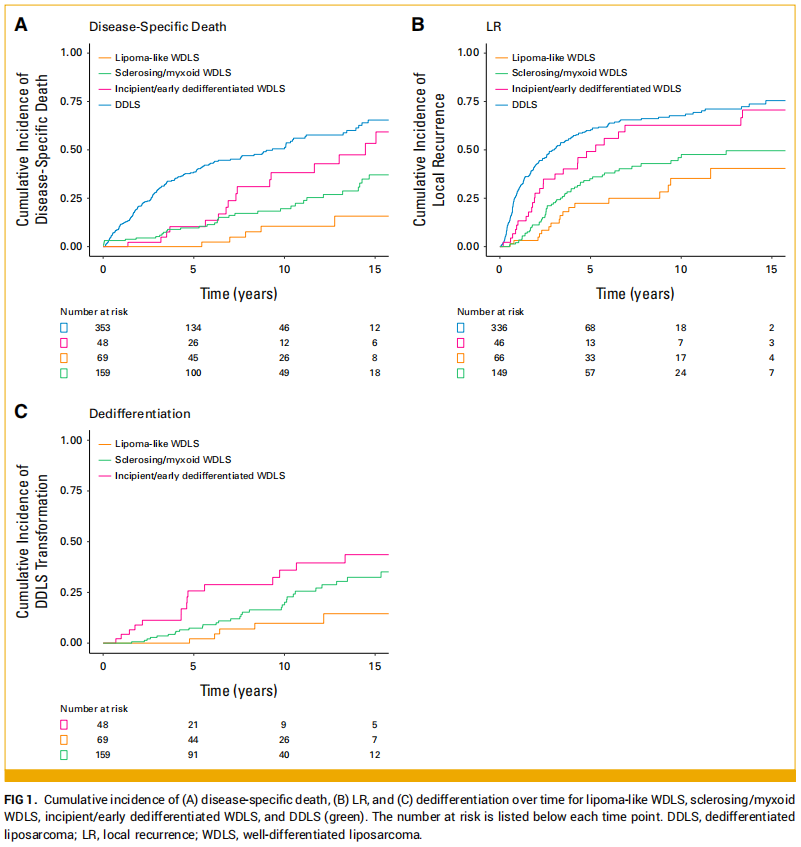
图1
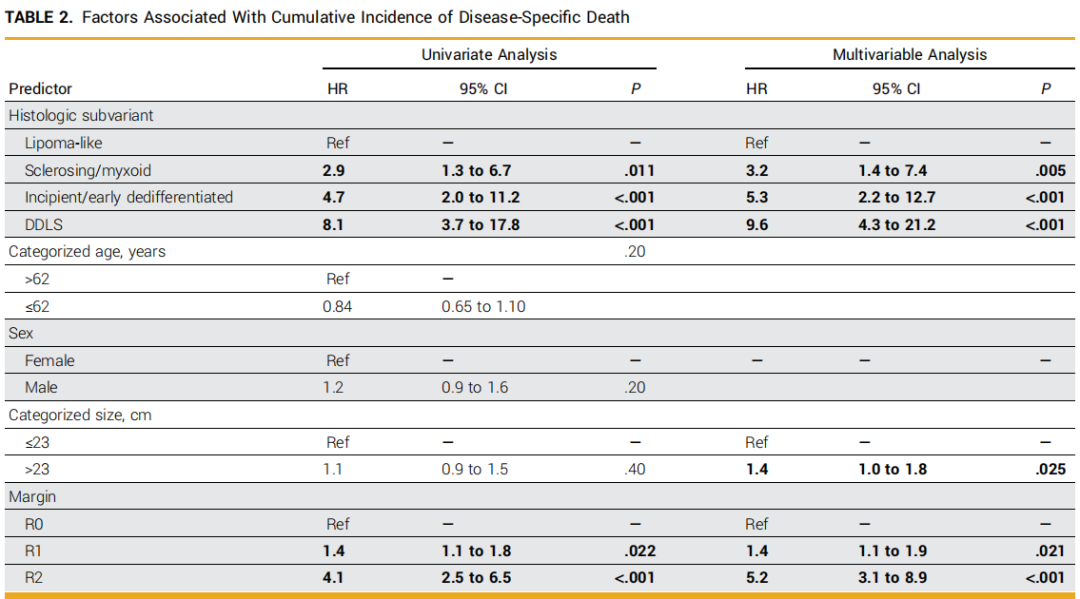
表2
鉴于随着时间推移,早期/初发去分化组的DSD发生率逐渐接近DDLS组,研究者进一步对这两个特定亚组进行生存分析。结果显示,与早期/初发去分化组相比,DDLS组的DSD风险显著更高(HR=1.7;95%CI:1.1-2.5;P=0.011;图1A)。研究者还应用混合治愈模型分析,更细致地评估这种差异是否源于DSD发生率、DSD潜伏期的差异,或两者共同作用。结果发现,亚组间DSD发生率无显著差异(HR=0.02;95%CI:0-61;P=0.34),但DDLS亚组的DSD潜伏期显著更短(HR=2.2;95%CI:1.3-3.7;P=0.004)。
局部复发(LR)、远处复发与去分化:
32例接受R2切除的患者被排除在LR分析之外。在剩余597例患者中,304例(51%)发生LR,80例(13%)未发生LR即死亡。单变量分析显示,与脂肪瘤样型肿瘤相比,早期/初发去分化型肿瘤(HR=2.4;P=0.002)及DDLS肿瘤(HR=3.4;P<0.001)的LR发生率显著更高,而硬化/黏液样型肿瘤无显著差异(HR=1.5;P=0.13;图1B)。与更高LR发生率相关的其他因素包括男性性别和R1切除 vs R0切除(表3)。在包含组织学亚型、性别、肿瘤大小及R1/R0切缘状态的多变量模型中,早期/初发去分化型 vs 脂肪瘤样型肿瘤(HR=2.4;P=0.003)、DDLS vs 脂肪瘤样型肿瘤(HR=3.4;P<0.001)以及R1 vs R0切缘状态(HR=1.3;P=0.020)仍与更高的LR发生率独立相关(表3)。
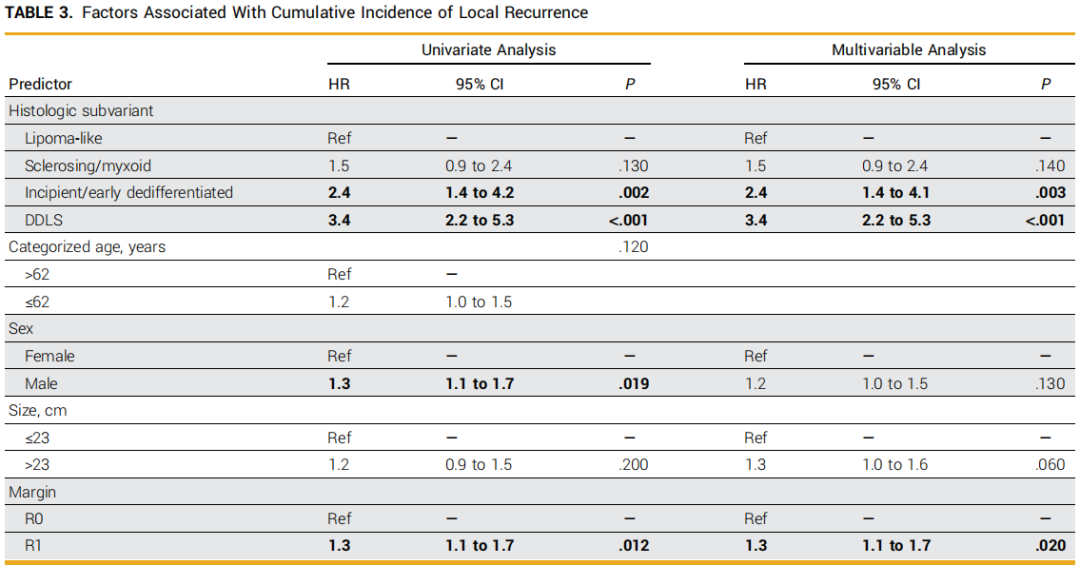
表3
脂肪瘤样型WDLS患者均未发生远处转移;159例硬化/黏液样型WDLS患者中9例(6%)、48例早期/初发去分化型WDLS患者中3例(6%)、353例DDLS患者中67例(19%)发生远处转移。由于事件数量不足,未进行进一步分析。
接下来,研究者对WDLS亚组进行分析,评估组织学亚型与去分化发生率的相关性。276例WDLS患者中,55例(20%)出现去分化复发,69例(25%)无去分化证据即死亡。5年去分化累积发生率:脂肪瘤样型组为2.1%,硬化/黏液样型组为7.4%,早期/初发去分化型组为26%。单变量分析显示,与脂肪瘤样型亚型相比,硬化/黏液样型(HR=2.9;P=0.028)和早期/初发去分化型(HR=5.4;P<0.001)亚型的去分化发生率显著更高(图1C)。年龄≤60岁和肿瘤大小>26cm也与更高的去分化发生率相关。在包含WDLS组织学亚型、年龄及肿瘤大小的多变量竞争风险回归模型中,与脂肪瘤样型亚型相比,硬化/黏液样型(HR=3.2;P=0.018)和早期/初发去分化型(HR=5.2;P=0.001)亚型仍与更高的去分化发生率独立相关。年龄≤60岁也与更高的去分化发生率独立相关。
探索性基因组分析:
队列中140例患者(41例WDLS、99例DDLS)的原发肿瘤接受了MSK-IMPACT测序。41例WDLS患者中,11例为脂肪瘤样型、21例为硬化/黏液样型、9例为早期/初发去分化型。对测序对应的福尔马林固定石蜡包埋(FFPE)肿瘤块切片进行病理回顾:所有脂肪瘤样型肿瘤的测序区域为脂肪瘤样区域;21例硬化/黏液样型肿瘤中17例(81%)的测序区域为硬化/黏液样区域;9例早期/初发去分化型肿瘤中7例(78%)的测序区域为早期/初发去分化区域或去分化区域(图2)。
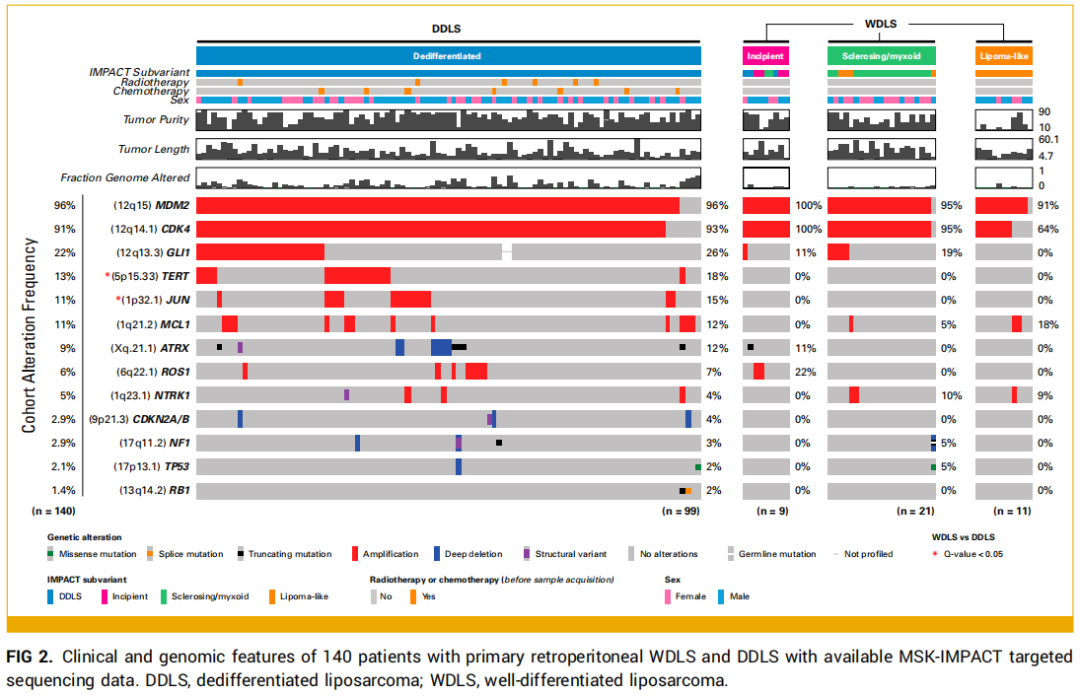
图2
研究者首先分析了按组织学亚型分层的突变及拷贝数变异图谱,MSK-IMPACT基因panel中最常见的变异基因如图2所示。MDM2拷贝数扩增在脂肪瘤样型、硬化/黏液样型、早期/初发去分化型肿瘤中的检出率分别为91%、95%、100%;CDK4扩增检出率分别为64%、95%、100%。随后,研究者对134例至少1个上述基因扩增的样本,分析了不同组织学亚型间MDM2和CDK4的相对拷贝数。结果显示,与WDLS样本相比,DDLS样本的MDM2中位拷贝数对数比(CNLR)(3.9 vs 3.2;P<0.001)、CDK4中位CNLR(3.6 vs 2.6;P<0.001)及基因组变异比例(FGA)(0.10 vs 0.02;P<0.001)均显著更高(图3)。与脂肪瘤样型样本相比,硬化/黏液样型和早期/初发去分化型样本的MDM2中位CNLR(分别为3.3、3.8 vs 1.8;P值分别为0.035、0.006)和CDK4中位CNLR(分别为2.8、3.1 vs 1.6;P值分别为0.02、0.01)均显著更高。WDLS各亚型间FGA无显著差异(脂肪瘤样型中位0.01 vs 硬化/黏液样型中位0.02 vs 早期/初发去分化型中位0.02;图3)。DDLS样本与早期/初发去分化型样本的CDK4(3.6 vs 3.1;P=0.43)和MDM2(3.9 vs 3.8;P=0.46)中位CNLR无显著差异,但DDLS样本的FGA显著更高(0.10 vs 0.02;P=0.02;图3)。
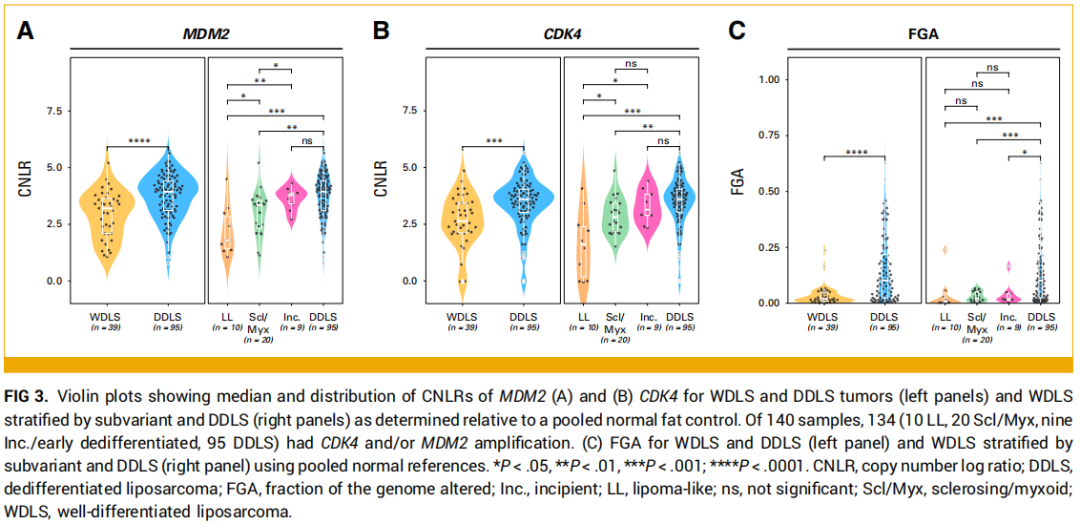
图3
讨 论
WDLS肿瘤具有显著的组织病理学异质性,仅不到25%为纯脂肪瘤样型;与脂肪瘤样型WDLS相比,硬化/黏液样型和早期/初发去分化型WDLS与更高的DSD发生率独立相关。各亚型间DSD的差异比局部复发的差异更为显著。这种差异可能部分归因于非脂肪瘤样型肿瘤的去分化风险更高——因为去分化型LR的侵袭性可能强于高分化型LR,且对DSD的影响更大。远处转移极为罕见,不足以进行统计分析;腹膜后WDLS/DDLS患者的主要死亡原因仍是无法控制的腹腔内病变。尽管以10%去分化比例作为区分早期/初发去分化型WDLS与DDLS的临界值,是基于对巨大肿瘤病理检查的粗略估算,但处于该临界值“灰色地带”的病例似乎较少。重要的是,这种病理学分型具有预后意义:混合治愈模型分析显示,尽管两个亚组的总体DSD发生率无显著差异,但早期/初发去分化型组的DSD潜伏期显著更长。
在探索性基因组分析中,研究者观察到CDK4和MDM2拷贝数与组织学特征之间存在显著关联。有趣的是,36%的脂肪瘤样型WDLS为CDK4二倍体,而非脂肪瘤样型WDLS中这一比例不足5%。由于CDK4与MDM2协同作用可驱动细胞衰老抵抗,因此CDK4扩增率较低可能是脂肪瘤样型WDLS病程更惰性的原因之一,但这一结论需在更大样本队列中验证。另有研究团队近期报道,更高的MDM2拷贝数可能激活不依赖p53的生长通路,并增强对MDM2抑制剂的耐药性,提示MDM2拷贝数增加可能促进肿瘤进展及治疗耐药。
本研究结果可能对腹膜后WDLS和DDLS的术前放疗评估具有启示意义。尽管近期完成的多中心STRASS试验发现,与单纯手术相比,添加术前放疗并未改善腹膜后肉瘤患者的腹腔无复发生存期或总生存期,但由于STRASS试验存在固有局限性,且通过倾向评分匹配分析整合STRASS和STREXIT患者数据后,WDLS亚组显示出潜在获益信号,术前放疗的应用仍存在争议。本研究结果提出两个重要考量:第一,STRASS/STREXIT试验的治疗组间可能存在WDLS亚型分布不均衡,这可能会无意中导致结果偏倚;第二,LR与DSD的关联性因组织学亚型而异。例如,脂肪瘤样型WDLS患者10年LR发生率接近40%,但DSD发生率不足20%,这提示预防首次腹腔复发的临床意义可能有限,鉴于患者预期生存期较长,应优先降低治疗相关毒性。相反,早期/初发去分化型WDLS患者5年去分化型LR发生率达26%,10年DSD发生率接近DDLS患者,提示这类患者可能是激进一线干预的目标人群。
有趣的是,研究者发现R1切缘与更高的DSD发生率相关,但这种差异仅在DDLS亚组中观察到。这与本研究团队及其他研究者之前发表的数据不一致,令人意外。由于病理学家仅在电灼表面、包膜破裂处或外科医生指定的重点关注区域检查显微镜下切缘,且所有多灶性肿瘤均归类为R1切除,因此R1组可能富集了局部晚期肿瘤和生物学行为不良的肿瘤。基于此,研究者不主张对DDLS患者采用更广泛的手术切缘。
本研究存在一定局限性:首先,为单中心回顾性分析(基于前瞻性维护数据库),可能存在选择偏倚和未测量的混杂因素;其次,巨大肿瘤的组织病理学评估受取样不足的限制,尽管样本均取自最坚实的区域以避免遗漏去分化病灶;最后,亚型分层的广泛应用需要多中心病理学家达成共识,采用更统一的定义,研究者希望本研究结果能为此奠定基础。CDK4/MDM2拷贝数对数比(CNLR)可作为有用的分子诊断辅助指标,但如图3所示,不同组织学类型间个体CNLR值存在重叠,因此无法完全替代组织学检查。此外,基因组分析仍处于探索阶段,存在以下局限:(a)样本量较小;(b)拷贝数分析依赖混合正常样本作为参考;(c)靶向测序虽易获取,但并非研究复杂核型肿瘤的最佳方式,无法捕获未测序基因组中具有生物学意义的结构变异和拷贝数变异。本研究实验室未来的研究将聚焦于WDLS各亚型及DDLS临床样本的全面全基因组测序,以明确肿瘤进展的特定分子机制及潜在的新型治疗策略。
尽管存在这些局限性,本研究结果表明,腹膜后WDLS是一种异质性疾病实体,可进一步分为三种亚型,这些亚型具有独特的临床行为,且处于WDLS向DDLS进展的疾病谱系中。在对腹膜后肉瘤患者进行预后评估及设计未来临床试验的入组标准时,应考虑这些亚型的差异。
参考文献:
George Z. Li et al. Histologic Subvariants of Retroperitoneal Well-Differentiated Liposarcoma Show Evidence of Clinical and Genomic Progression Toward Dedifferentiated Liposarcoma. JCO Precis Oncol 9, e2500316(2025). DOI:10.1200/PO-25-00316
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)