首页 > 医疗资讯/ 正文
心肌缺血再灌注损伤(MIRI)是急性心肌梗死再通治疗后最常见的“二次打击”:当冠状动脉被迅速开通,缺血区血流恢复的瞬间,大量活性氧(ROS)爆发、钙超载、线粒体膜电位骤降,原本濒临死亡的细胞反而加速凋亡或坏死,临床表现为再灌注心律失常、无复流现象及远期心力衰竭。过去四十年,全球先后尝试了抗氧化剂、钙通道阻滞剂、线粒体膜稳定剂等上百种药物,但除速效β受体阻滞剂外,尚无一药物被指南正式推荐用于“预防”再灌注损伤,根本原因在于缺乏可精准干预的分子靶点。
传统中医早在《金匮要略》即有“胸痹心痛,短气”之论,现代临床亦证实活血化瘀方药可显著降低急性心梗患者肌钙蛋白峰值、改善微循环。羟基红花黄色素A(HSYA)是红花(Carthamus tinctorius L.)中含量最高的水溶性查尔酮苷,国家药监局已批准其注射剂用于心脑血管病,多中心回顾性研究显示可使ST段抬高型心梗患者30天主要心血管事件相对风险下降28%,然而其直接作用蛋白与分子机制始终未被系统阐明,成为制约中药国际化与精准化的“卡脖子”环节。
近期,中国中医科学院中药研究所与兰州大学药学院联合团队首先在小动物水平验证了HSYA的“最后一公里”疗效。

图1 论文首图
HSYA对C57BL/6小鼠心肌缺血再灌注损伤具有保护作用
研究将雄性C57BL/6小鼠予左前降支结扎30 min、再灌注24 h建立急性MIRI模型,随机分为模型组、HSYA 20/40/80 mg/kg组及美托洛尔阳性对照组。Evans蓝-TTC双染色显示,模型组梗死区占危险区(IS/AAR)高达42.7%,而HSYA 80 mg/kg组降至18.3%,且危险区面积本身无差异,提示药物真正挽救了“可逆带”。超声心动图进一步证实,HSYA剂量依赖性地提高左室射血分数(EF%)与短轴缩短率(FS%),并逆转舒张末容积扩大;血清LDH水平下降42%,SOD活性升高1.6倍,心肌TUNEL阳性细胞减少58%,ATP含量与NAD+/NADH比值显著回升,磷酸化AMPK升高2.1倍。尤为重要的是,HSYA半衰期仅1.2 h,团队模拟临床静脉泵注方式,在24 h内分4次给药即取得上述疗效,既符合中药“持续微剂量”输注传统,又避免了一次大剂量推注可能带来的血流动力学波动,为后续转化研究提供了安全可行的给药范式。
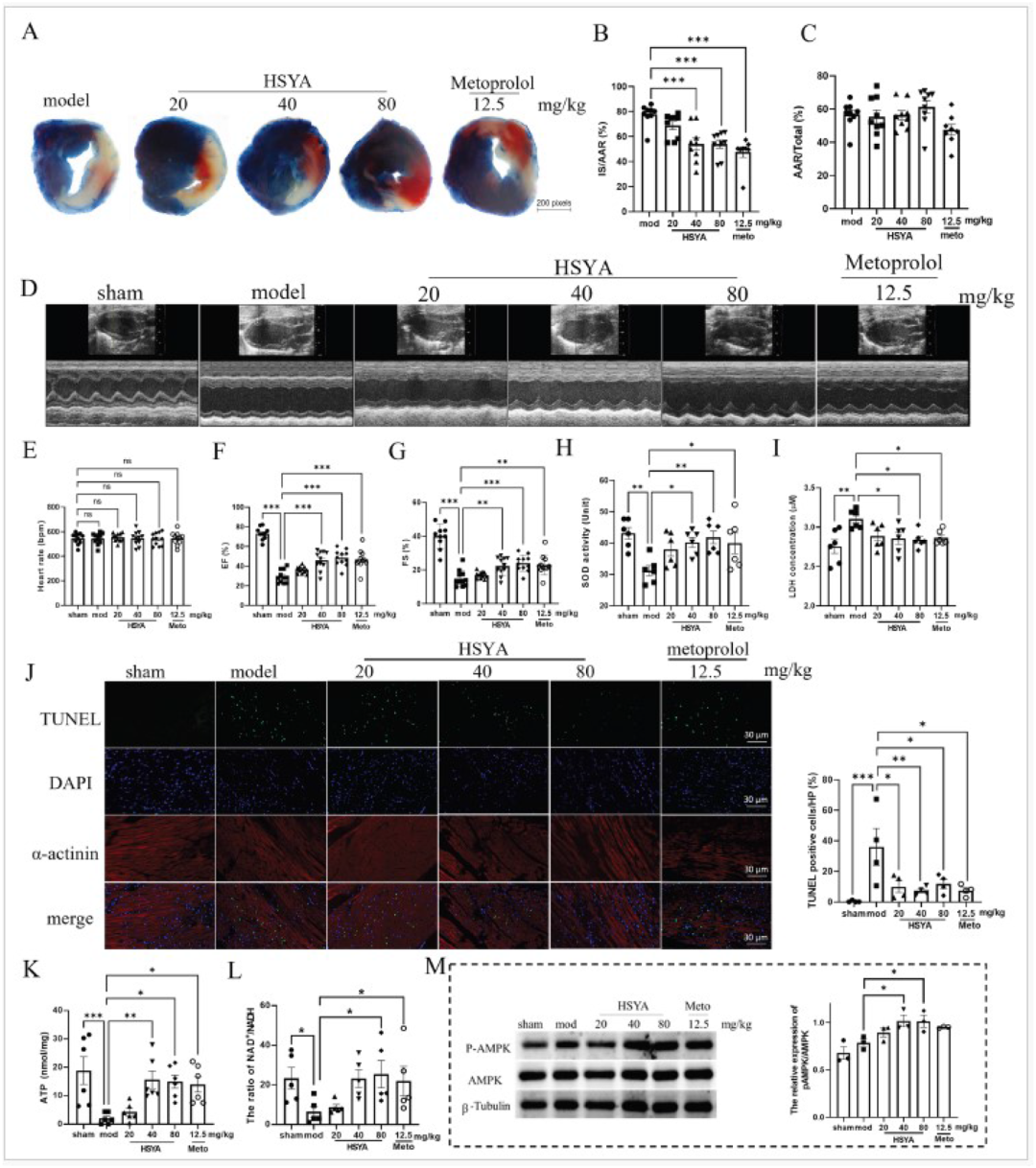
图2 HSYA对C57BL/6小鼠心肌缺血再灌注损伤具有保护作用
HSYA改善H9c2细胞的线粒体代谢稳态
在细胞水平,研究者采用H9c2大鼠心肌细胞系建立缺氧20 h/复氧4 h(H/R)模型,模拟缺血再灌注能量“断-供”骤变。CCK-8与台盼蓝染色显示,HSYA 50–200 μM无细胞毒,且将H/R后存活率由46%提升至81%。DCFH-DA探针检测到ROS水平下降55%,JC-1与Calcein-AM双标记显示线粒体膜电位(MMP)耗散及mPTP异常开放被显著抑制。Seahorse XFp代谢流分析进一步揭示,HSYA使基础氧耗率(OCR)提高38%,ATP合成偶联效率增加34%,最大呼吸容量与储备呼吸容量分别上升45%与52%;同时细胞外酸化率(ECAR)提示糖酵解速率、代偿性糖酵解及糖酵解储备均显著增强,而2-脱氧葡萄糖阻断试验证实其能量来源确为糖酵解通量上调。Western blot显示AMPK Thr172磷酸化在HSYA处理后15 min即达峰,与ATP回升时程一致,提示药物通过“能量感应-代谢重编程”轴快速启动细胞自救程序,为后续靶点发现提供了功能表型锚定。
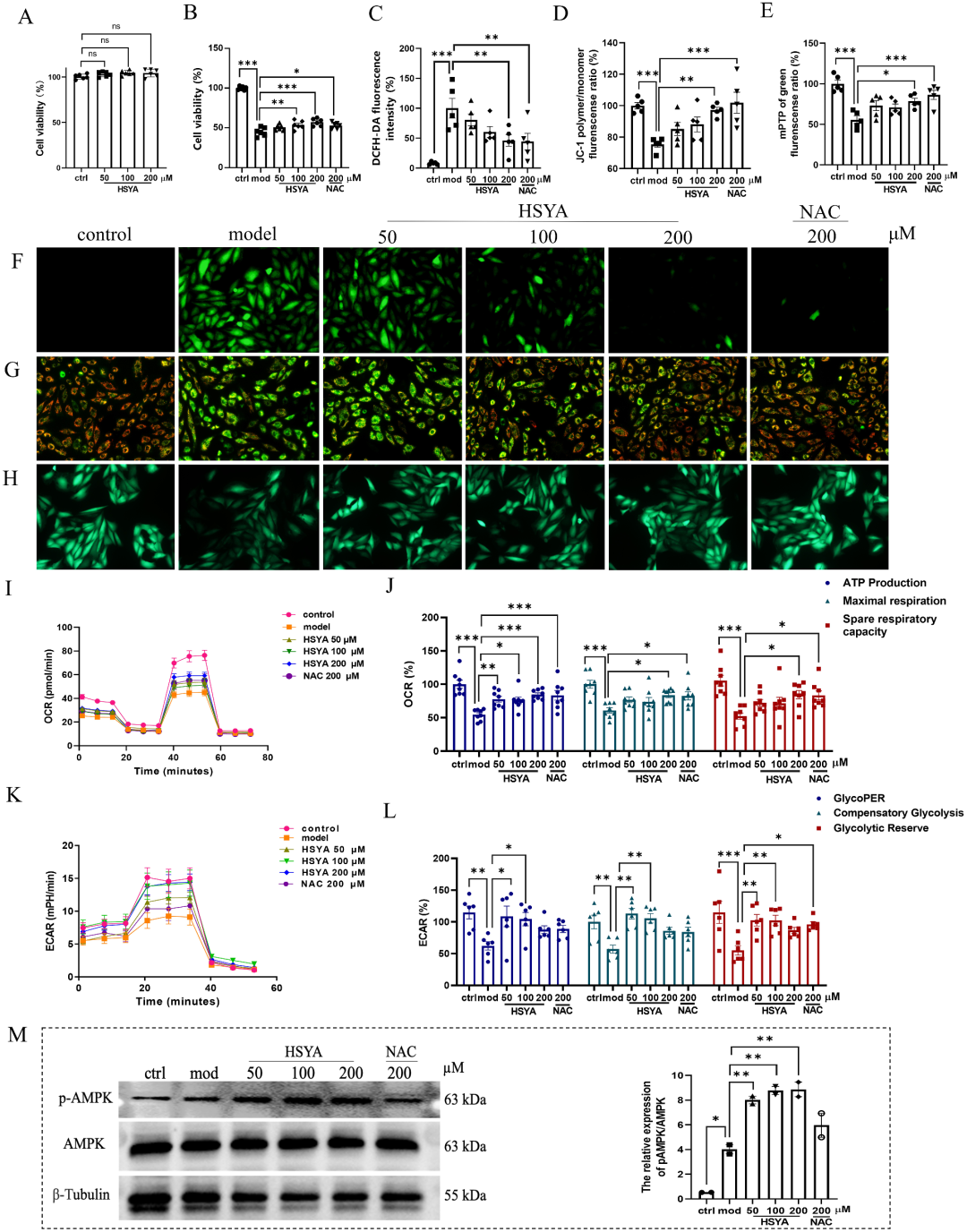
图3 HSYA改善H9c2细胞的线粒体代谢稳态
MDH1被鉴定为HSYA在心肌缺血再灌注损伤中的直接靶点
机制研究的关键是“找到直接握手的人”。团队利用最新一代“还原二甲基标记-串联正交蛋白酶解-活性基底蛋白谱”(rdTOP-ABPP)技术,利用HSYA自身α,β-不饱和酮结构可与亲核半胱氨酸(Cys)发生迈克尔加成的特性,设计IA-炔基探针竞争实验。心脏组织与H9c2细胞裂解液先与HSYA或DMSO共孵育,再与IA-炔基探针竞争标记,通过点击化学偶联生物素-罗丹明,富集后LC-MS/MS定量。以“重标/轻标”比值>1.5为阈值,共捕获234个可竞争蛋白,GO与KEGG富集最显著的是“三羧酸循环”与“碳代谢”通路,其中10个酶蛋白评分居前,包括MDH1、MDH2、SDHA、LDHA等。siRNA分别敲低这10个基因后,仅MDH1与MDH2缺失可完全阻断HSYA对H9c2的细胞保护作用,且MDH1表型最为显著。细胞热位移实验(CETSA)显示,HSYA 200 μM使MDH1熔解曲线右移5.7 ℃,提示直接结合并增加蛋白热稳定性;而MDH2虽酶活也被激活,但无热稳定性改变,提示非共价结合。体外酶活实验表明,HSYA对MDH1的半最大有效浓度(EC50)为9.66 μM,且呈“底物-加速”模式,即药物与酶-底物复合物结合更紧密,符合变构激活特征。至此,MDH1被锁定为HSYA共价激活的“首要”分子靶点。
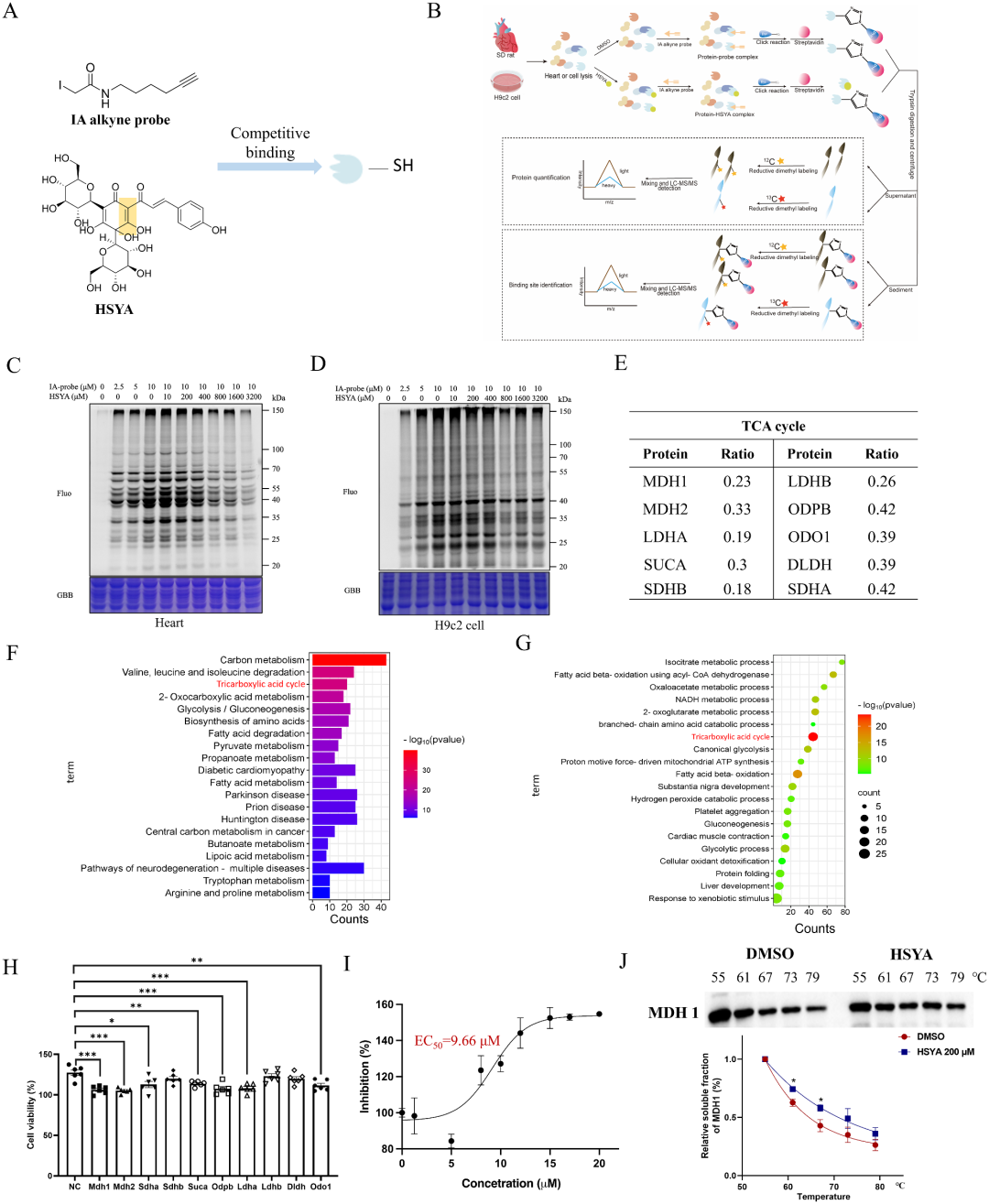
图4 MDH1被鉴定为HSYA在心肌缺血再灌注损伤中的直接靶点
MDH1在HSYA治疗心肌缺血再灌注损伤中发挥重要作用
为验证MDH1是否为功能必需,团队构建心肌特异性可诱导Mdh1-/-小鼠,并在H9c2细胞采用siRNA沉默。结果显示,敲除MDH1后,HSYA 80 mg/kg的梗死面积减少效应被完全取消,EF%与FS%亦无改善;细胞水平MDH1缺失使HSYA对H/R的保护率由75%降至7%,ROS回落、mPTP关闭及MMP恢复均被阻断。Seahorse实验进一步表明,MDH1敲低导致基础OCR下降62%,HSYA无法提升ATP合成及最大呼吸容量;糖酵解代偿亦被取消,提示MDH1是连接“氧化磷酸化-糖酵解”代谢偶联的闸门。尤为精彩的是,在H2O2诱导的纯氧化应激模型中,HSYA仍能显著提高野生型细胞存活率,而对MDH1-/-细胞无效,说明药物通过MDH1抑制ROS的“源头”而非简单清除已生成的ROS。上述数据从遗传学角度坐实了“无MDH1即无保护”的因果链,为靶向能量代谢的精准干预提供了坚实证据。
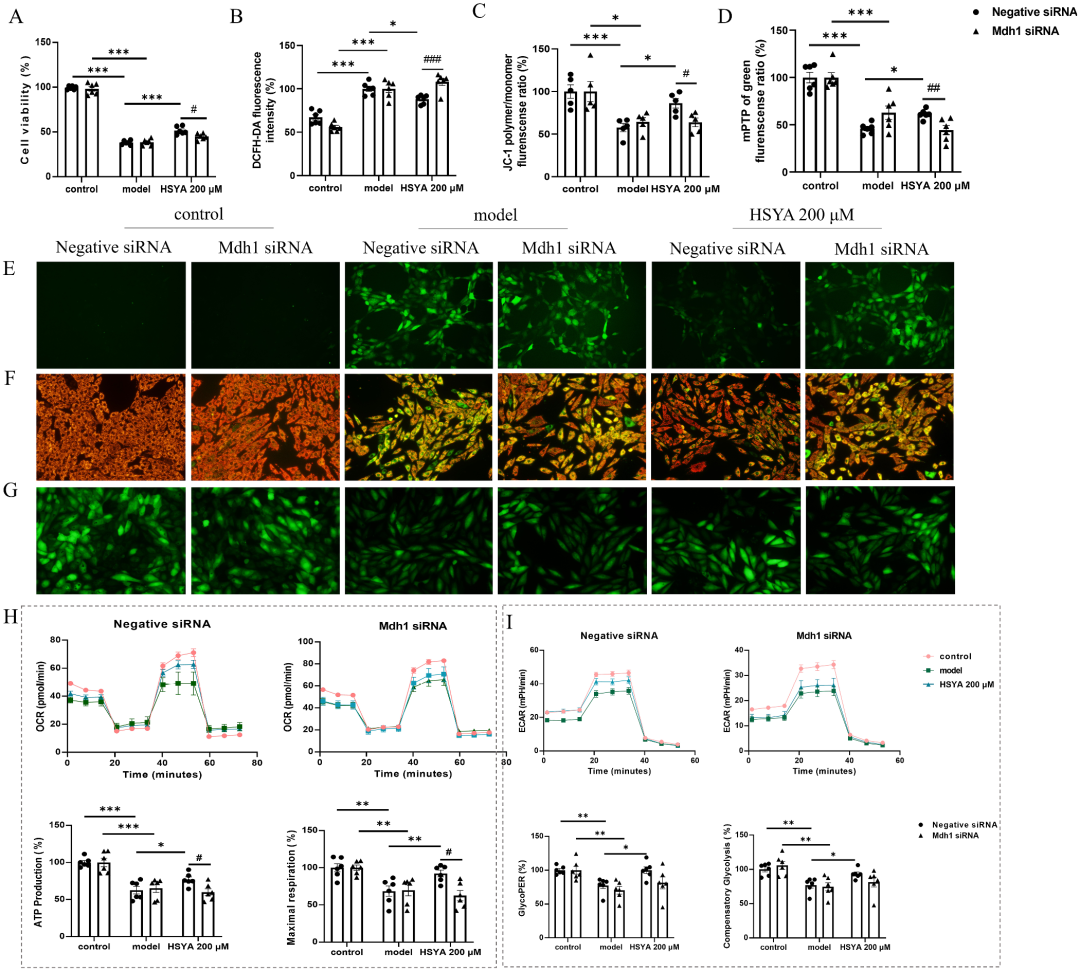
图5 MDH1在HSYA治疗心肌缺血再灌注损伤中发挥重要作用
HSYA直接结合MDH1的Cys137位点
最后,团队利用rdTOP-ABPP结合高分辨质谱,将HSYA-MDH1加合肽段锁定在137位半胱氨酸(Cys137),并测得精确质量漂移936.5759 Da,与迈克尔加成后形成的硫醚键理论值一致。分子对接显示,HSYA的α,β-不饱和酮位于Cys137硫原子3.2 Å,烯碳呈现正电势,与带负电的硫醇形成理想互补;突变Cys137→Ala后,药物对MDH1热稳定性与酶活增强效应完全消失,且突变体细胞在H/R刺激下对HSYA无应答,证实该位点是共价激活的“开关”。结构分析进一步发现,Cys137位于MDH1二聚体界面附近,其共价修饰使活性环α3-α4间距增大0.8 Å,促进NAD+进入口袋,酶转换数kcat提高1.7倍而Km不变,符合变构激活特征。该发现不仅首次绘制了天然产物与MDH1的“共价结合-构象变化-活性增强”全景图,也为后续开发更具成药性的小分子激活剂提供了可编辑的位点模板。
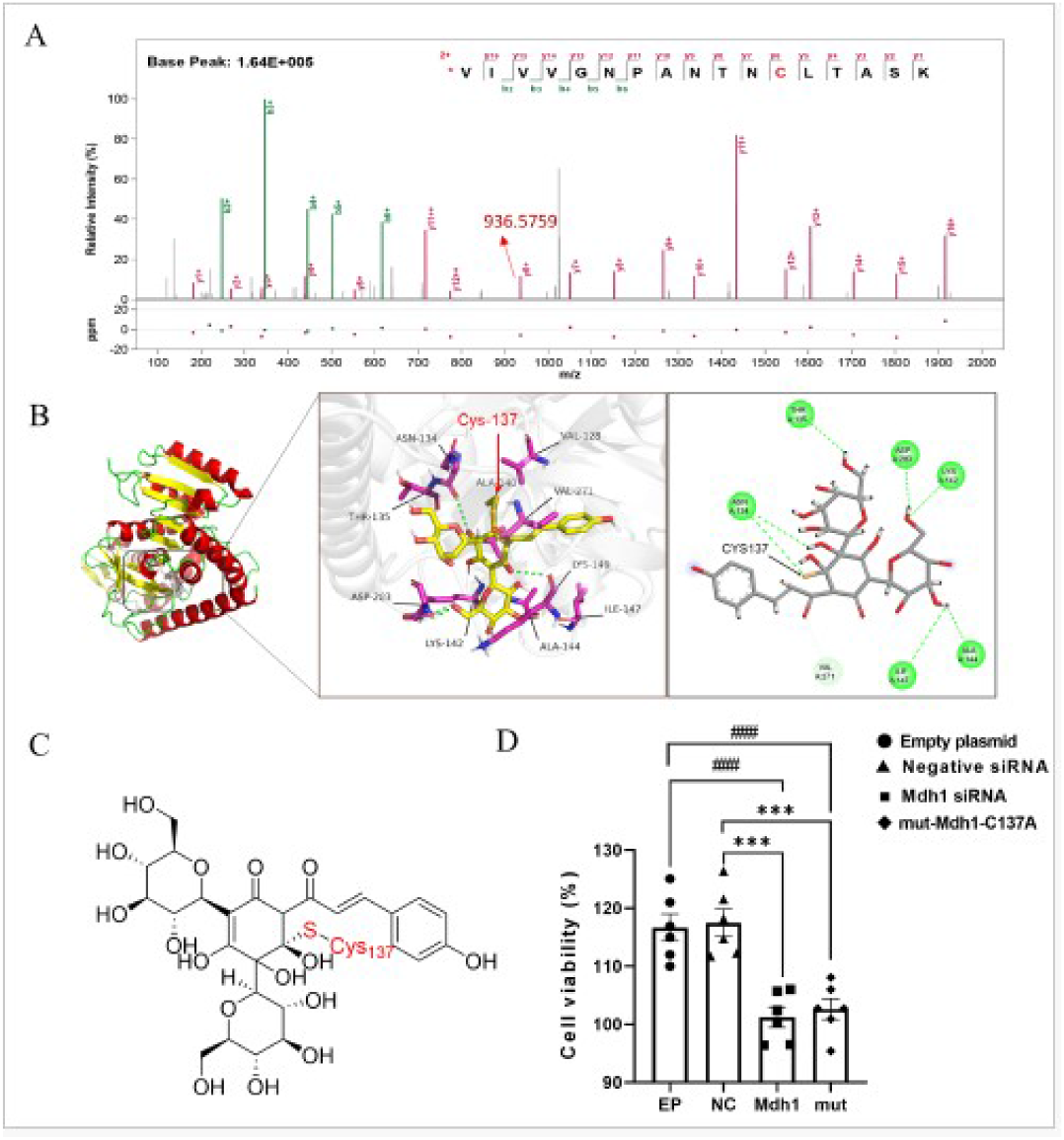
图6 HSYA直接结合MDH1的Cys137位点
小结
从“临床有效”到“机制清晰”,本研究用现代化学蛋白组学语言诠释了红花HSYA“活血化瘀”的科学内涵:其通过共价激活MDH1-Cys137,重建缺血再灌注心肌的线粒体能量网络,抑制ROS爆发,实现真正意义上的“代谢复苏”。该工作不仅填补了中药活性单体直接作用蛋白的空白,更为全球缺乏特异干预手段的再灌注损伤提供了可快速转化的新靶点、新机制与新分子。未来,基于MDH1变构位点的药物化学优化、心肌靶向递送系统及与PCI术联合使用的时机研究,将成为中西医结合精准治疗急性心梗的新前沿。
参考文献:
Zhao F, Cheng W, Wu D, Gong Z, Ma W, Xu J, Zhang J, Xiang X, Ma R, Zhou W, Zhang X, Wang P, Dai J, Xu H. Hydroxysafflor yellow A ameliorates myocardial ischemia/reperfusion injury by promoting MDH1-mediated mitochondrial metabolic homeostasis. Phytomedicine. 2025 Aug;144:156868. doi: 10.1016/j.phymed.2025.156868. Epub 2025 May 29. PMID: 40513321.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)