首页 > 医疗资讯/ 正文
鼻咽癌是一种在亚洲和北非地区高发的恶性肿瘤,2020年全球新发病例超过13.3万例,其中约70%的患者在确诊时已处于局部晚期阶段,且约有30%的患者在接受根治性放化疗后出现治疗失败,这使得治疗策略的优化成为临床实践中的重要课题。磁共振成像作为鼻咽癌诊断和病灶勾画的核心工具,其潜在价值在于能够通过影像特征揭示肿瘤的生物学行为,但目前尚未充分用于预测治疗反应和指导个性化治疗决策。近年来,多项临床试验证实,对于局部晚期鼻咽癌患者,采用诱导化疗联合同步放化疗的方案相较于单纯同步放化疗能显著改善生存结局,因此美国国家综合癌症网络指南已将诱导化疗加同步放化疗列为标准治疗。
目前,临床常用的诱导化疗方案包括TPF(多西他赛+顺铂+5-氟尿嘧啶)和GP(吉西他滨+ 顺铂),两者均被列为2A级证据,但由于直接比较两种方案疗效与毒性的研究较少,临床医生在面对具体患者时仍难以做出个性化选择。放射组学作为一种新兴技术,通过从医学影像中提取定量特征来表征肿瘤异质性,为预测治疗反应提供了新思路,然而现有模型多局限于预测患者是否从诱导化疗中获益,而未能进一步指导方案的选择,这限制了其在精准医疗中的应用。早期识别患者对特定化疗方案的敏感性,不仅有助于最大化治疗效果,还能减少不必要的毒副反应,因此开发一种能够预测诱导化疗反应并指导方案选择的工具具有重要的临床意义。

本研究采用多中心回顾性设计,旨在基于治疗前磁共振成像和临床数据,构建深度学习模型来预测局部晚期鼻咽癌患者对TPF或GP方案的反应。研究共纳入1438例患者,数据来源于两家医疗中心,其中训练集包含969例患者,内部测试集243例,外部测试集226例,所有患者均经组织病理学确诊为鼻咽癌,并根据第八版美国癌症联合委员会分期系统被重新划分为III至IVa期。每位患者在治疗前接受了头颈部磁共振成像扫描,包括轴位T1加权、T2加权和对比增强T1加权序列,同时收集了其临床特征,如EBV DNA水平、T分期、N分期、TNM分期、性别、年龄、世界卫生组织病理分型及Karnofsky功能状态评分。研究的主要终点定义为完全生物学反应,即在完成三个周期诱导化疗后三周内检测不到细胞游离Epstein-Barr病毒DNA,次要终点为无病生存期,用以评估长期疗效。在图像处理方面,研究团队利用基于Python的自动分割模型对肿瘤总体积和转移淋巴结进行勾画,并通过经验丰富的放射科医师进行人工校正,确保感兴趣区域的准确性。特征提取阶段采用Pyradiomics工具,从各序列中获取了1906个放射组学特征,涵盖形状、纹理和强度等多个维度,并应用了指数、梯度、局部二值模式等多种滤波器以优化特征质量。特征选择通过Spearman相关系数和Akaike信息准则等方法进行,最终TPF模型筛选出28个特征,GP模型筛选出23个特征。
模型构建的核心采用了图卷积网络这一深度学习架构,其优势在于能够处理非欧几里得数据结构,并通过节点间的关联捕捉患者群体中的复杂关系。在具体实现中,研究为TPF和GP队列分别建立了三种模型:仅基于临床特征的临床模型、仅基于磁共振成像特征的磁共振成像模型以及结合两者的磁共振成像-临床模型。图中每个节点代表患者的特征向量,边则表示特征间的相互作用,模型通过定向图卷积网络进行训练,以输出完全生物学反应的预测概率。为进一步解释模型决策,研究还引入了梯度加权类激活映射技术,可视化关键特征对预测结果的贡献。统计分析方面,团队使用受试者工作特征曲线下面积评估模型区分能力,并通过DeLong检验比较不同模型性能的差异,风险分层的截断值则依据Youden指数确定,同时采用Kaplan-Meier法和对数秩检验分析组间生存差异,所有分析均以P值小于0.05为显著性标准。
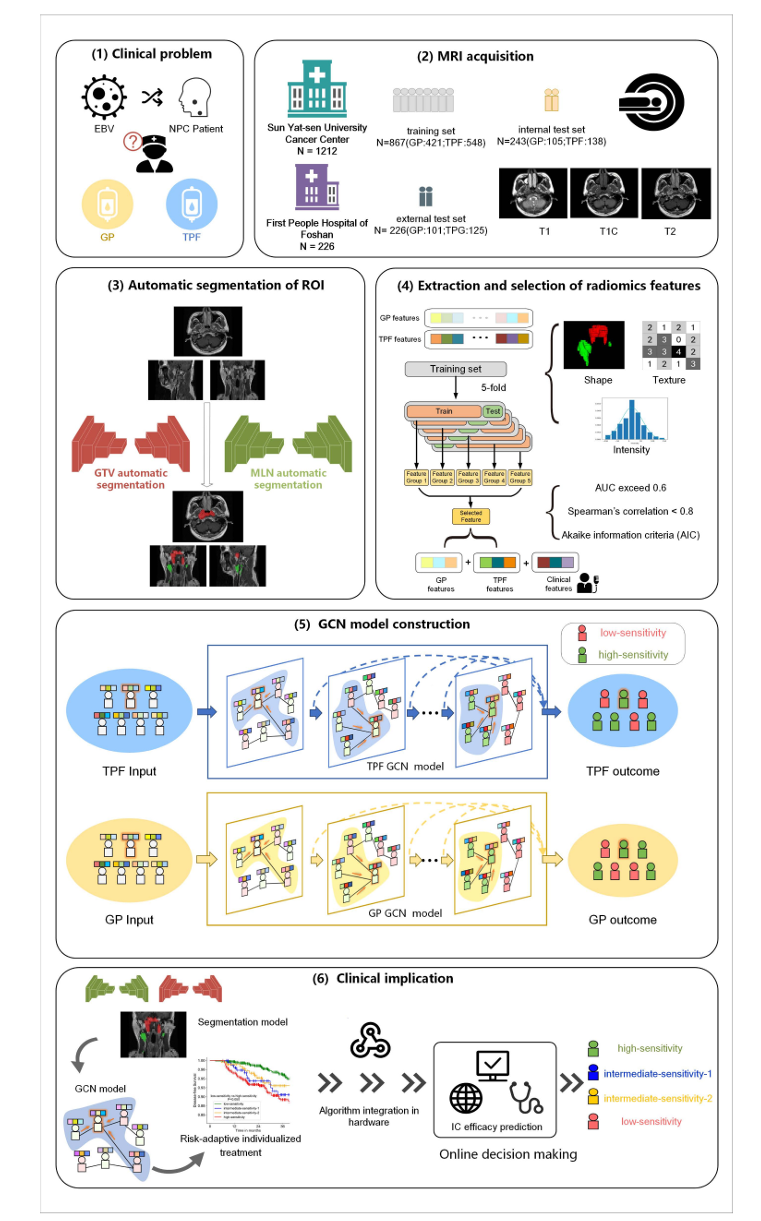
图1 本研究整体设计图示构建TPF和GP队列IC疗效预测模型的工作流程包括图像采集感兴趣区分割特征提取和选择GCN模型构建及临床意义
结果显示,在预测完全生物学反应方面,磁共振成像-临床模型和磁共振成像模型均显著优于仅依赖临床特征的模型。在TPF队列中,磁共振成像-临床模型在训练集、内部测试集和外部测试集的曲线下面积分别为0.770、0.838和0.671,而临床模型对应值仅为0.589、0.662和0.605;GP队列中,磁共振成像-临床模型的曲线下面积在三个数据集中分别为0.740、0.777和0.749,临床模型则仅为0.585、0.649和0.565。这一结果表明,融合影像组学特征能大幅提升预测准确性。通过风险分层,患者被划分为高敏感组和低敏感组,在TPF队列中,高敏感组在训练集、内部测试集和外部测试集中的比例分别为59.7%、55.6%和56.8%,低敏感组对应比例为40.3%、44.4%和43.2%;GP队列中,高敏感组比例分别为58.2%、57.7%和64.4%,低敏感组为41.8%、42.3%和35.6%。
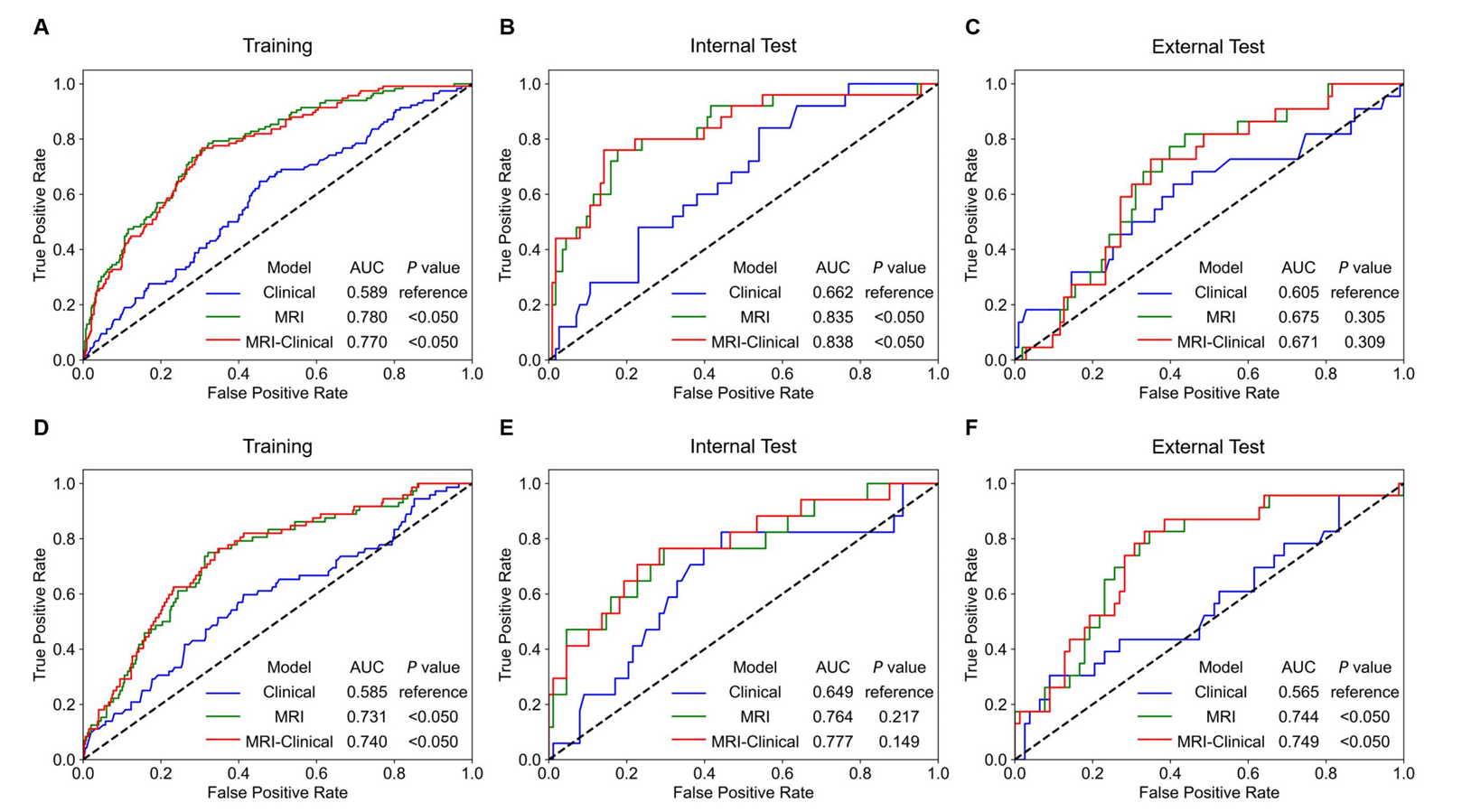
图2 训练集内部测试集和外部测试集中三种模型预测3周期IC后cBR信息的ROC曲线比较
生存分析进一步证实,基于磁共振成像-临床模型划分的高敏感组在所有数据集中均表现出更优的三年无病生存率,凸显了模型在预后评估中的价值。此外,研究还通过交叉预测将患者分为四类:高敏感组(对TPF或GP均敏感)占45.91%,中间敏感组1(仅对GP敏感)占12.37%,中间敏感组2(仅对TPF敏感)占12.43%,低敏感组(对两种方案均不敏感)占29.28%。生存曲线显示,高敏感组预后最佳,低敏感组最差,中间组别介于两者之间,这为临床方案选择提供了直观依据。基于上述结果,研究团队开发了一款在线工具,医生可输入患者的磁共振成像和临床数据,获取其对TPF或GP方案的预测反应值,从而制定个性化治疗策略,例如高敏感组可选择任意方案,中间敏感组1推荐GP,中间敏感组2推荐TPF,而低敏感组则需考虑免疫检查点抑制剂或西妥昔单抗等替代疗法。
总之,本研究的创新点在于首次将图卷积网络应用于鼻咽癌诱导化疗反应预测,并通过多中心数据验证了模型的稳健性。图卷积网络相比传统卷积神经网络具有更低的计算需求,本模型仅包含约8.41万参数,训练时GPU内存占用约184.6 MB,远低于三维ResNet50所需的12.7 GB,这使得其更适合在临床边缘设备中部署。然而,研究也存在一定局限性,例如回顾性设计可能引入选择偏倚,外部验证集中GP模型性能下降可能与扫描仪参数差异有关,这提示模型泛化能力仍需通过前瞻性研究和多中心合作进一步强化。此外,当前仅依赖EBV DNA作为反应标志物,未来结合影像学评估或许能提供更全面的疗效判断。综上所述,该深度学习工具为局部晚期鼻咽癌的个性化治疗提供了可靠支持,有望在临床实践中优化诱导化疗方案的选择,提升患者生存获益。
原始出处:
Chen, Z.-H., Han, X., Lin, L., Lin, G.-Y., Li, B., Kou, J., Wu, C.-F., Ai, X.-L., Zhou, G.-Q., Gao, M.-Y., Lu, L.-J., & Sun, Y. (2025). Harnessing deep learning to optimize induction chemotherapy choices in nasopharyngeal carcinoma. Radiotherapy and Oncology, 211, 111047. https://doi.org/10.1016/j.radonc.2025.111047
本文相关学术信息由梅斯医学提供,基于自主研发的人工智能学术机器人完成翻译后邀请临床医师进行再次校对。如有内容上的不准确请留言给我们。
猜你喜欢
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)