首页 > 医疗资讯/ 正文
多发性骨髓瘤(MM)是一种克隆性浆细胞恶性肿瘤,其特征为高度的染色体不稳定性以及不可避免的复发。过去二十年来,对MM进展过程中免疫失调和抑制认识的加深,推动了各种免疫疗法的发展。免疫治疗策略包括免疫调节剂、单克隆抗体、免疫检查点抑制剂、抗体-药物偶联物、嵌合抗原受体T细胞和双特异性T细胞衔接器,均在众多临床试验中得到评估,并显示出显著的临床疗效,尤其是在复发难治性MM患者中。然而,尽管免疫治疗取得了实质性进展,但经过多线治疗的患者由于治疗选择有限和多重耐药性的出现,仍然面临挑战。因此,识别新的靶点并开发额外的治疗方法,旨在防止免疫逃逸同时增强现有免疫疗法的疗效,仍是目前极为紧急的任务。
中国医学科学院血液病医院(中国医学科学院血液学研究所)邱录贵教授和郝牧教授等近日于《Chinese Medical Journal》发表综述,回顾了目前可用的免疫疗法,重点关注每种疗法的新靶点和产品,并对MM的未来发展方向提出展望。

引言
多发性骨髓瘤(MM)是第二常见的血液系统恶性肿瘤,其特征包括克隆性浆细胞的进行性生长、M蛋白的过度积累以及终末器官损伤。MM的进展与进行性免疫功能障碍密切相关,可归因于耗竭的免疫细胞、MM相关的免疫抑制细胞以及免疫抑制微环境中的可溶性介质。对MM发病机制的众多研究推动了针对免疫系统功能障碍和逃逸的免疫疗法的发展,使得过去二十年的5年总生存(OS)率有所提高。
目前可用的免疫疗法包括免疫调节剂(IMiDs)和单克隆抗体(mAbs),现已成为新诊断多发性骨髓瘤(NDMM)和复发/难治性多发性骨髓瘤(RRMM)的标准治疗方法。最近的工作进一步推动了新型免疫疗法的发展,如免疫检查点抑制剂(ICIs)、嵌合抗原受体T细胞(CAR-T)疗法、双特异性抗体和抗体-药物偶联物(ADCs),均在多个临床试验中得到广泛研究。尽管取得了这些进展,MM仍然无法治愈,多数会复发。此外,三重难治性疾病(对蛋白酶体抑制剂[PIs]、IMiDs和CD38单抗耐药)或五重难治性疾病(对2种PIs、2种IMiDs和一种CD38单抗耐药)由于靶点丢失或抗原逃逸,比其他类型更难治疗。因此,迫切需要针对MM的具有新靶点的新疗法,以改善临床反应并避免疾病复发。
免疫微环境在MM发展中的关键作用
MM与骨髓(BM)中的免疫微环境具有牢固的联系,通过复杂的动态相互作用,极大地促进了疾病进展和恶化。MM进展所需的关键突变存在于疾病的早期阶段,包括意义未明的单克隆丙种球蛋白病(MGUS)和冒烟型多发性骨髓瘤(SMM)。MM进展的特征是在MGUS/SMM阶段之前就开始的克隆结构变化,而非出现全新的亚克隆。对骨髓单个核细胞(BMNCs)的单细胞测序分析证实,除了肿瘤细胞的内在特性外,肿瘤微环境(特别是免疫微环境)对MM细胞的增殖也具有极大影响。在BM微环境中,炎症细胞因子(如白细胞介素(IL)-6和转化生长因子(TGF)-β)浓度的增加导致T细胞群的变化,促进肿瘤生长并促进免疫逃逸和免疫编辑。调节性T细胞(Tregs)通过免疫抑制干扰抗肿瘤反应,BM中CD8+T细胞与Tregs的比率可反映抗肿瘤免疫反应的强度,因此可以预测对免疫检查点阻断(ICB)疗法的反应,较高的CD8+/Treg比率表明抗肿瘤免疫反应更强。浸润的MM细胞破坏CD8+T细胞的正常分化,促进免疫抑制微环境的形成,这种破坏与PIM激酶和KLRB1的异常表达以及MM驱动的代谢失调有关。CD57+CD8+T细胞代表着一个终末分化、衰老和功能耗竭的亚群,其特征为增殖能力减弱、细胞毒性减弱和干扰素-γ产生减少。研究显示衰老与端粒无关,而各种免疫检查点,包括程序性死亡(PD)-1、细胞毒性T淋巴细胞相关蛋白-4、淋巴细胞活化基因(LAG)-3以及具有免疫球蛋白和ITIM结构域的T细胞免疫受体(TIGIT),常与免疫细胞耗竭相关。在T细胞衔接器(TCE)治疗前存在预先存在的耗竭样CD8+T细胞克隆(例如,颗粒酶K+或胸腺细胞选择相关高迁移率族盒蛋白+)可能与临床反应失败有关。
自然杀伤(NK)细胞的细胞毒性活性在MM中常常受到损害,原因为受体失调(例如激活受体表达减少)以及抑制受体和免疫检查点表达增加。人类白细胞抗原(HLA)-E的表达受转录因子cAMP反应元件结合蛋白1(CREB1)调控,后者直接与其启动子区域结合。HLA-E与NKG2A相互作用,向NK细胞传递抑制信号。重要的是,研究表明CREB1抑制剂治疗能有效恢复NK细胞介导的对MM细胞系和患者样本的细胞毒性。细胞外腺苷与MM进展相关:研究发现其水平与CD8+T细胞和NK细胞细胞毒性活性的降低以及Tregs比例的增加相关。髓源性抑制细胞(MDSCs)在MM患者的BM中含量丰富,主要通过诱导Treg分化、减少T细胞增殖以及促进MM细胞增殖和血管生成来抑制免疫反应。在MM细胞中,白细胞免疫球蛋白样受体B4(LLRB4)的表达增加促进MDSCs的生成,有助于建立和维持免疫抑制微环境。粒细胞性MDSCs通过促进Piwi相互作用RNA(piRNA)-823的表达来增强MM中的肿瘤进展和免疫抑制,piRNA-823促进DNA甲基化并增加MM细胞的致瘤潜力和癌症干细胞特性。
多项研究已证实,在诊断和复发时MM患者的BM肿瘤相关巨噬细胞中表达M2巨噬细胞标志物CD163和CD206。P-选择素糖蛋白配体-1与选择素之间以及细胞间粘附分子-1与淋巴细胞功能相关抗原1分别在巨噬细胞和MM细胞上的相互作用,激活Src和Erk1/2激酶以及c-Myc通路,最终抑制化疗药物诱导的caspase。IL-32γ通过部分依赖集落刺激因子1(CSF1)的上调驱动巨噬细胞向M2表型极化,从而促进MM的耐药性。由于CSF-1增强转移潜能,抑制CSF-1/CSF-1R活性不仅可能减缓癌症进展,还可靶向转移并防止恶性转化。吲哚胺2,3-双加氧酶是一种将色氨酸转化为犬尿氨酸代谢物的诱导酶,在MM中过度表达,有助于抑制抗骨髓瘤免疫力并促进BM中免疫抑制微环境的建立。
免疫疗法:概念、类别与历史
MM的免疫疗法侧重于操纵免疫系统以特异性识别、靶向和根除MM细胞。通过增强免疫系统将恶性细胞识别为威胁的能力,免疫疗法旨在启动更精确和有效的攻击。这种方法的目标不仅是增强免疫系统的靶向能力,还有助于维持持续的免疫反应,从而可能预防疾病复发并改善患者预后。
在20世纪60年代,口服烷化剂美法仑和泼尼松的联合用药是MM的标准一线治疗。随着柔红霉素的引入,由长春新碱、阿霉素和地塞米松组成的联合疗法于1983年开发用于治疗难治性MM,其疗效已在临床试验中得到证实。在20世纪80年代,自体BM移植(BMT)和异基因BMT与大剂量化疗一起被引入。这些策略通过免疫介导的移植物抗骨髓瘤效应实现了延长的疾病管理,同时促进了免疫平衡的恢复。2003年蛋白酶体抑制剂(PIs)的引入标志着一个重大进展,并导致无进展生存期(PFS)显著增加。继硼替佐米后,其他PIs(包括卡非佐米和伊沙佐米)也获批用于治疗MM。沙利度胺是一种IMiD,于1997年首次使用,并于2006年获得美国食品和药物管理局(FDA)批准。FDA随后于2006年批准使用来那度胺,并于2013年批准泊马度胺。
当前MM治疗领域处于动态变化中,且以免疫为基础的疗法快速发展为特征[图1]。
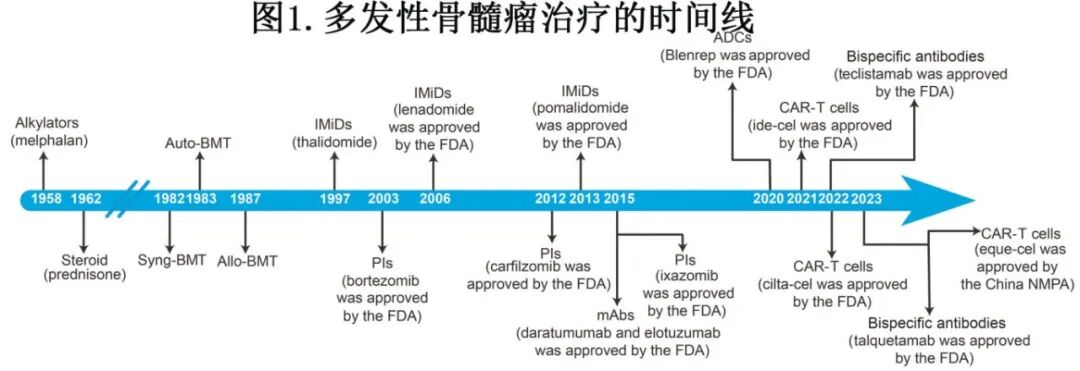
免疫疗法可大致分为四个主要部分。第一个组成部分是通过mAbs靶向MM细胞上存在的特定抗原。第二个组成部分是通过诸如检查点抑制剂等药物破坏免疫耐受机制。第三个组成部分是增强免疫效应细胞的数量和效力,特别是通过CAR-T、CAR自然杀伤细胞(CAR-NK)和疫苗等疗法旨在根除MM细胞。第四个组成部分是通过双特异性T细胞衔接器(BiTEs)和ADCs等治疗平台整合双重机制,这些平台同时靶向肿瘤抗原并发挥细胞毒性或免疫调节作用[图2]。这种多模式治疗旨在完善抗MM免疫反应并改善患者的治疗结局。
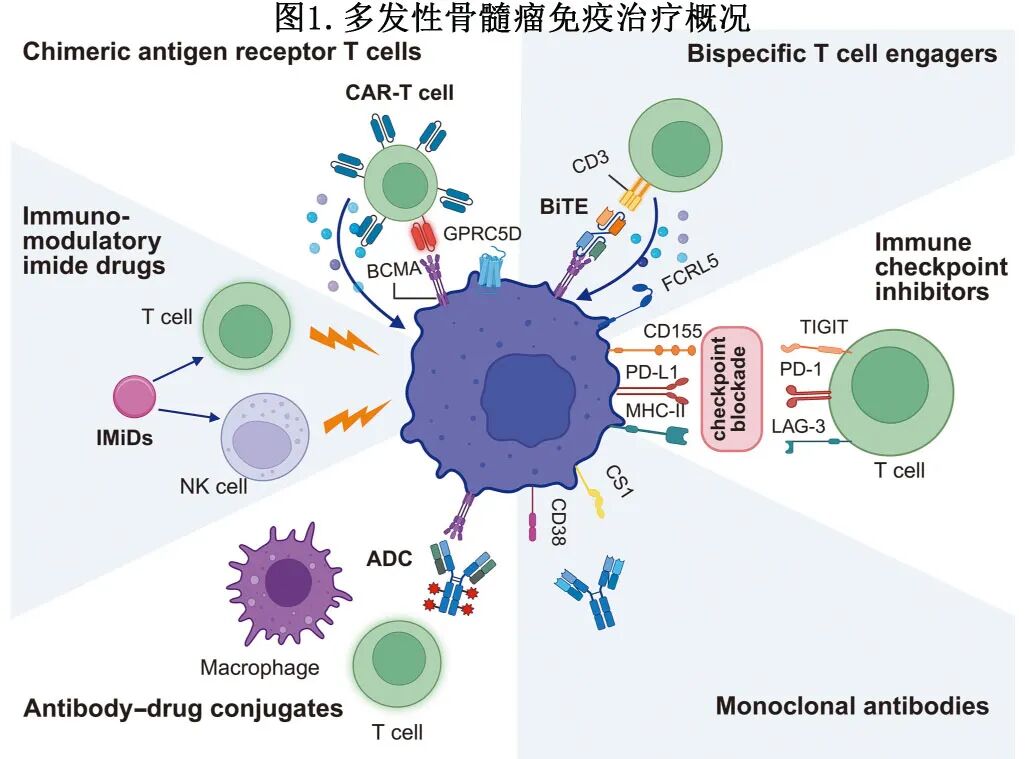
靶向新通路的免疫疗法
免疫调节剂(IMiDs)
IMiDs在NDMM和RRMM的联合治疗中起着至关重要的作用,也可用于自体干细胞移植(ASCT)后的维持治疗。沙利度胺的成功为MM的治疗注入了新的希望,导致了一系列基于其使用的临床试验。然而沙利度胺与显著的不良反应相关,并已逐渐被沙利度胺衍生物来那度胺和泊马度胺所取代,后者具有更好的耐受性和疗效。
IMiDs表现出一系列抗骨髓瘤效应,包括抗血管生成特性、诱导凋亡和抑制细胞生长。这些药物的机制直到2010年代才得以阐明,当时发现cereblon(CRBN)是沙利度胺的关键靶点。IMiDs充当分子胶:这些药物结合CRBN并将新底物连接到CRL4CRBN复合物,导致多聚泛素化和随后的蛋白酶体降解。在MM中,主要的新底物是转录因子Ikaros(IKZF1)和Aiolos(IKZF3),它们对浆细胞的发育和增殖至关重要。IMiD介导的IKZF1和IKZF3被CRL4CRBN复合物降解导致MM细胞中干扰素反应因子(IRF)4表达的下调,最终触发凋亡。除了直接的细胞毒性外,IMiDs还通过促进T细胞分泌IL-2和NK细胞产生干扰素-γ来调节免疫反应,从而增强两种细胞群体的活性。最近的研究表明,IMiDs可以通过ZAP-70介导的、不依赖CRBN的机制增强NK和T细胞的细胞毒性,为开发新型MM疗法提供了潜在靶点。
基于类似机制,近期开发了下一代cereblon E3连接酶调节剂(CELMoDs)。CELMoDs对CRBN的亲和力比传统IMiDs高20倍以上,导致IKZF1和IKZF3的降解显著增强,已在接受过多线治疗(包括来那度胺和泊马度胺)的RRMM患者中产生了有希望的临床结果。Iberdomide是一种新型有效的CELMoD,在临床前研究中显示出对MM细胞具有强大的抗增殖和促凋亡活性。一项多中心、多队列、开放标签的I/II期试验评估了iberdomide联合地塞米松在一组197名接受过至少三线既往治疗的RRMM患者中的临床效果。剂量递增队列的总缓解率(ORR)为32%(95%置信区间[CI] 23–43%;29/90),剂量扩展队列为26%(95% CI 18–36%;28/107)。尽管这种联合疗法的ORR不如靶向RRMM的B细胞成熟抗原(BCMA)治疗那么显著,但联合疗法的≥3级非血液学不良事件的发生率较低,表明其安全性更易管理且耐受性更好。对试验中RRMM参与者生物样本的分析表明,iberdomide不仅通过CRBN依赖的IKZF1和IKZF3降解发挥抗骨髓瘤作用,还通过免疫刺激,诱导T细胞转变为激活的记忆表型。Mezigdomide(CC-92480)是一种归类为CELMoD的新型化合物,对CRBN的结合亲和力甚至高于iberdomide。在MM细胞系中,mezigdomide通过与其他IMiDs相似的机制发挥抗骨髓瘤作用,但实现对IRF4和c-Myc更大的下调。此外,T细胞淋巴瘤研究表明,mezigdomide可以通过靶向IKZF1和ZFP91来克服来那度胺耐药性。正在进行的III期临床试验(编号CC-92480-MM-002)评估了mezigdomide联合地塞米松和硼替佐米的疗效。在19名接受过二至四线既往治疗(包括来那度胺)的RRMM患者中,所有剂量的ORR为73.7%(14/19),并且不良反应可控。这些发现表明该联合疗法具有有希望的初步临床结果,并支持进一步开发mezigdomide用于治疗RRMM。
单克隆抗体(mAbs)
近年来,mAbs已成为治疗MM的基石。在过去十年中,FDA已批准三种mAbs用于治疗MM,包括达雷妥尤单抗、艾莎妥昔单抗和elotuzumab。这些药物特异性靶向在MM细胞上高度且排他性表达的抗原,通过多种机制诱导细胞毒性。
抗CD38单抗
达雷妥尤单抗单药治疗在经过多线治疗的MM患者中显示出有希望的临床活性,ORR为29%,且安全性良好,为治疗RRMM带来了新希望。鉴于这些鼓舞人心的效果,达雷妥尤单抗已在不同MM患者亚组中与标准治疗方案联合进行了评估。在RRMM患者中,达雷妥尤单抗与IMiDs或PIs以及地塞米松联合,相较于单独标准治疗,具有更长的OS和更强的临床反应。
在不适合移植的NDMM患者中,达雷妥尤单抗为基础的联合方案显示出优越的临床疗效。在ALCYONE试验中,初步分析显示,达雷妥尤单抗联合硼替佐米、美法仑和泼尼松(D-VMP)相较于单独使用硼替佐米、美法仑和泼尼松(VMP)显著延长中位PFS。在中位随访40个月后,中位PFS的显著改善得以维持(风险比[HR] 0.42 [95% CI 0.34–0.51];P <0.0001)。在适合移植的NDMM患者中,达雷妥尤单抗被纳入硼替佐米、沙利度胺和地塞米松方案(D-VTd),在ASCT之前和之后的诱导和巩固阶段使用。在ASCT前后给药时,D-VTd在中位PFS(83.7 vs. 52.8个月)、严格完全缓解率(sCR)(29% vs. 20%;HR 1.60, 95% CI 1.21–2.12, P = 0.0010)和微小残留病(MRD)阴性率(64% vs. 44%)方面相较于单独VTd具有临床优势。[63] 此外,巩固后的达雷妥尤单抗维持治疗相较于单独标准VTd导致PFS显著改善(中位未达到[95% CI 79.9–不可估计(NE)] vs. 45.8个月[41.8–49.6个月];HR 0.49 [95% CI 0.40–0.59];P <0.0001)。然而,静脉注射达雷妥尤单抗需要较长的输注时间,并可能导致输注相关反应,这可能对患者的生活质量产生不利影响。最近,开发了一种用于皮下注射的达雷妥尤单抗新制剂,以减少给药时间和过敏反应的发生率。在一项随机III期试验中,发现皮下注射达雷妥尤单抗在保持不劣于静脉注射达雷妥尤单抗的疗效和药代动力学的同时,具有改善的安全性。
艾莎妥昔单抗是一种免疫球蛋白G1(IgG1)单抗,靶向与达雷妥尤单抗不同的特定CD38表位。艾莎妥昔单抗的临床疗效也在将其纳入标准治疗方案的临床试验中进行了评估。来自ICARIA-MM和IKEMA试验的结果导致艾莎妥昔单抗和地塞米松与泊马度胺或卡非佐米的联合疗法获批治疗RRMM。与达雷妥尤单抗类似,艾莎妥昔单抗与来那度胺、地塞米松和硼替佐米联合给药,在诊断为NDMM的适合移植和不适合移植的患者中均带来了临床改善。然而直接比较达雷妥尤单抗和艾莎妥昔单抗临床效果的研究很少。一项评估艾莎妥昔单抗在达雷妥尤单抗难治性疾病患者中安全性和有效性的III期研究结果表明,艾莎妥昔单抗在这一特定患者群体中没有临床效果。具体而言,艾莎妥昔单抗在达雷妥尤单抗难治性MM患者中未引起任何客观缓解。这一发现表明,艾莎妥昔单抗在先前接受过达雷妥尤单抗治疗的RRMM患者中没有临床疗效。
抗CS1单抗
Elotuzumab是一种人源化IgG1单抗,特异性靶向信号淋巴细胞活化分子F7(SLAMF7),也称为CS1或CD319。SLAMF7是一种细胞表面糖蛋白,主要在MM细胞和正常浆细胞上表达,也在NK细胞和CD8+ T细胞上表达。Elotuzumab通过刺激NK细胞介导的Fcγ受体(FcγR)介导的抗体依赖性细胞毒性以及巨噬细胞介导的抗体依赖性细胞吞噬作用来发挥其抗肿瘤作用。Elotuzumab作为单药治疗的抗肿瘤活性有限,但与IMiDs联合时显示出显著的临床疗效。
随机III期ELOQUENT-2试验评估了elotuzumab、来那度胺和地塞米松(ERd)联合用药在接受过一至三线既往治疗的RRMM患者中的效果。长期随访结果显示,与单独使用来那度胺和地塞米松(Rd)相比,ORR增加(79% vs. 66%)、中位PFS延长(19.4 vs. 14.9个月),并且OS有显著获益(48.3 vs. 39.6个月,HR 0.82 [95.4% CI 0.68–1.00])。当与泊马度胺和地塞米松联合使用时,在接受过来那度胺和PI预治疗的RRMM患者中,与单独使用泊马度胺和地塞米松(Pd)相比,elotuzumab在中位PFS(从4.7个月延长至10.3个月)和OS(从17.4个月延长至29.8个月,HR 0.59 [95% CI 0.37–0.93];P = 0.0217)方面显示出显著改善。
新兴mAbs靶点
CD98重链(CD98hc)因其在MM细胞增殖和存活中的关键作用而成为MM中一个有前景的治疗靶点,但也在正常造血和非造血细胞上的普遍表达,对选择性靶向MM细胞构成了重大挑战。最近,Hasegawa等人鉴定了一种单抗RSH283,它能特异性识别MM细胞上表达的CD98hc,而不与正常组织相互作用。这种特异性归因于MM细胞上表达的CD98hc糖型与正常细胞不同,表明CD98hc是MM中基于单抗治疗的可行靶点。
IL-6是MM细胞存活的关键生长因子,可被司妥昔单抗靶向。一项随机、双盲、多中心研究评估了司妥昔单抗在延迟高危SMM向症状性MM进展方面的疗效。结果显示,与安慰剂相比,PFS显著改善(未达到 vs. 23.5个月,HR 0.50 [95% CI 0.24–1.04];P = 0.0597),且安全性良好,表明司妥昔单抗在延迟疾病进展方面具有潜在的临床获益。
免疫检查点抑制剂(ICIs)
T细胞和NK细胞表达多种免疫检查点受体,如PD-1、TIGIT和LAG-3。随着疾病进展以及这些免疫细胞与肿瘤微环境的相互作用,免疫检查点受体的表达水平增加,导致免疫细胞衰老或耗竭,这一过程促进肿瘤免疫逃逸。通过阻断抑制性受体与其配体之间的相互作用,ICIs在实体瘤和血液恶性肿瘤的治疗中取得了显著进展。然而在MM中,ICIs作为单药治疗的疗效有限。在最近的研究中,将ICIs与IMiDs、mAbs或其他ICIs联合使用已产生有希望的结果。然而,在2017年,FDA暂停了涉及IMiDs(泊马度胺或来那度胺)和地塞米松与ICIs(帕博利珠单抗或纳武利尤单抗)联合使用的三项正在进行中的III期临床试验,原因主要是严重的不良反应和高死亡率。这一决定随后影响了涉及ICIs联合治疗的其他研究,导致数个项目中止。
当前临床试验的结果表明,针对单一免疫检查点的单药治疗,例如PD-1/PD-配体1(L1)阻断, 或简单的ICI联合方案往往无法达到最佳治疗效果,识别精确的生物标志物并阐明协同机制对于提高治疗效果至关重要。NCT04150965评估了抗TIGIT或抗LAG3抗体与泊马度胺和地塞米松联合用药在接受过PI或IMiD治疗的RRMM患者中的效果。研究表明,该联合方案耐受性良好,并在两个治疗组中均实现持久的临床缓解。具体而言,抗TIGIT组6名患者中有3名缓解,而抗LAG3组6名患者中有2名缓解。两组之间的免疫反应谱不同:抗LAG3应答者表现出更高水平的初始CD4+ T细胞和更低的PD-1表达,而抗TIGIT应答者显示CD226表达增加和NK细胞活性增强。
接受过至少三线既往治疗(包括PI、IMiD和抗CD38单抗)的RRMM患者被纳入一项研究,以评估2.5 mg/kg 玛贝兰妥单抗联合帕博利珠单抗治疗的有效性和安全性。34名患者中ORR为47%(95% CI 29.8%–64.9%),10名达到≥非常好的部分缓解(VGPR)的患者中有3名为MRD阴性。在先前接受过抗BCMA治疗的患者亚组中,8名患者中有5名达到≥部分缓解(PR),包括两名BCMA难治性疾病患者。该方案耐受性良好,不良事件可控,未显著影响生活质量。这些发现凸显了联合免疫疗法在克服RRMM治疗耐药性方面的潜力。
Cobimetinib(MEK抑制剂)、维奈克拉(BCL-2抑制剂)和atezolizumab(PD-L1抑制剂)的联合用药在接受过三至五线既往治疗(包括PI和IMiD)的RRMM患者中显示出中等疗效和良好的安全性,携带t(11;14)易位的患者表现出极佳的缓解。具体而言,cobimetinib单药治疗的反应率为0%,cobimetinib-维奈克拉双药治疗为27.3%,完全联合治疗为28.6%;而在t(11;14)阳性患者中,cobimetinib-维奈克拉的缓解率增加至50%,全联合治疗的缓解率更是达到100%。这些结果强调了靶向治疗对于具有遗传定义MM亚组的潜力。一项评估EOS884448(一种TIGIT抑制剂)作为单药或与iberdomide联合在RRMM患者中疗效的III期研究(编号NCT05289492)因公司战略决策而终止。多组学分析等先进技术将使我们能够更深入地理解免疫逃逸机制,并制定个性化免疫治疗策略以改善RRMM患者的预后。
抗体-药物偶联物(ADCs)
ADCs是治疗MM的一种有前景的治疗策略,它们将mAbs的肿瘤靶向特异性与化疗药物的细胞毒性效力结合起来,能够在最小化对正常组织损伤的同时,靶向消除MM细胞。玛贝兰妥单抗是首个获得FDA批准(2020年加速获批上市,后因关键研究未达主要终点为撤回,2025年10月重新获批上市)的靶向BCMA的、治疗RRMM的ADC,用于接受过四线或以上既往治疗的患者。这一批准引起了将ADCs应用于MM的极大兴趣,随后推动了针对骨髓瘤细胞表达抗原的多种治疗候选药物的开发[表1]。ADCs包含三个核心组成部分:一个mAb、一个连接子和一个细胞毒性有效载荷。在与MM细胞表面的肿瘤相关抗原结合后,ADCs通过内吞作用被内化。在细胞内,连接子被切割,释放出细胞毒性有效载荷,以精确靶向并根除MM细胞。
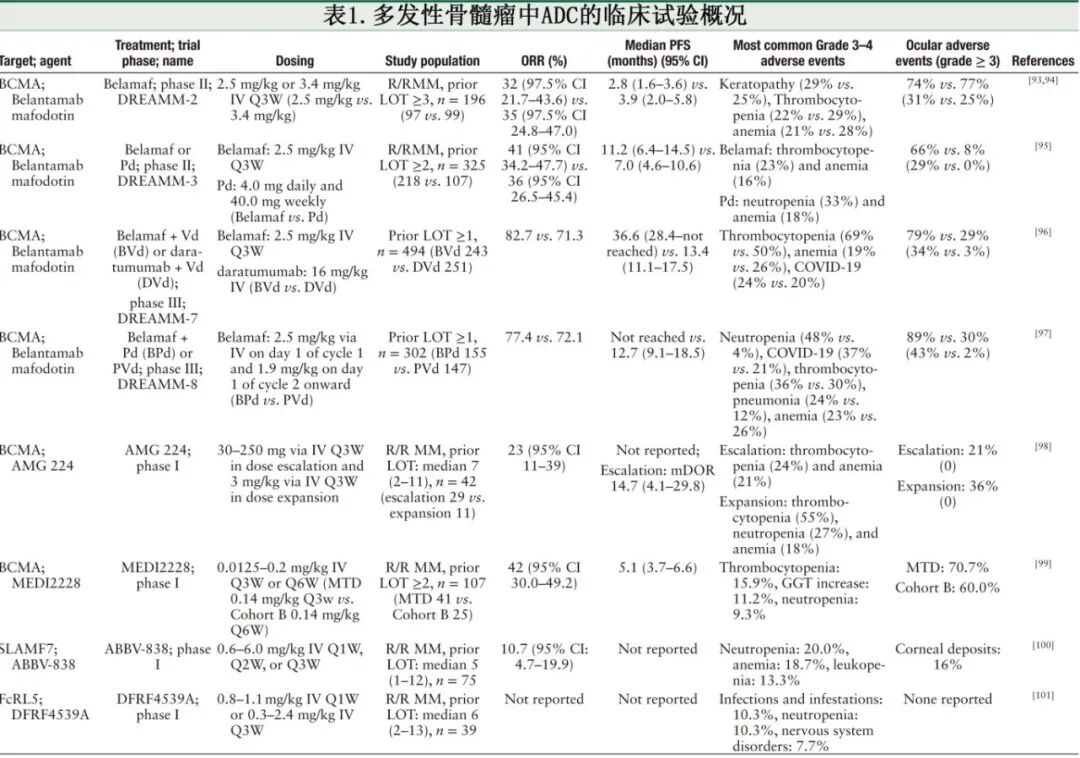
B细胞成熟抗原(BCMA)作为关键治疗靶点
BCMA也称为TNFRSF17,是肿瘤坏死因子(TNF)受体超家族的成员,主要在恶性和正常浆细胞上表达,在其他正常组织中表达极少。这种受限的表达模式降低了脱靶毒性的风险,使BCMA成为开发ADCs的一个有吸引力的靶点。
在靶向BCMA的ADC玛贝兰妥单抗中,一个mAb通过专门的连接子与细胞毒性剂单甲基澳瑞他汀E(MMAE)连接。尽管FDA于2023年2月因DREAMM-3试验中不利的临床结果撤回了该ADC的生物制品许可,但后续研究(包括DREAMM-7和DREAMM-8试验)仍证明了其在MM中的治疗潜力。
III期DREAMM-7试验评估了玛贝兰妥单抗、硼替佐米和地塞米松(BVd)联合方案在至少接受过一线治疗后进展的MM患者中的疗效和安全性。中位随访28.2个月后,BVd方案的中位PFS为36.6个月(95% CI 28.4个月 – 未达到),显著超过达雷妥尤单抗、硼替佐米和地塞米松(DVd)组的13.4个月(HR 0.41;95% CI 0.31–0.53;P <0.001)。18个月时BVd组的OS达到84%,而DVd组为73%;BVd组中25%达到MRD阴性状态且达到≥CR,而DVd组为10%。然而,在接受BVd的患者中95%发生≥3级不良事件,而接受DVd的患者为78%。眼部事件在BVd组更常见(79% vs. 29%),但通常可通过剂量调整进行管理。重要的是,大多数视力下降病例随着时间的推移得到缓解,证明了该方案在临床实践中的可行性。在DREAMM-8 III期试验中,玛贝兰妥单抗、泊马度胺和地塞米松(BPd)联合用药在暴露于来那度胺且接受过至少一线治疗的RRMM患者中,相较于泊马度胺、硼替佐米和地塞米松(PVd)联合用药显示出优越的疗效。在接受BPd的患者中,71%(95% CI 63–78%)达到了12个月PFS(vs. PVd组的51%,95% CI 42–60%),77%达到至少PR(vs. PVd组的72%),40%达到≥CR(vs. PVd组的16%)。尽管疗效强劲,但≥3级不良事件的发生率分别为94%和76%。BPd治后眼部不良事件发生率达89%,但可控,仅9%因毒性停药。
HDP-101是一种创新的靶向BCMA的ADC,包含一个与α-鹅膏蕈碱偶联的抗BCMA mAb,α-鹅膏蕈碱是一种特异性抑制RNA聚合酶II的毒素。临床前研究表明,HDP-101在体外对处于增殖和静止状态的BCMA阳性MM细胞均具有显著的细胞毒性。在体内,该ADC显示出强大的抗肿瘤潜力,单次给药在MM模型(包括鼠异种移植模型和食蟹猴模型)中可产生良好的治疗效果。目前HDP-101正在一项I/IIa期试验中进行临床评估。在纳入前五个剂量递增队列的18名RRMM患者中,17名可评估剂量限制性毒性。前四个剂量队列显示出良好的耐受性,未观察到剂量限制性毒性。在队列5中,4名患者在三到四个周期的治疗后显示出令人鼓舞的结果:两名达到PR,两名保持疾病稳定(SD)。这些初步结果突显了HDP-101在解决MM当前未满足治疗需求方面的潜力,值得在后期临床试验中进一步探索。
MEDI2228是一种ADC,将一个全人源化的靶向BCMA的抗体与一个吡咯并苯二氮卓二聚体结合在一起。MEDI2228的疗效在一项涉及RRMM患者的I期临床试验中进行了评估,这些患者先前接受过≥3线治疗,包括PIs、IMiDs和mAbs。MEDI2228显示出令人鼓舞的疗效,在最大耐受剂量队列中达到56.1%的ORR(95% CI 39.7%-71.5%),在三重难治患者中达到53.3%(16/30)。然而该药物的开发因显著的不良事件而受阻,特别是眼部毒性,如畏光,从而限制了其临床应用。AMG 224是另一种靶向BCMA的ADC,由一种抗BCMA IgG1抗体与抗微管剂美登素衍生物偶联而成。作为单药治疗,该药物在深度治疗的RRMM患者中显示出疗效,在临床试验中达到23%的ORR(95% CI 11-39%)。尽管AMG 224的毒性谱通常可控,但血小板减少症成为最突出的不良事件。值得注意的是,AMG 224相对于其他BCMA靶向疗法的ORR不高,凸显了其作为RRMM单药治疗的局限性。
CC-99712是另一种靶向BCMA的ADC,已被评估以确定其在RRMM患者中的治疗潜力。启动了一项I期临床试验(编号NCT04036461)来评估其疗效,但由于患者招募困难而提前终止。
扩展ADC靶点格局:MM中的新靶点
近年来,ADCs的进展已超越传统的BCMA靶点,扩展到包括新靶点,如G蛋白偶联受体C类第5组成员D(GPRCSD)、CD38、CD46和Fc受体样(FCRL)5,从而拓宽了MM的治疗格局。
GPRCSD
在这些靶点中,GPRCSD因其在MM细胞中的高表达而成为一个有前景的治疗候选靶点。AZD0305是首个专门设计用于靶向GPRCSD的同类ADC,在临床前研究中显示出强大的抗肿瘤活性。目前正在一项涉及RRMM患者的I期临床试验(编号NCT06106945)中评估AZD0305的疗效和安全性,患者招募正在进行中。另一种新型靶向GPRCSD的ADC为LM-305,在MM模型中显示出强大的临床前抗肿瘤活性。LM-305对GPRCSD表现出高结合亲和力、高效内化和在MM细胞系中的强细胞毒性。在异种移植小鼠模型中,LM-305诱导剂量依赖性肿瘤消退,并在3 mg/kg剂量下在GPRCSD高表达肿瘤中达到CR,同时保持良好的安全性。这些临床前发现支持将LM-305作为有GPRCSD表达的RRMM患者的一种有前景的治疗选择进一步开发。
CD38
CD38是一种在MM细胞表面大量表达的跨膜糖蛋白,在肿瘤增殖、免疫抑制和免疫逃逸中起着关键作用,使其成为MM治疗的关键治疗靶点。STI-6129是一种ADC,包含全人源化抗CD38抗体STI-5171,通过专有的非聚乙二醇基连接子与微管抑制剂duostatin-5.2(Duo-5.2)连接。临床前研究表明,STI-6129在CD38+血液学模型中,无论在体外还是体内,均表现出强大的抗肿瘤活性。目前正在进行两项临床试验(编号NCT05565807 [招募中] 和 NCT05308225 [活跃,未招募]),均旨在评估STI-6129在RRMM患者中的安全性、药代动力学和初步疗效。MT-0169也称为TAK-169,是另一种由CD38抗体片段与去免疫化的志贺样毒素A亚单位有效载荷偶联组成的ADC。临床前研究表明,MT-0169对MM细胞(包括新诊断、耐药和RRMM细胞)发挥强大的细胞毒性作用。体内研究进一步证实了其显著的抗肿瘤活性。一项I期临床试验(编号NCT04017130)已启动,旨在评估MT-0169在RRMM患者中的安全性和疗效。早期结果表明,在50 mg/kg剂量下,MT-0169能有效结合其CD38靶点并显著降低NK细胞计数。然而两例心脏不良事件导致FDA实施了部分临床暂停,在提交了更新的安全性数据后,该限制被解除,允许试验继续进行。
CD46
CD46在携带1q染色体增益的MM患者和难治性疾病患者中经常过度表达,其水平在IMiD治疗后进一步升高。FOR46是一种靶向CD46并与vc-MMAE偶联的ADC,在临床试验中显示出良好的疗效。在纳入剂量递增队列(1.8和2.4 mg/kg)的三重难治MM患者中,6名可评估参与者中有3名达到PR。此外,FOR46表现出可接受的毒性特征,支持其作为该患者群体的可行治疗选择的潜力。
FGRL5
FGRL5也称为FGRH5,是一种细胞表面受体和免疫球蛋白超家族成员,在B细胞谱系中表达上调,在正常和恶性浆细胞上均观察到高水平表达。DFRF4539A是一种与MMAE偶联的靶向FcRH5的ADC,已在RRMM背景下进行了临床评估。然而在一项I期试验中其疗效有限,5%的患者达到PR,3%表现出轻微反应,46%维持SD,41%经历疾病进展。95%的患者报告了不良事件,21%发生严重不良事件,39%发生≥3级事件。贫血是最常报告的不良事件,发生率26%。尽管耐受性尚可,但DFRF4539A在此背景下未能显示出显著的临床获益。目前正在评估几种其他靶向MM细胞表面抗原的ADC,包括STRO-001(靶向CD74,包含单甲基澳瑞他汀F)、indatuximab ravtansine(靶向CD138,包含美登素衍生物DM4)、lorvotuzumab mertansine(靶向CD56,包含美登素)和SGN-CD48A(靶向CD48,包含MMAE)。
平衡疗效与安全性:MM中ADC的挑战与未来方向
MM中ADC的治疗动态特点较为分歧。虽然一些ADC表现出强大的抗骨髓瘤疗效,但其临床应用常常受到严重不良效应的限制。而具有更良好安全性的ADC往往无法达到预期的治疗效果,特别是在经过多线治疗的RRMM队列中。这种在疗效和耐受性之间持续的权衡凸显了迫切需要进一步研究MM发病机制并阐明基于ADC疗法的分子和细胞机制。这些见解对于指导合理设计下一代ADC至关重要,使其能够有效平衡强效抗骨髓瘤疗效与可管理的安全性。
CAR-T细胞疗法
近年来,CAR-T细胞疗法已成为癌症治疗中最具创新性和前景的策略之一,显示出前所未有的疗效,尤其是在血液恶性肿瘤中。CAR-T细胞疗法始于白细胞分离术,从患者或健康供者中分离CD3+T细胞, 分离出的T细胞然后在体外扩增和激活,随后用载体转导以表达能够识别肿瘤特异性抗原的CARs。这些在T细胞上表达的CARs由几个结构组件组成。单链可变片段(scFv)形成CAR的胞外域,负责识别肿瘤相关抗原,且不依赖于HLA呈递。通过铰链区和跨膜结构域连接,CAR的胞内域包含一个CD3ζ信号域(第一代)、一个共刺激域(第二代)或两个共刺激域(第三代),以诱导T细胞扩增并增强持久性。制造完成后,CAR-T细胞在清淋化疗后回输给患者。
在MM中,理想的CAR-T细胞靶点应在MM细胞上选择性且丰富地表达,而在正常组织中不表达。目前BCMA是MM中研究最广泛的CAR-T靶点,因为它仅在浆细胞和MM细胞上分布。靶向BCMA的CAR-T细胞疗法在RRMM患者中显示出显著的有效性,显著延长了OS。FDA已批准两种抗BCMA CAR-T细胞疗法,idecabtagene vicleucel(ide-cel, bb2121, 由Celgene公司开发)和ciltacabtagene autoleucel(cilta-cel, JNJ-4528, 由Janssen Biotech公司开发),用于治疗RRMM患者。
尽管其疗效显著,但靶向BCMA的CAR-T细胞疗法也面临着诸如总抗原丢失和抗原逃逸等挑战,可损害抗肿瘤效果并最终导致复发,因此识别MM细胞表面的新靶点至关重要。已在MM上发现了众多靶点,并且针对这些靶点的CAR-T细胞的疗效已在临床前模型和临床试验中得到证明[表2],相关靶点包括CD19、CD38、CD138、CD229、GPRCSD、SLAMF7/CS1、增殖诱导配体(APRIL)、跨膜激活剂和CAML相互作用因子(TACI)、NKG2D配体、整合素β7和FcRL5。本综述重点介绍靶向BCMA和非BCMA抗原的CAR-T细胞疗法的临床疗效和安全性,特别关注那些显示出良好安全性以及对于RRMM具有引人注目治疗潜力的新靶点。
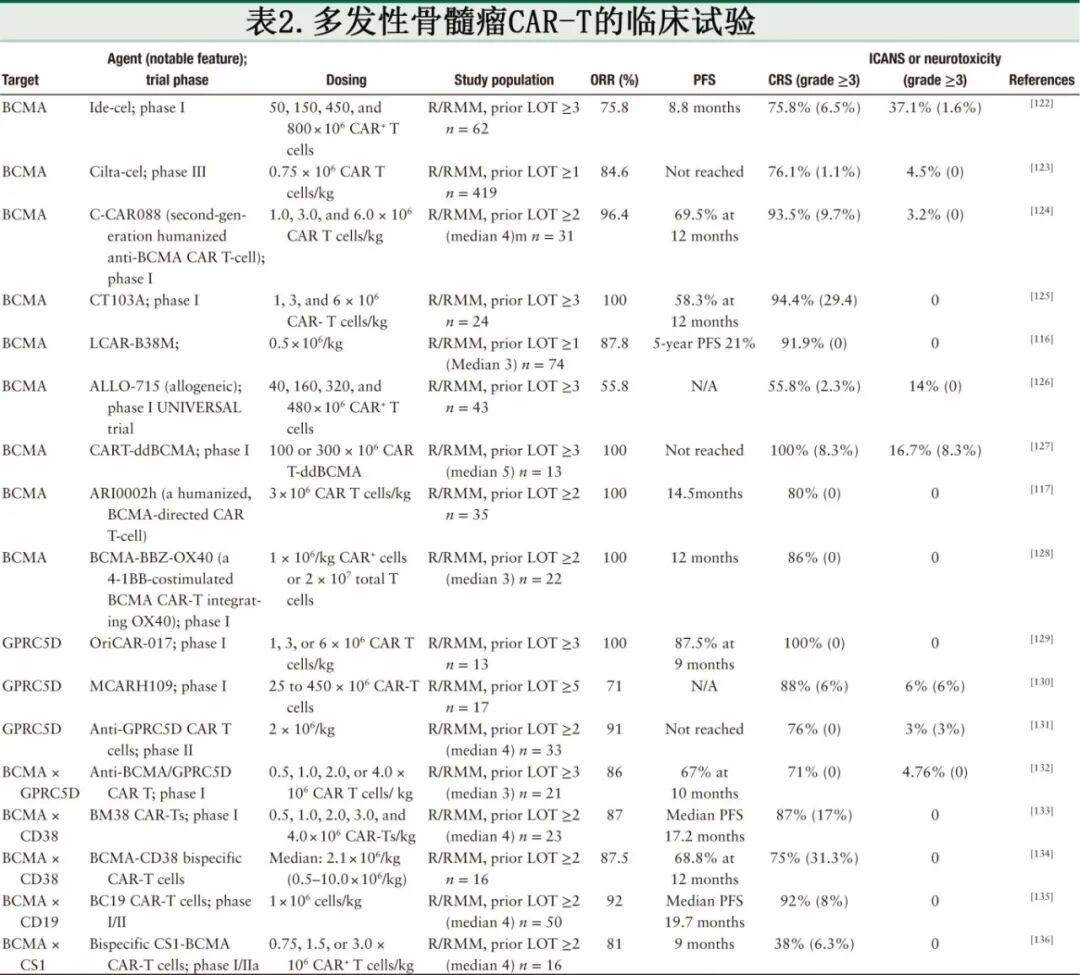
靶向BCMA的CAR-T细胞疗法
BCMA是TNF受体超家族的一员,在MM细胞、浆细胞和成熟B细胞亚群上持续表达,强度不一,但不存在于造血干细胞或正常组织中,使得BCMA成为CAR-T细胞疗法的理想靶点。BCMA与B细胞激活因子(BAFF)和APRIL相互作用,它们对MM细胞的存活、增殖和分化至关重要。2021年,FDA批准了抗BCMA CAR-T细胞疗法ide-cel和cilta-cel用于接受过≥4线既往治疗的RRMM患者。受到抗BCMA CAR-T细胞疗法显著临床结果的鼓舞,临床试验越来越多地评估这些疗法。
首个靶向BCMA的CAR-T细胞人体研究由美国国家癌症研究所(NCI)进行。总共24名接受过中位7.5线既往治疗的RRMM患者在清淋化疗后接受不同剂量的抗BCMA CAR-T细胞(范围从0.3×106细胞/kg到9×106细胞/kg)。在接受最高剂量的16名患者中,ORR为81%,≥VGPR率为63%。这些结果强调了靶向BCMA的CAR-T细胞在经过多线治疗的RRMM患者中的显著疗效。这项研究首次证明了非CD19 CAR-T细胞的强大临床疗效,深刻地改变了CAR-T细胞开发的格局。
Ide-cel是最先进的抗BCMA CAR-T细胞产品,已在RRMM中得到广泛研究。Ide-cel采用了与NCI产品相似的scFv,以及一个4-1BB共刺激域。一项I期研究在接受了至少3线既往治疗的RRMM患者中证明了其良好的临床疗效,为评估ide-cel安全性和有效性的II期及后续研究铺平了道路。在II期KarMMa-2试验中,ide-cel在三重暴露RRMM患者中获得显著且持久的缓解,ORR达到73%,其中33%的患者达到≥CR。中位随访13.3个月时,中位OS为19.4个月,中位PFS为8.8个月(95% CI 5.6–11.6个月),表明单次ide-cel输注具有强劲疗效。≥3级毒性作用的发生率不超过6%,其中3级神经毒性作用发生率为3%。 III期KarMMa-3试验评估了ide-cel与标准方案在接受过二至四线既往治疗的RRMM患者中的临床疗效。中位随访18.4个月时,ide-cel显著延长PFS(13.3 vs. 4.4个月,HR 0.49;95% CI 0.38–0.65;P <0.001)并实现ORR获益(与RRMM患者的标准方案相比)。
Cilta-cel是FDA批准的第二种用于治疗MM的CAR-T细胞疗法,特异性靶向BCMA。多项试验一致证明了其临床疗效,尤其是在RRMM患者中。在III期CARTITUDE-1试验(编号NCT03548207)中,97名RRMM患者接受了推荐目标剂量为0.75 × 106CAR阳性活T细胞/kg的cilta-cel。ORR达到98%(95% CI 92.7–99.7%),其中83%的患者达到sCR。中位PFS为34.9个月(95% CI 25.2个月-不可估计)。在49名可评估MRD的患者中,26名维持MRD阴性超过12个月,20名同时达到MRD阴性和sCR。细胞因子释放综合征(CRS)发生率92%,其中≥3级CRS为9%。神经毒性发生率21%,并且通常可控,表明总体安全性可控。
cilta-cel的疗效在III期CARTITUDE-4试验(编号NCT04181827)中得到进一步证实,这是一项纳入来那度胺难治性MM患者的随机对照研究。在接受cilta-cel的208名患者中,12个月PFS率为75.9%(95% CI 69.4–81.1%),显著高于标准治疗组的48.6%(95% CI 41.5–55.3%)。ORR为84.6%,73.1%的患者达到≥CR,60.6%达到MRD阴性;在统计学上均优于对照组(分别为67.3%、21.8%和15.6%)。尽管在大多数患者中观察到CRS,但3-4级CRS发生率仅1.1%,神经毒性事件主要为轻度至中度。
Cilta-cel已在临床环境中得到广泛研究,其应用已从单药治疗发展到联合方案,并跨越了越来越广泛的疾病阶段。但挑战依然存在,特别是关于疾病复发和治疗相关不良事件,如CRS。需要进一步的机制研究来阐明耐药性和毒性的根本原因,从而优化cilta-cel治疗MM的临床获益和长期结局。
Equecabtagene autoleucel(eque-cel)是一种全人源化抗BCMA CAR-T产品,于2023年在中国获得监管批准,用于治疗接受过至少三线既往治疗的RRMM患者。在关键FUMANBA-1研究中,eque-cel显示出强大的临床疗效,在可评估患者中达到96.0%的ORR和74.3%的CR或更好率。12个月PFS率为78.8%(95% CI 68.6–86.0%),95%的患者观察到MRD阴性。值得注意的是,eque-cel在75%先前经历过其他CAR-T疗法失败的患者中诱导了临床反应,强调了其克服CAR-T耐药性的潜力。最常报告的不良事件是CRS,发生在93.2%的患者中;大多数病例严重程度为1-2级。免疫效应细胞相关神经毒性综合征(ICANS)罕见,仅1.9%,且仅限于1-2级事件。总体而言,eque-cel表现出良好的安全性和耐受性。对eque-cel的临床研究正在进行中,以进一步验证其治疗效果并扩大其适应症。当前的临床试验正在评估其在各种环境下的应用,包括RRMM(NCT05698303)、与塞利尼索联合治疗R/R髓外骨髓瘤(NCT05201118)、自身免疫性神经系统疾病(CARTinNS, NCT04561557)以及作为新诊断高风险MM一线治疗的一部分(FUMANBA-2, NCT05181501)。这些研究旨在进一步阐明eque-cel的临床效用并拓宽其治疗格局。
非BCMA靶向的CAR-T细胞
GPRCSD
GPRCSD主要在MM患者的BM浆细胞上表达。在正常组织中,GPRCSD的表达主要限于毛囊。小鼠的临床前研究表明,靶向GPRCSD的CAR-T细胞即使在BCMA抗原逃逸模型中也能有效消除MM异种移植物并延长生存期,而不会诱导脱发或其他GPRCSD介导的毒性。
这些结果导致靶向GPRCSD的CAR-T细胞产品快速发展,并在临床试验中进行了评估,显示出令人鼓舞的疗效。MCARH109是一种靶向GPRCSD的CAR-T细胞产品,在一项I期研究中,以四个剂量水平给予RRMM患者。总体而言,71%(12/17)和58%(7/12)接受无明显副作用剂量(25 × 106 至 150 × 106 细胞)的患者获得了临床反应。OriCAR-017是另一种基于GPRCSD的CAR-T细胞产品,也显示出显著的效力,在I期临床试验中ORR达到100%(10名患者中的10名),且无严重不良事件。这些阳性反应可能归因于OriCAR-017的特性,包括高度人源化、双表位识别和低基础信号诱导。与之类似,一项II期研究报告了高达91%的ORR(95% CI 76–98%;30/33),可能与随访时间较短且患者治疗程度较其他研究报告的轻有关。
这些研究也评估了靶向GPRCSD的CAR-T细胞的安全性,显示CRS发生频率高但级别低。最常见的3级或4级不良事件包括血液学毒性,如中性粒细胞减少症、血小板减少症和贫血,发生率超90%。这些毒性主要与清淋化疗有关。on-target/off-tumor效应短暂且可控,通常需要很少或不需要干预。此外,接受过BCMA靶向治疗或在BCMA CAR-T细胞治疗后复发的患者对GPRCSD CAR-T细胞表现出令人印象深刻的反应,表明MM细胞上GPRCSD的表达独立于BCMA。然而,所有研究都报告了最初对GPRCSD CAR-T细胞有反应的患者出现复发。与BCMA类似,这些复发可能与染色体改变介导的GPRCSD双等位基因丢失有关。这些研究的样本量较小,因此GPRCSD复发的机制仍未明了,需要进一步验证。
为了提高CAR-T细胞疗法的长期临床效果并减少抗原逃逸,设计了一种抗BCMA/GPRCSD双特异性CAR-T细胞,并在RRMM患者中进行了测试。在一项纳入21名患者的I期临床试验中,这种双特异性CAR-T疗法显示出良好的安全性谱和强大的抗骨髓瘤活性。ORR为86%,其中62%的患者达到≥CR,81%达到MRD阴性。抗BCMA/GPRCSD双特异性CAR-T细胞疗法总体耐受性良好,最常见的≥3级不良事件是血液学毒性。CRS发生在71%的患者中,所有病例均为1级或2级。仅观察到一例1级ICANS,在或低于最大耐受剂量时未报告严重神经毒性或器官毒性。这些发现表明,抗BCMA/GPRCSD双特异性CAR-T细胞为RRMM患者(包括单抗原阴性表达的患者)提供了一种有希望的治疗选择,并可能克服抗原逃逸的挑战,同时保持可控的安全性。
CS1 (SLAMF7)
CS1也称为SLAMF7,在MM细胞上高表达,与BCMA相比,CS1在更大比例的MM患者中可检测到。FDA已批准抗CS1单抗elotuzumab(huLuc63),其与IMiDs和PIs联合用于治疗RRMM时显示出强大的疗效。因此,CS1已成为MM治疗中一个有前景的靶点,并且CS1 CAR-T细胞疗法已推进到I期临床试验(编号NCT03710421)。然而临床前研究表明,虽然单输入CS1 CAR-T细胞表现出肿瘤溶解效应,但其抗肿瘤活性不如BCMA CAR-T细胞强劲。由于CS1在NK细胞、CD8+ T细胞和其他淋巴细胞上的表达有限,临床前研究发现单输入CS1 CAR-T细胞会诱导正常淋巴细胞的选择性自相残杀。为了利用CS1的独特表达同时最小化off-tumor毒性,后续开发了双特异性CS1-BCMA CAR-T细胞,并在体外和体内进行了评估。临床前分析表明,这些新型单链双特异性CARs可以靶向CS1或BCMA,对单输入BCMA或CS1 CAR-T细胞耐药的MM发挥强大的抗肿瘤作用。最近,进行了一项单臂IIIA期临床试验,以评估双特异性CS1/BCMA CAR-T细胞在RRMM患者中的安全性和有效性(编号NCT04662099)。试验报告称,在16名可评估患者中,13名(81%)获得了临床反应,6名(38%)达到了sCR。值得注意的是,该研究中也观察到了严重感染(6/13, 38%)和淋巴细胞减少症(16/16, 100%),可能与选择性自相残杀有关。
CD38
CD38在MM细胞上广泛但非特异性表达,从而引发了在靶向CD38的CAR-T细胞治疗中可能产生on-target/off-tumor毒性的担忧。因此,CD38目前正在与BCMA一起在双特异性CAR-T细胞疗法中进行研究,并取得有希望的结果,双特异性CD38和BCMA CAR-T细胞在临床前研究中显示出强大的抗肿瘤效果。这种CAR疗法已推进到I期临床试验,以评估其安全性和有效性。Mei等人在一项涉及RRMM患者的I期临床研究(编号ChiCTR1800018143)中评估了BM38 CAR。中位随访9个月时,20名患者(87%)获得了临床反应且MRD阴性,其中12名患者(52%)达到sCR,四名患者(17%)达到VGPR。最常见的不良事件是CRS(20/23, 87%)和血液学毒性(22/23, 96%),在大多数情况下轻微且可控;未观察到神经毒性。在另一项单臂、单中心临床研究中,16名RRMM患者接受CD38和BCMA双特异性CAR-T细胞的输注;中位随访11.5个月期间,14名(87.5%)对治疗有反应,包括13名sCR和一名PR。尽管两项研究中的患者在CD38和BCMA双特异性CAR-T细胞治疗后复发,但大多数复发涉及BM中持续的CD38和BCMA阳性。这表明对BCMA的选择压力低于单独使用BCMA,并突出了改善CAR-T细胞持久性的重要性。
CD138
与CD38类似,CD138在MM细胞以及正常造血和非造血组织上高度表达。由于CD38和CD138在MM细胞上的独特共表达,已在几项临床前研究中开发了同时靶向这两种标志物的双重CAR-T细胞。 Globerson Levin等人将CD138和CD38识别域分别整合到CD28和CD8链中,允许在单个CAR内由两个不同的多肽链分别提供激活和共刺激信号。因此,CD138/CD38双靶向CAR-T细胞(dCAR138-38)仅在同时识别CD138和CD38时被激活,从而在临床前模型中产生显著的抗肿瘤效果,同时对正常细胞的毒性最小。尽管dCAR138-38引发了强大的细胞毒性,但这种CAR-T细胞疗法的肿瘤特异性仍然欠佳。另一种同时靶向CD138和CD38的CAR-T细胞是使用类似策略生成的,涉及不同的组合方法并结合具有不同亲和力的结合域。这种双重CAR-T细胞是使用低亲和力刺激性CD138 CAR(sCD138CAR)和高亲和力共刺激性CD38 CAR(cCD38CAR)开发的,以增强MM中的抗原特异性细胞毒性。研究结果显示,sCD138CAR/cCD38CAR-T细胞在MM细胞中表现出显著的细胞毒性,即使在达雷妥尤单抗经治的模型中也是如此。目前有几项靶向CD138单独或与其他靶点联合的CAR-T细胞临床试验(编号NCT03672318, NCT03196414, 和 NCT01886976),可能为未来使用CAR-T细胞靶向CD138提供有价值的临床见解。
FcRL5
FcRL5(CD307, IRTA2)是一种免疫球蛋白样细胞表面受体,特异性表达于B细胞谱系。与正常浆细胞相比,其在MM细胞中的表达上调,特别是在具有1q21染色体扩增的细胞中。因此,FcRL5是MM治疗中一个有前景的靶点; 靶向FcRL5的CAR-T细胞也得以开发并在临床前模型和临床试验中进行了评估。抗FcRL5 CAR-T细胞由抗FcRL5 scFv、CD8铰链区和CD28-CD3ζ胞内域组成,在临床前模型中表现出强大的效果,即使在BCMA缺陷的模型中也是如此。基于此结构,通过在胞内域加入IL-15分泌模块,开发了一种先进的抗FcRL5 CAR-T细胞产品;该产品在临床前研究中增强了T细胞持久性并改善了抗肿瘤疗效。此外,还开发了一种同时靶向FcRL5和BCMA的双特异性CAR-T细胞,与单特异性CAR-T细胞相比,显示出优越的抗肿瘤效果,并展示了未来CAR-T细胞开发的巨大潜力。另外,一项开放标签、单臂、II期临床试验(编号NCT06196255)正在进行中,以评估抗FcRL5 CAR-T疗法在RRMM患者中的安全性和有效性。
TACI
与BCMA类似,也TACI是TNF受体超家族的成员,在B细胞成熟和存活中起关键作用。TACI在B细胞谱系中表达,并在大多数MM细胞中检测到水平升高。TACI的天然配体是APRIL,它也作为BCMA的配体。因此产生了基于APRIL的CAR-T细胞,其中使用APRIL作为肿瘤靶向域,以同时识别BCMA和TACI。尽管使用单一APRIL结构域制造的基于APRIL的CAR-T细胞即使在肿瘤逃逸模型中也显示出强大的抗骨髓瘤效果,但在I期临床试验(编号NCT03287804, AUTO2)中观察到的临床反应微乎其微。为了增强APRIL与BCMA和TACI的结合,开发了具有三聚体APRIL结合域(称为TriPRIL)的CAR-T细胞,目前正在临床试验(编号NCT05020444)中进行评估。最近,使用不同方法开发了第二代靶向TACI的CAR-T细胞。与先前使用APRIL作为肿瘤靶向域的方法不同,这种新方法整合了源自TACI免疫小鼠的抗TACI scFv,以提高抗原结合特异性。此外,还开发了同时靶向BCMA和TACI的双特异性CAR-T细胞,以增加细胞毒性并防止抗原逃逸。
CD229
CD229是SLAM家族的成员,在MM细胞存活中起着至关重要的作用。尽管CD229在正常T和B淋巴细胞上普遍低水平表达,但它在MM细胞上高表达,使其成为MM CAR-T细胞治疗的一个有前景的靶点。已开发出靶向CD229的CAR-T细胞,并显示出消除MM细胞(包括传播疾病的细胞)的强大能力。然而,尽管在CD229低/阴性T细胞中没有自相残杀,但发现抗CD229 CAR-T细胞会靶向具有高CD229表达的正常T细胞,可导致on-target/ off-tumor毒性并损害T细胞持久性。为了解决对正常细胞的意外杀伤并增强CAR-T细胞的选择性,Vander Mause等人筛选了多个结合域,并开发了具有降低的CD229结合亲和力的FH9Q/c-Jun CAR-T细胞。这种低亲和力设计有效地减轻了on-target/ off-tumor毒性,同时通过c-Jun过表达维持T细胞持久性。这种修饰在CAR-T细胞的疗效和安全性之间实现了最佳平衡。
LLLRB4
LLLRB4是一种免疫检查点受体,仅在髓系细胞上表达,包括树突状细胞和巨噬细胞。LLRB4在血液系统恶性肿瘤中也高度表达,特别是急性髓系白血病(AML)和MM。在AML中,LLRB4主要在具有单核细胞分化的肿瘤细胞表面表达,抑制T细胞活化并促进白血病浸润和存活。靶向LLRB4在临床前AML模型中显示出有希望的效果,抗LLRB4 CAR-T细胞疗法通过逆转免疫抑制和直接消除AML细胞表现出抗肿瘤活性。与AML类似,最近的研究表明,LLRB4促进骨病变并促进MM中的细胞增殖,强调了其在疾病发展中的重要作用。除了肿瘤细胞,LLRB4也在MDSCs上检测到,并作为免疫检查点受体发挥免疫抑制作用。鉴于LLRB4对MM细胞和肿瘤微环境的双重作用,开发了一种新型的基于TCR的CAR-T细胞,STAR-T,以同时靶向MM细胞和MDSCs上的LLRB4。STAR-T的临床前研究证明了其在MM细胞系和异种移植MM模型中的强细胞毒活性和增强细胞因子分泌的能力,且没有显著的off-tumor效应。这些发现突出了LLRB4作为未来MM免疫疗法的一个有前景的靶点。
针对新抗原的CAR-T疗法的开发代表了MM治疗的一个关键前沿,可提高反应的持久性,为BCMA低表达患者扩大治疗选择,并降低复发率。未来的努力将集中于优化CAR设计、最小化脱肿瘤毒性以及探索与ICIs或其他药物的组合。随着更多临床数据的出现,新靶点CAR-T疗法有望成为个性化、有效和持久的MM治疗策略的组成部分。
BiTEs
BiTEs是一类新兴的免疫疗法,已被快速发展用于治疗多种血液系统恶性肿瘤。BiTEs是经过设计的蛋白质,旨在将T细胞的细胞毒性潜力重新导向癌细胞。这些分子由两个连接在一起的scFvs组成:一个结合域靶向恶性细胞上的肿瘤相关抗原,而另一个则结合CD3,T细胞受体复合物的关键组成部分。这种同时结合促进了免疫突触的形成,导致T细胞激活和对肿瘤细胞的直接细胞毒性,且不依赖于主要组织相容性复合物呈递。然而BiTEs通常半衰期短,需要持续输注以维持其治疗效果。BiTEs的疗效依赖于患者活化T细胞的质量和功能,其毒性谱与CAR-T细胞相似,包括CRS和ICANS。
目前正在开发用于治疗MM的大多数BiTEs靶向BCMA,BCMA已成为领先的治疗靶点;这些BiTEs在RRMM患者中提供了强大、持久的反应。最近,针对新靶点(包括GPRCSD和FcRL5)的BiTEs已被开发用于经过多线治疗的患者[表3]。这些创新正在扩大治疗格局,并为治疗选择有限的患者带来新的希望。
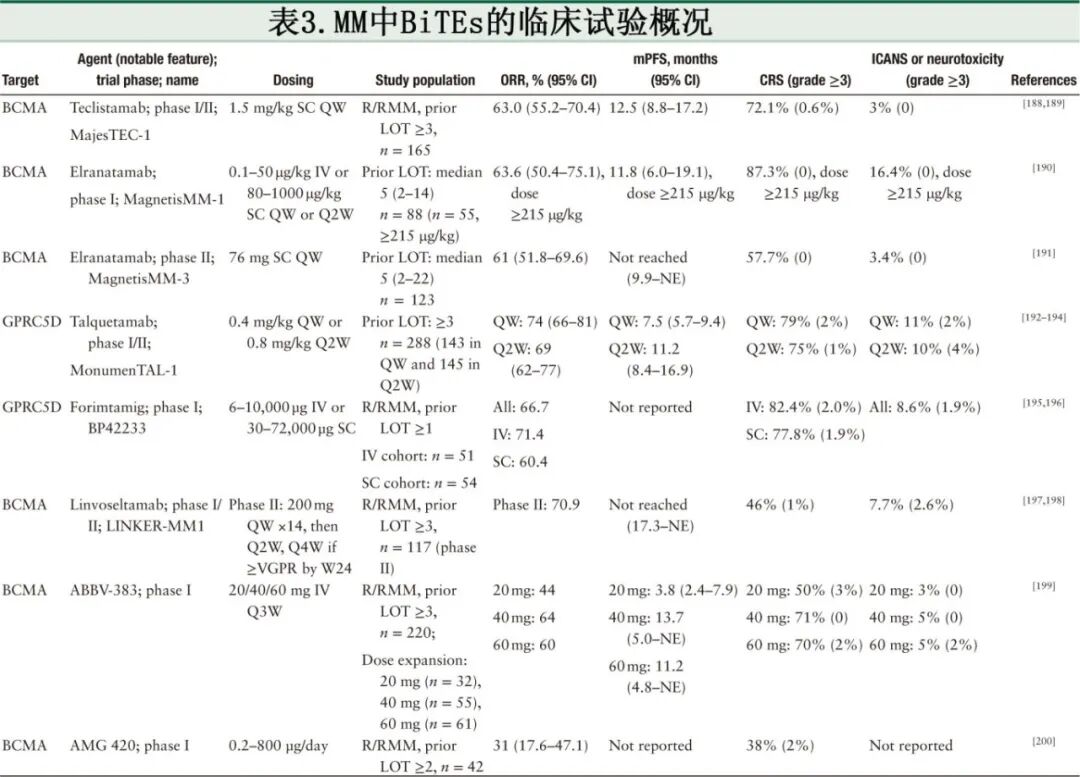
靶向BCMA的BiTEs
靶向BCMA的BiTEs 特立妥单抗和elranatamab已获得FDA批准,用于治疗接受过三线以上既往治疗的RRMM患者。它们的有效性和安全性已在多项临床试验中得到评估,这些试验在经过多线治疗的MM患者中产生了有希望的结果和良好的安全性。
MajesTEC-1研究是一项特立妥单抗的I/II期单药临床试验。在该试验中,接受过至少三线既往治疗的RRMM患者按照阶梯式递增给药方案每周皮下注射特立妥单抗(1.5 mg/kg)。在中位随访14.1个月期间,ORR为65%(95% CI 48–79%),39.4%的患者达到≥CR。中位PFS为11.3个月,表明持续、显著的临床获益。在一个队列中,ORR为52.5%(95% CI 36.1–68.5%),其中30%的患者(95% CI 16.6–46.5%)达到≥CR,表明该药物即使在先前接受过BCMA治疗后也具有潜在效用。Elranatamab在经过多线治疗的RRMM患者中表现出与特立妥单抗相似的临床疗效。在MagnetisMM-1临床试验的I期阶段,88名RRMM患者接受elranatamab单药治疗,这些患者接受过至少三线既往治疗,包括55名接受有效剂量(≥215 µg/kg)的患者。中位随访12个月后,ORR为63.6%(35/55;95% CI 50.4–75.1%),其中38.2%的患者达到CR或更好,表明在RRMM患者中反应强劲且持久。基于MagnetisMM-1研究I期的鼓舞人心的结果,三重暴露RRMM患者接受elrantatamab(76 mg)每周一次的皮下注射,遵循两次阶梯式递增起始剂量。结果显示ORR为61%(95% CI 51.8–69.6%),≥CR率为35%,展示了elrantatamab在这一具有挑战性的患者群体中的疗效。此外,在MajesTEC-1和MagnetisMM-1研究中,既往治疗线数较少或难治程度较低的患者比接受过多线既往治疗或疾病晚期的患者有更好的缓解率,表明当在更早线中特立妥单抗和elrantatamab均能带来改善的获益。
与抗BCMA BiTEs相关的最常见不良事件包括感染、血细胞减少和CRS。大多数患者表现出低级别CRS,以及≥3级感染和血细胞减少。抗BCMA BiTE治疗后CRS的减轻与阶梯式递增起始剂量密切相关,这在特立妥单抗和elrantatamab的试验中均得到证实。此外,在正在进行的II期MagnetisMM-3临床试验中,接受elrantatamab每周给药持续应答者,在六个周期后转为每两周给药,导致3/4级不良事件减少。因此,将特立妥单抗和elrantatamab转为每两周给药是改善长期安全性的潜在策略。
靶向GPRCSD的BiTEs
塔奎妥单抗是一种首创的双特异性抗体,靶向GPRCSD和CD3,在治疗RRMM方面显示出显著前景。在一项I期研究(Monument-TAL-1)中,塔奎妥单抗以两个推荐用于II期评估的剂量皮下给药:每周405 µg/kg和每两周800 µg/kg。ORR分别为70%(95% CI 51–85%)和64%(95% CI 48–78%),且反应随时间增强。中位缓解持续时间分别为10.2个月和7.8个月。常见不良事件包括CRS(77–80%,主要为1-2级)、皮肤相关事件(67–70%)和味觉障碍(57–63%)。严重不良事件不常见,因毒性停药罕见。这些发现确立了塔奎妥单抗作为经过多线治疗的R/R MM的新型治疗选择,具有显著的抗肿瘤活性和可接受的安全性。
Forimtamig是另一种靶向GPRCSD和CD3的双特异性抗体,采用2+1分子形式来优化结合亲和力和对MM的治疗效果。临床前模型已证明forimtamig能够诱导强大的T细胞活化,促进稳定的免疫突触形成,并实现强大的肿瘤细胞杀伤。早期临床数据表明在治疗RRMM方面具有显著疗效,即使在经过多线治疗的患者中也显示出显著的抗肿瘤活性。Forimtamig在正位小鼠模型中显示出快速的肿瘤清除,并且当与标准疗法(如抗CD38 mAbs、IMiDs和PIs)联合使用时,显示出增强的疗效。其安全性表明CRS可控,阶梯式递增给药策略有效减轻了严重不良事件。此外,forimtamig与新药(如BCMA靶向的双特异性TCEs和CELMoDs)的协同潜力降低了GPRCSD阴性肿瘤复发的可能性。目前正在I期临床试验(编号NCT04557150)中进行研究,forimtamig作为单药治疗和联合方案组成部分都具有前景,解决了MM中的关键耐药机制,同时为持久疾病控制提供了新途径。
靶向FcRL5的BiTEs
Cevostamab是首个在RRMM患者中显示出显著抗骨髓瘤活性的FcRL5靶向疗法。在一项正在进行的临床试验中,cevostamab显示出令人鼓舞的疗效,特别是在深度治疗的RRMM患者中。ORR约为50%,即使在先前对BCMA靶向疗法难治的患者中也观察到反应,突出了其作为替代治疗选择的潜力。
BiTEs已成为RRMM免疫疗法的一种变革性方法,通过将T细胞重定向以靶向恶性细胞,展示了强大的抗骨髓瘤活性。虽然BCMA仍然是验证最充分的靶点,且特立妥单抗和elrantatamab等BiTEs已获得FDA批准并在经过多线治疗的患者中产生高反应率和可管理的安全性,但诸如复发和耐药性等挑战仍需寻求替代抗原。针对GPRCSD、FcRL5或其他新靶点的新兴BiTE产品正在展现出令人鼓舞的疗效和耐受性,为治疗选择有限的患者提供了一条有希望的途径,并带来了抗原逃逸和治疗耐药性可以被克服的新希望。
结论
在过去的二十年里,MM免疫治疗领域取得了实质性进展,改变了这种复杂恶性肿瘤的治疗模式。免疫疗法的进步,包括IMiDs、mAbs以及诸如CAR-T细胞疗法和BiTEs等尖端疗法,已显著改善了患者的预后,特别是在RRMM患者中。然而MM仍然无法治愈,复发和治疗耐药性继续构成重大挑战,尤其是在经过多线治疗的患者中。
新治疗靶点的识别,如BCMA、GPRCSD和FcRL5,以及新模式的开发,如CELMoDs和ADCs,为克服这些挑战带来了希望。尽管这些疗法疗效显著,但诸如抗原逃逸、免疫相关毒性和有限反应持久性等问题凸显了对创新方法的需求。新兴策略,包括联合方案和下一代疗法,正在为更安全、更持久的治疗选择铺平道路。
参考文献
Wang Y, Wang Y, Ma J, Jing H, Liu L, Qiu L, Hao M. Identification and transformation of novel targets for immunotherapy in multiple myeloma. Chin Med J (Engl). 2025 Oct 31. doi: 10.1097/CM9.0000000000003869. Epub ahead of print. PMID: 41176333.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)