首页 > 医疗资讯/ 正文
导读
在我们身体里,几乎每个角落都上演着静默而激烈的“谍战大片”,免疫细胞需要精准识别:哪些是值得保护的“自己人”,哪些又是需要清除的“入侵者”或“叛变者”。在这场攻防博弈中,一个名为CD47(cluster of differentiation 47)的蛋白质,扮演着正常细胞“通行证”的关键角色。它广泛存在于多种细胞表面,能够向免疫系统发出“别吃我”的信号,从而避免被巨噬细胞等免疫细胞清除。然而,近年来科学家发现,这一原本用于保护正常细胞的防御机制,却被一些病变细胞(如癌细胞、炎症细胞)所“劫持”,用于逃避免疫监视与攻击,从而加速疾病进展与恶化。
近日,来自美国肯塔基大学Shuxia Wang教授及团队在eGastroenterology发表了题为“CD47: an immunoregulatory nexus in liver and gastrointestinal disorders”的综述文章,系统梳理了CD47在肝脏与胃肠道疾病中的多重角色,涵盖了脂肪肝、炎症性肠病、肝脏缺血再灌注损伤、药物性肝损伤,以及肝癌、结直肠癌和胰腺癌等消化系统恶性肿瘤。CD47不仅是免疫检查点,更是维持组织稳态和调控疾病进程的多面调控因子。

CD47是谁?
CD47,是一种广泛存在于细胞表面的跨膜糖蛋白。它通过与多种“合作伙伴”相互作用,参与调控包括自我识别(即“别吃我”信号)、免疫调节、细胞凋亡、细胞迁移与增殖等多种生命过程,其关键作用机制主要包括以下三个方面(见图1):
1. 与SIRPα结合:向免疫系统发出“别吃我”的信号,在肿瘤微环境中,高表达CD47的癌细胞常利用这一机制抑制巨噬细胞的吞噬清除,从而实现免疫逃逸。
2. 与TSP1结合:调控血管生成、细胞凋亡、炎症反应及细胞增殖等多种细胞功能。
3. 与整合素结合:影响细胞迁移、黏附与增殖。
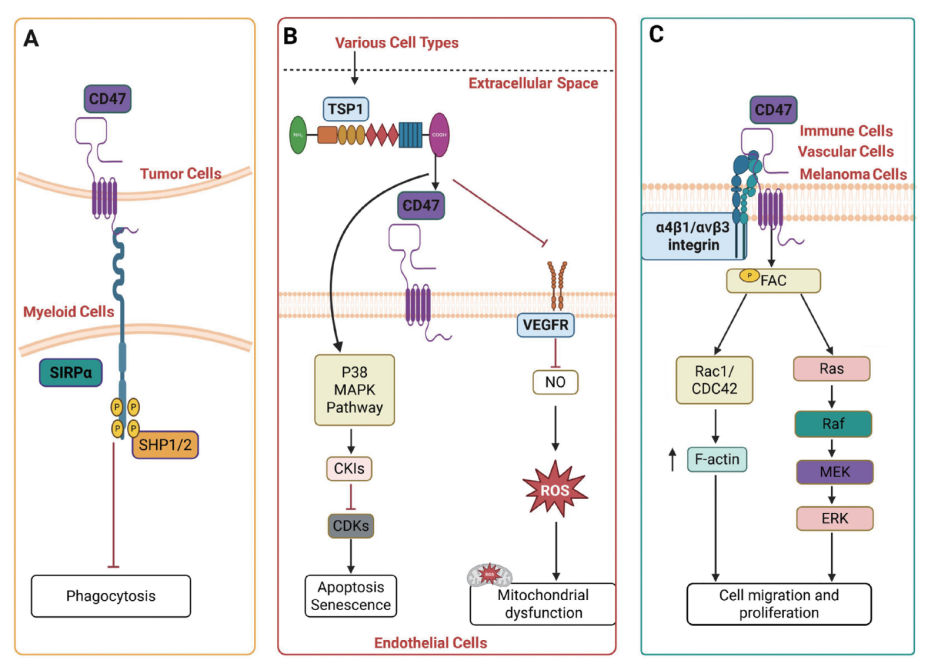
图1: CD47的作用机制
正是这种“多才多艺”,使得CD47不仅在生理状态下维持组织平衡,也在病理状态下成为疾病的“推手”。
CD47与代谢功能障碍相关脂肪性肝病:全程参与
非酒精性脂肪性肝病已逐渐被更新为代谢功能障碍相关脂肪性肝病(metabolic dysfunction-associated steatotic liver disease, MASLD),其炎症阶段称为代谢功能障碍相关脂肪性肝炎(metabolic dysfunction-associated steatohepatitis, MASH)。全球约30%成人受MASLD困扰,其中约20%会发展为MASH,进而可能演变为肝硬化,甚至肝癌。
1. CD47在脂肪变性中的作用
研究发现,CD47缺失小鼠能够抵抗高脂饮食诱导的肥胖、胰岛素抵抗及脂肪变性,其保护作用部分归因于棕色脂肪活性增强。然而,长期CD47缺失可导致严重的肝脂肪变性。
2. CD47促进炎症、纤维化与肝硬化
在MASH模型中,CD47表达上调,阻碍巨噬细胞清除坏死肝细胞,导致炎症持续。同时,CD47也激活肝星状细胞,导致过量细胞外基质沉积,推动肝纤维化进程和肝硬化发展(见图2 )。
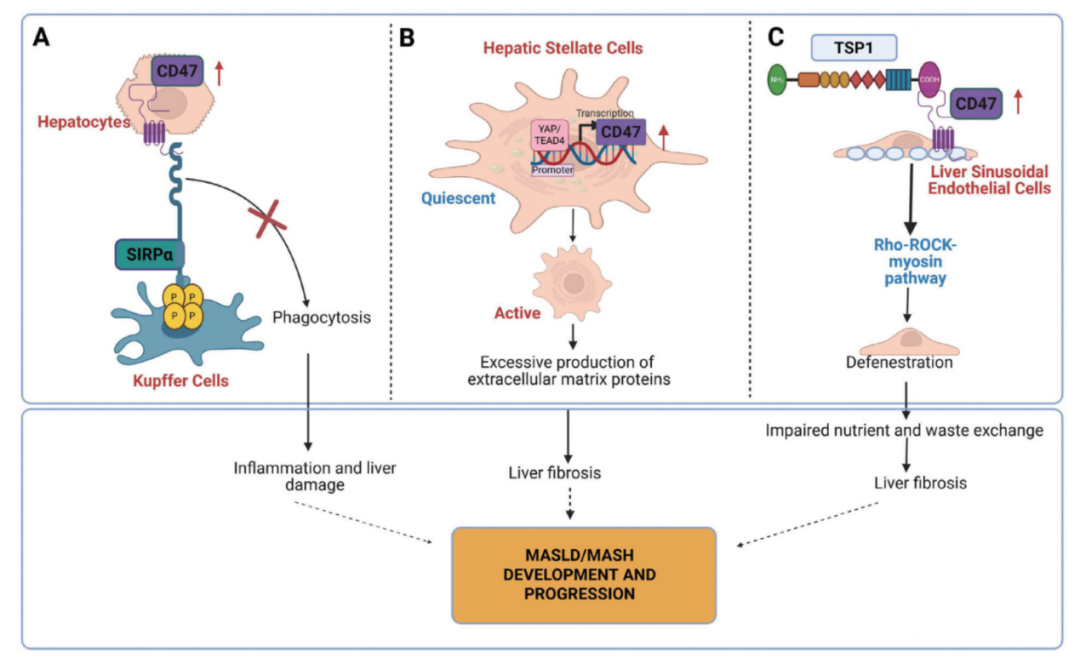
图2:CD47在MASLD及MASH中的作用机制
3. CD47与肝癌的免疫逃逸
研究发现,CD47通过与巨噬细胞表面SIRPα受体结合,介导免疫逃逸,抑制肿瘤细胞被吞噬,从而促进肝癌进展。在肝癌组织中,CD47表达显著升高,同时伴随SIRPα水平上调,两者均与患者的不良预后及高转移风险相关。这些发现凸显CD47作为MASLD及MASH相关肝癌潜在治疗靶点的重要价值。
CD47与炎症性肠病:双向作用
慢性肠道炎症,如克罗恩病和溃疡性结肠炎等炎症性肠病,是由于黏膜稳态破坏、上皮损伤、免疫应答失调及组织修复障碍等引起的。在炎症状态下,肠道上皮细胞中CD47表达显著上调,可抑制上皮细胞的自我更新与修复能力。CD47缺失或使用CD47-Fc融合蛋白阻断其信号,可促进黏膜愈合、减轻炎症。然而,在动物实验与类器官模型中亦发现,全身性CD47阻断也可能导致修复功能受损影响创面愈合。
CD47在结肠炎中的作用有情境依赖性,提示对其信号通路进行选择性调控可能为IBD治疗提供新机遇。
CD47与药物性肝损伤:隐身技术
药物性肝损伤的治疗需要兼顾组织修复与免疫逃逸。近年来,科学家开发出一种双重功能外泌体技术,表面修饰CD47以逃避免疫清除,内部携带促进肝细胞再生的Wnt2 mRNA。在动物实验中,这一治疗显著减轻了对乙酰氨基酚引起的肝损伤。这一策略标志着“智能药物递送”+“免疫逃逸”结合的创新治疗模式正式登场。
CD47与肝移植:好坏兼具
肝移植是治疗终末期肝病的有效手段,但缺血再灌注损伤是导致移植失败的主要原因之一,其可引发炎症、细胞死亡和氧化应激,最终导致移植肝永久性功能丧失。研究表明,使用抗CD47单抗可保护肝窦内皮细胞、减少氧化应激,并促进肝细胞再生,显著提高移植成功率。另一方面,在移植肝细胞中过度表达CD47又有助于移植细胞逃避免疫清除,提高存活率。
这些发现共同凸显了CD47的双重及情境依赖性角色——既可作为抑制靶点以保护移植物免受缺血再灌注损伤,又可作为免疫逃逸分子增强移植物的长期存活。
CD47与消化系统肿瘤:关联广泛
研究表明,CD47在结肠腺癌组织中过度表达,与肿瘤晚期分期、血管侵犯及不良预后相关。联合使用SHP2抑制剂与抗CD47抗体,可恢复巨噬细胞的吞噬作用并促进肿瘤清除。
胰腺癌预后差,5年生存率极低。研究表明,CD47的表达与胰腺癌预后相关。其在肿瘤干细胞中高表达,通过抑制抗原提呈细胞介导的吞噬作用促进免疫逃逸。抗CD47抗体与化疗药物或免疫检查点抑制剂联用,已在动物模型中显示出协同抗肿瘤效果。
CD47靶向疗法已进入临床试验阶段
作为肿瘤细胞过度表达的关键“别吃我”信号,CD47已成为癌症免疫治疗领域的重要靶点。在ClinicalTrials.gov上进行检索可见,全球已有超过92项CD47靶向疗法临床试验在册,其中12项专注于消化系统肿瘤。针对CD47的治疗策略持续发展,主要聚焦于通过单克隆抗体、双特异性抗体和融合蛋白等制剂阻断CD47-SIRPα相互作用,以提升治疗的有效性与安全性。尽管多项临床试验仍面临血液学毒性和总体生存获益有限的两大核心挑战,但新一代药物通过分子优化设计,正在逐步突破瓶颈。
总结与展望
在精准医疗时代,CD47已成为消化系统疾病治疗的关键靶点,然而其广泛表达带来的安全性挑战,要求我们必须发展更精准的策略。未来的核心方向将聚焦于三大领域:开发细胞特异性递送系统以实现精准定位;推进联合用药方案(如CD47与PD-L1双靶点联合治疗);建立生物标志物筛选体系,实现真正的个体化治疗。
从脂肪肝到肝癌,从肠炎到胰腺癌,CD47这把原本保护健康细胞的“免疫钥匙”被病变细胞利用而成为“疾病帮凶”。如今,科学家正致力于将其重新编程为“治疗利器”。
引证本文
Otuagomah J, Newcomb A, Gwag T, Wang S. CD47: an immunoregulatory nexus in liver and gastrointestinal disorders. eGastroenterology. 2025;3:e100242.
https://doi.org/10.1136/egastro-2025-100242
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)