首页 > 医疗资讯/ 正文
摘要
背景:越来越多的证据凸显了电针(EA)的抗炎和镇痛作用,但其潜在机制仍不甚明了。P2X7嘌呤能受体(P2X7R)位于外周和中枢神经系统,与慢性炎性疼痛的发生有关。抑制P2X7R表达与电针的镇痛作用相关。在背根神经节中,P2X7R仅在卫星神经胶质细胞(SGCs)中表达,但其在电针抗炎作用中的作用仍有待阐明。
方法:通过向大鼠足底注射完全弗氏佐剂(CFA)建立慢性炎性疼痛模型。采用蛋白质印迹法、免疫染色、行为学检测、药理学干预、腺相关病毒介导的基因敲低实验、卫星神经胶质细胞(SGCs)培养和实时细胞增殖分析等方法,研究针刺足三里(ST36)和昆仑(BL60)穴位减轻炎性疼痛作用的细胞机制。
结果:注射完全弗氏佐剂(CFA)的大鼠同侧后爪出现了持久的痛觉过敏,同时腰4 - 6背根神经节(L4 - 6 DRGs)中P2X7受体(P2X7R)和肿瘤坏死因子- α(TNF - α)的表达上调。卫星神经胶质细胞(SGCs)中P2X7R的药理学抑制或短发夹RNA(shRNA)介导的敲低可显著减轻炎症性痛觉过敏,减少P38丝裂原活化蛋白激酶(P38 MAPK)的磷酸化,并降低TNF - α水平。电针(EA)治疗显著缓解了CFA诱导的痛觉过敏,并抑制了P2X7R及其下游P38 MAPK/TNF - α信号通路的表达。P2X7R激动剂2'(3')- O -(4 - 苯甲酰苯甲酰)- ATP(BzATP)可逆转电针的镇痛作用。体外实验结果证实,在CFA模型中,SGCs分泌的TNF - α显著增加,但电针治疗可降低其分泌,模拟了P2X7R拮抗作用的效果。
结论:这些研究结果表明,卫星神经胶质细胞(SGCs)中P2X7受体(P2X7R)及其下游P38丝裂原活化蛋白激酶(P38 MAPK)/肿瘤坏死因子-α(TNF-α)信号通路的抑制作用有助于电针在慢性炎性疼痛中的镇痛效果。以SGCs中的外周P2X7R为靶点,可能为电针抗炎作用的细胞机制提供新的见解。
关键词:炎性疼痛、电针镇痛、卫星胶质细胞、P2X7嘌呤能受体、P38丝裂原活化蛋白激酶/肿瘤坏死因子-α信号通路
1 引言
慢性疼痛病症难以治愈,且仍然难以管控。它给社会带来了巨大的人文负担和经济成本。神经炎症是导致慢性炎性疼痛起始和持续的关键过程,被认为是慢性疼痛的根本原因之一。包括皮质类固醇和非甾体抗炎药(NSAIDs)在内的药物干预措施,构成了抗炎治疗策略的基石。然而,由于这些药物对心血管、胃肠道和肾脏系统有严重的不良反应,其使用受到限制,这凸显了寻找新的治疗靶点和方法的必要性。血脑屏障将中枢神经系统与身体其他部位分隔开来,但外周神经系统中的背根神经节(DRG)组织具有独特的血管分布和内皮细胞,可使药物渗透并蓄积在该组织中。将药物分布限制在DRG组织,绕过中枢神经系统,或针对仅在初级感觉神经元中表达或富集的疼痛机制,可能有助于最大限度地减少副作用。为解决慢性疼痛问题,未来针对外周神经系统中DRG的新型镇痛方法将变得越来越重要。
越来越多的研究表明,神经胶质细胞在慢性疼痛的潜在过程中起着至关重要的作用。环绕背根神经节(DRG)神经元的卫星神经胶质细胞(SGCs)在慢性疼痛的病理生理学和进展过程中也发挥着积极作用。越来越多的证据表明,在炎症和神经损伤的情况下,SGCs会被激活并发生一系列功能变化,例如与相邻SGCs或神经元之间的缝隙连接形成增强、对三磷酸腺苷(ATP)的敏感性增加、内向整流钾通道亚基(Kir4.1)功能降低以及细胞因子释放增加。SGCs表面含有P2X7嘌呤能受体(P2X7R)、P2Y12R、P2Y14R、N -甲基- D -天冬氨酸受体(NMDAR)、谷氨酸-天冬氨酸转运体(GLAST)等受体。与其他嘌呤能受体不同,P2X7R优先在DRG的SGCs中表达,参与疼痛信号传导,与炎性疼痛的发生和维持密切相关。
多项临床研究已证实,电针(EA)具有显著的抗炎和镇痛作用。近年来,研究人员越来越关注了解电针的作用机制。在机制研究中,炎性疼痛的治疗主要集中于外周调节。近期,马秋富教授及其同事指出,不同强度的电针刺激会影响外周交感神经神经肽Y阳性(NPY +)神经元,从而抑制炎症反应。刺激后肢足三里(ST36)穴位的电针可通过含蛋白偶联受体2(PROKR2)的标记感觉神经元激活迷走神经-肾上腺抗炎轴,从而对抗细胞因子风暴。尽管已有研究表明电针可通过抑制背根神经节(DRG)中P2X7受体(P2X7R)的表达发挥镇痛作用,但电针对激活的卫星神经胶质细胞(SGCs)中P2X7R调节作用的直接证据仍有待探索。肿瘤坏死因子-α(TNF-α)是外周神经系统中已知的疼痛介质,与炎性痛伤害性感受敏化有关。除此之外,背根神经节(DRG)中P38丝裂原活化蛋白激酶(P38 MAPK)的快速磷酸化是伤害感受器激活的标志,其激活有助于炎性痛的发生和维持。研究表明,下调P38 MAPK的磷酸化表达可减轻完全弗氏佐剂(CFA)诱导的炎性痛。虽然背根神经节中的P2X7受体(P2X7R)、P38 MAPK和TNF-α均参与炎性痛的起始、进展或维持,但其相互关系仍不清楚。据报道,卫星神经胶质细胞(SGCs)可通过产生肿瘤坏死因子-α(TNF-α)等细胞因子激活P38丝裂原活化蛋白激酶(MAPK),而活化的P38 MAPK可进一步促进TNF-α的释放。抑制P2X7受体(P2X7R)可降低P38 MAPK的磷酸化表达,进而降低TNF-α的表达,从而缓解神经性疼痛,在慢性术后疼痛模型中拮抗P2X7R的功能可抑制TNF-α水平升高,进而发挥镇痛作用。然而,电针(EA)是否通过降低P2X7R的表达,从而抑制SGC诱导的P38 MAPK/TNF-α信号通路来预防炎性疼痛仍不清楚。
在本研究中,将CFA注射至大鼠足底以建立经典的慢性炎性疼痛模型,并探究电针(EA)通过卫星胶质细胞(SGC)中P2X7受体(P2X7R)和P38丝裂原活化蛋白激酶(P38 MAPK)/肿瘤坏死因子-α(TNF-α)信号通路发挥潜在镇痛作用的机制。
2 材料与方法
动物
雄性Sprague–Dawley大鼠,体重180–220克,购自中国科学院上海实验动物中心 [SCXK(上海)2018–0006]。大鼠在浙江中医药大学动物研究中心[SYXK(浙江)2018–0012]标准环境条件下饲养(室温:24±2°C,湿度:60±5%,12/12小时光-暗周期),自由饮用和进食。所有动物实验均获得浙江中医药大学伦理委员会批准(IACUC 批准号:20190715–03),并遵循动物研究的相关伦理指南。动物实验样本量根据3R原则(替代、减少和优化)确定,并采用Dell等人描述的统计功效分析方法计算。这种方法既保证了科学的严谨性,又确保了所有实验的全面伦理合规。
炎症性疼痛大鼠模型的建立
经过一周的适应性喂养和基线行为测量后,按照先前描述的方法,采用足底注射CFA建立炎性疼痛模型。将100μL的CFA溶液(F5881,Sigma,美国)缓慢注射到左后爪的足底,按压注射部位约30秒以防止渗漏。对于对照大鼠,则注射等量的生理盐水(NS)。测量机械痛阈和热痛潜伏期以确认模型建立成功。
电针治疗
对于EA治疗,CFA + EA组的大鼠采用本实验室设计的定制棉质约束器进行固定(专利号:ZL 201420473579.9,中华人民共和国国家知识产权局)。将消毒后的一次性不锈钢针灸针(直径0.25毫米,长度13毫米,中国苏州苏州医疗器械厂生产)双侧刺入穴位,针刺深度为5毫米,穴位选取足三里(ST36,位于胫骨前结节外侧 5 毫米处)和昆仑(BL60,位于踝关节水平,外踝尖与跟腱之间)。将同侧的两根针连接到仿人体生物电多功能电刺激仪(FANGS - 100,中国杭州达利神医疗器械有限公司生产)同一输出端的两个电极上。
电针(EA)参数设置如下:疏密波(脉冲宽度:2 Hz时为0.4毫秒,100 Hz时为0.2毫秒,每3秒自动在2 Hz和100 Hz刺激之间交替);电流强度为0.5 - 1.0 - 1.5毫安(每种强度持续10分钟),总时长为30分钟。从CFA注射后第8天至第14天,每天进行30分钟的电针刺激,共进行7次治疗。假电针治疗组的大鼠在穴位处皮下进针(深度1毫米)但不给予电刺激;其他所有操作与电针组相同。
行为测量
Von Frey 测试
使用von Frey针(Stoelting Co.,Thermo,Gilroy,CA,USA)根据Chaplan等人描述的上下法评估机械性痛觉过敏。将大鼠放入透明笼子中,至少适应15分钟。使用4、6、8、15和26克的von Frey针缓慢轻柔地刺激左后爪中心至少5秒。根据大鼠对前一次刺激的反应,使用下一个增量硬度的针。在出现首次阳性反应后,记录四次刺激后的反应序列。若大鼠后爪回缩或退缩,则记录为阳性反应,标记为“X”。使用上下法计算引起50%回缩反应所需的力量。
Hargreaves 测试
使用 Hargreaves 测试(Ugo Basile 37,370,Italy)确定大鼠的爪子撤回潜伏期(PWLs)。大鼠在实验笼中适应3天,每天60分钟。在测试当天,每只大鼠在测试笼中适应60分钟后,用辐射热光束照射后爪中心进行刺激。从热刺激开始到后爪抬起的反应时间自动记录为PWL。对同一只后爪重复测试5次,每次试验间隔至少5分钟。为防止组织损伤,设定截止时间为20秒。取平均缩爪潜伏期作为最终的PWLs。
腰椎穿刺
如前所述,在 CFA 注射前7天植入腰椎导管。在大鼠麻醉(2–5% 异氟醚与氧气混合)下,将充满生理盐水的无菌 PE-10聚乙烯导管插入 L5/L6 椎间隙,另一端穿过颈部和背部。此外,导管尖端位于腰骶脊髓水平。最后,在手术部位肌肉注射青霉素(200,000 单位)以预防感染。排除术后后肢瘫痪或麻痹的动物。通过导管注入 2% 利多卡因溶液以确认脊髓内位置,通过立即出现的双侧后肢瘫痪(15 秒内)并持续 20–30 分钟来验证导管放置正确。A740003(Tocris Bioscience,英国)是一种选择性 P2X7R 拮抗剂,溶解于DMSO并稀释至250nM/L生理盐水。BzATP(Sigma-Aldrich,美国)是一种选择性P2X7R激动剂,溶解于蒸馏水并稀释至280nM/L生理盐水。SB203580(MedChemExpress,中国)是一种选择性p38MAPK抑制剂,溶解于 DMSO 并稀释至1μg/μl生理盐水。所有药物均在CFA注射后第12天至第14天通过腰椎导管给药。每次10μL药物注射后,再注入25μL生理盐水。
背根神经节内注射
在CFA或NS注射前约3至4周,将shRNA注射到大鼠同侧L4背根神经节中。根据 Gregory Fischer等人描述的方法,对背根神经节内注射协议进行了修改。大鼠用戊巴比妥钠(40mg/kg,腹腔注射)麻醉。将大鼠置于俯卧位,脊柱固定在立体定位仪中。在左侧暴露 L4和L5椎骨后,切除多裂肌和最长肌。去除关节突和部分腰椎横突,暴露L4背根神经节。使用玻璃微电极在微注射泵(World Precision Instruments,Sarasota,USA)操作下,以20nL/s的速度注入shRNA(每 DRG 3μL)。rAAV2/5-GFaABC1D-cre-mcherryWPRE-hGH和rAAV2/9-CMV-DIO-(mCherry-U6)-shRNA(scramble)-WPRE-Hgh(简称 scr-shRNA)注入Con或CFA组大鼠的同侧L4背根神经节。rAAV2/5-GFaABC1D-cre-mcherryWPRE-hGH和rAAV2/9-CMV-DIO-(mCherry-U6)-shRNA(P2X7R)-WPRE-hGH(简称 P2X7R-shRNA)注入CFA组大鼠的同侧 L4背根神经节。手术后立即肌肉注射青霉素(200,000单位)。
背根神经节神经元分离和细胞培养
在第14天处死大鼠,从对照(Con)组和其他组中分别取出双侧或同侧L4-6背根神经节,然后移植到含有10mM HEPES的Hank's平衡盐溶液(HBSS,H2387,Sigma Aldrich,St.Louis,MO,美国)中。收集L4-6背根神经节并用1mg/mL胶原酶I型和2mg/mL胰蛋白酶(Gibco,Thermo Fisher Scientific,美国)在37°C下消化40分钟,随后在37°C下用0.25%胰蛋白酶(T4549,Sigma Aldrich,St.Louis,MO,美国)处理12分钟。使用火抛光的玻璃巴斯德移液管分离细胞。将分离的细胞接种在涂有 Matrigel的培养皿(354,234,Corning,NY,美国)上,置于37℃、含5%二氧化碳的湿润环境中培养。
卫星胶质细胞富集培养
在体外培养4天后,当SGCs丰富时,向培养基中加入1mL 0.25%胰蛋白酶,分离 SGCs 3分钟后丢弃。加入1mL新鲜培养基(DMEM/F12含10%胎牛血清、100单位/mL青霉素和100μg/mL链霉素),轻轻从培养皿上移除细胞,使用火抛光的巴斯德移液管。收集1mL细胞悬浮液后,在室温下以1000rpm离心5分钟以沉淀细胞。将250μL细胞悬浮液接种在新的未涂覆24 孔板上。未处理的培养皿可防止神经元附着,但对胶质细胞的附着或生长无影响。此外,在细胞接种后2小时更换培养基以去除悬浮细胞(主要是神经元)。SGCs富集培养在37°C下的5% CO₂湿润环境中孵育3天,每两天更换一次培养基。用于免疫细胞化学测定的SGCs接种在未涂覆的载玻片上,并在体外处理3天以允许SGCs附着。
实时细胞增殖分析(RTCA)
使用xCELLigence系统(DP 系统,ACEA Biosciences,San Diego,CA,USA)和E板(Roche)通过实时细胞计数评估细胞增殖,该系统通过测量集成在组织培养板底部的叉指状金微电极间的电阻抗来实时监测细胞活动。电阻抗测量可提供有关细胞数量的定量信息。从Con、CFA 和CFA +EA 组中培养并富集SGCs。CFA组的每个SGCs 培养孔中加入100μL含有A740003的培养基溶液,最终浓度为1μM。对细胞活动进行24小时监测。在实验结束前30分钟,向CFA + EA组的每个SGCs孔加入100 μL含终浓度为100 μM的BzATP的培养基溶液。 随后记录30分钟的细胞活动情况。
酶联免疫吸附测定(ELISA)
在50mM Tris-base(pH 7.4)和150mM NaCl 中加入蛋白酶抑制剂(#04693132001,Roche,Switzerland和0.2% Triton-X,将L4-6背根神经节收集并以全速匀浆。将匀浆液在4°C下以10,000rpm离心15分钟。将细胞悬浮液在4°C下以10,000rpm离心 15 分钟,立即收集上清液进行检测。使用ELISA试剂盒(R&D Systems,USA)根据制造商的说明检测上清液中的TNF-α水平。使用微孔板读取器在450、540和570nm处分析平板。总蛋白通过BCA测定法(Thermo Fisher Scientific)确定。
免疫荧光
对于背根神经节的免疫荧光,将背根神经节固定在4%甲醛中,并在蔗糖梯度中脱水3天。脱水后,使用冷冻切片机(CryoStar,NX50,Thermo Fisher,USA)将样本切成12μm的切片。将切片安装在明胶涂覆的载玻片上。将切片在37°C下用5%驴血清在 TBST(含 0.3% Triton X-100,封闭缓冲液)中封闭1小时。对于免疫细胞化学,用4% 甲醛溶液洗涤后,用0.3% Triton X-100 溶液在室温下通透细胞30分钟,然后用 3% BSA溶液在PBS溶液中封闭1小时。然后在4°C下用以下一抗孵育过夜:P2X7R抗体(1:400,兔多克隆,GTX)、GFAP抗体(DRG 用 1:400,细胞用 1:200,小鼠单克隆,Abcam)、NeuN抗体(1:400,小鼠单克隆,Abcam)、Iba1抗体(1:400,小鼠单克隆,Abcam)。二抗包括驴抗兔IgG H&L(Alexa Fluor® 488)、驴抗小鼠 IgG H&L(Alexa Fluor® 594)和驴抗小鼠IgG H&L(Alexa Fluor® 488)(Abcam),在 37°C下与切片孵育1小时,然后加入适量的含DAPI的抗荧光猝灭剂。用蔡司 Apotome 3显微镜(Zeiss,Germany)检查染色和安装的切片。使用ZEN软件(Zeiss)捕获图像。
蛋白质免疫印迹法
用戊巴比妥钠(40mg/kg,腹腔注射)深度麻醉大鼠。取出同侧L4-6背根神经节,称重,并在含有蛋白酶和磷酸酶抑制剂的RIPA缓冲液中匀浆。将匀浆液在4°C下以 14,000rpm离心10分钟。使用双缩脲法(BCA 法)确定蛋白含量,保持恒定的蛋白上样量(20μg),按照说明书(Thermo Fisher Scientific,USA)操作。样品经SDS-PAGE 分离后,转移到PVDF膜上,然后在室温下用 5% 脱脂奶粉在含 0.1% Tween-20(pH 7.5)的TBS中封闭 1 小时后,用一抗在 4°C 下孵育过夜。洗涤后,用 HRP 结合的二抗(1:5000)在 37°C 下孵育 1 小时。使用增强化学发光检测试剂进行染色,然后使用FluorChem Protein Simple(AlphaImager ProteinSimple,San Jose,CA,USA)曝光,并使用ImageJ软件进行分析,以GAPDH作为加载对照。使用的一抗如下:兔抗 P2X7R(1:1000,Alomone)、兔抗 P38MAPK(1:1000,CST)、兔抗 pP38MAPK(1:1000,CST)、GAPDH(1:1000,CST)。
统计分析
所有数据以均值±标准差表示,并使用GraphPad Prism 8.0(GraphPad Software Inc.,San Diego,CA,USA)进行分析。使用Shapiro–Wilk测试验证数据正态性。通过Student t检验(双尾)进行两组之间的比较。三组或三组以上的比较采用单因素或多因素方差分析(ANOVA),随后进行Tukey事后检验。必要时进行重复测量方差分析。比较组间差异有统计学意义的判定标准为P<0.05。
3 结果
足底注射 CFA 诱发痛觉过敏和上调P2X7R、P38MAPK 磷酸化和TNF-α表达
根据先前报道的方案,成功建立了炎性疼痛大鼠模型,并对伤害性相关行为进行了系统测量。注射后第7天, CFA组大鼠同侧爪出现明显的炎症体征(红、肿、热、痛)。可见爪肿胀、周长增加、皮肤紧绷有光泽,且触敏性增强。对照组未出现此类变化(图1B)。与对照组(Con)大鼠相比,CFA处理组大鼠从注射后第1天(D1,即CFA注射后24小时)开始出现明显的机械性异常性疼痛,表现为50% 爪子撤回阈值(PWTs)显著降低,并持续至观察期结束(第14天,D14)(图1C)。同样,热痛觉过敏表现为50% 爪子撤回阈值(PWLs)缩短,从D1(CFA注射后24小时)开始出现,并持续至D14(图1D)。曲线下面积(AUC)分析进一步证实了机械性异常性疼痛和热痛觉过敏的累积(图1C和D),验证了大鼠炎性疼痛模型诱导成功。
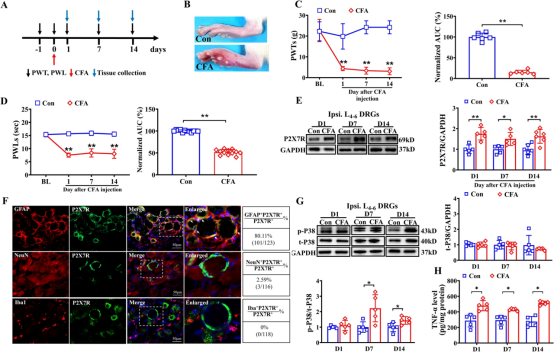
图1
先前的研究表明,DRG 中的 P2X7R 表达在周围炎症反应中被激活。采用蛋白质免疫印迹分析来评估在注射CFA后第1天(注射后24小时)、第7天和第14天,同侧L4 - 6背根神经节中P2X7R表达的变化。结果显示,与对照组大鼠相比,在所有时间点,经CFA处理的大鼠同侧L4 - 6背根神经节中的P2X7R蛋白表达均显著增加(图1E)。 这些发现表明,CFA诱导的炎性疼痛会显著增加L4 - 6背根神经节中P2X7R的表达,且表达升高水平在注射后至少持续14天。免疫荧光染色显示 P2X7R 与 SGCs 共表达(通过 GFAP 标记),但不与神经元(通过 NeuN 标记)或巨噬细胞(通过 Iba1 标记)共表达(图 1F)。我们进一步发现,在慢性炎症疼痛期间,磷酸化 P38MAPK(p-P38MAPK)和 TNF-α 的表达在背根神经节中显著增加,并持续到 CFA 注射后第 14 天,而总 P38MAPK 水平保持不变。
P2X7R的拮抗作用减轻了 CFA 大鼠背根神经节中的炎症疼痛、SGCs 的激活、P38MAPK 磷酸化和TNF-α 水平
为了研究 P2X7R 在 CFA 诱导的疼痛过敏中的作用,我们在预定时间点通过腰椎导管给予选择性拮抗剂 A740003 或溶媒(图 2A)。虽然 A740003 对未处理大鼠的基线疼痛阈值没有影响(补充图 1A 和 B),但它显著减轻了 CFA 大鼠的同侧机械性痛觉过敏和热痛觉过敏(图 2C 和 D)。免疫荧光结果表明,与 Con +Veh 组相比,CFA +Veh 组在同侧背根神经节中显示出显著增加的 P2X7R 阳性细胞数量和增强的 SGC 活性。A740003 的腰椎注射显著抑制了 CFA 诱导的同侧背根神经节中 P2X7R 和 SGC 的过度表达(图 2B)。此外,我们观察到 A740003 注射显著减少了背根神经节中 P38MAPK 的磷酸化增加(图 2E)。ELISA 结果表明,与 Con +Veh 组相比,CFA +Veh 大鼠的 L4-6 背根神经节中 TNF-α 水平显著更高。A740003 的腰椎注射显著降低了 CFA 大鼠的 TNF-α 水平(图 2F)。这些发现表明,P2X7R激活触发SGC激活,增加P38 MAPK磷酸化和TNF - α产生,所有这些都促成了慢性炎性疼痛。
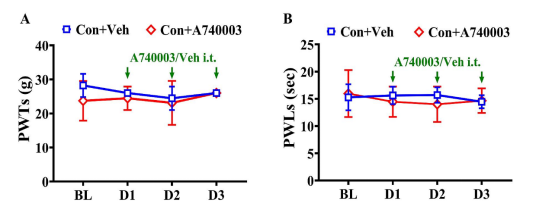
补充图 1A 和 B
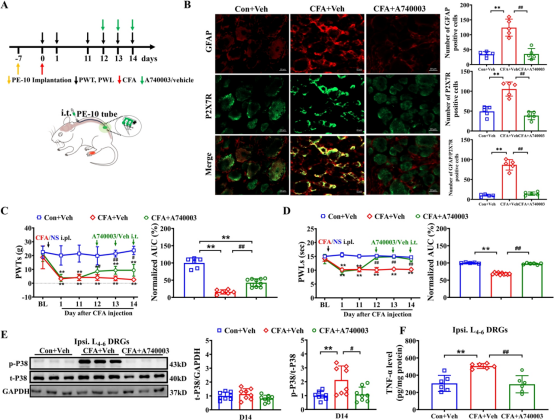
图2
在 CFA 大鼠的 L4 背根神经节中敲低 SGCs的P2X7R可通过抑制 P38MAPK/TNF-α通路减轻CFA诱导的炎症性疼痛
由于通过腰椎导管给予A740003可能非选择性地调节 DRGs 和中枢神经系统中表达P2X7R的细胞,我们采用靶向遗传方法,专门研究SGCs中P2X7R在炎症性疼痛发病机制中的作用。我们将表达P2X7R基因的重组腺相关病毒(rAAV)通过SGC特异性启动子GFaABC1D注入DRGs,以实现SGCs中P2X7R的选择性敲低(图 3A)。通过 DRG内注射确保病毒感染局限于DRG区域,不影响脊髓背角或其他更高级脑区。如图3B所示,DRG内注射病毒3周后,rAAV2/5-GFaABC1D-mcherry 在GFAP标记的SGCs中清晰表达,证实了病毒感染的特异性。蛋白质印迹分析显示,与 CFA +scr-shRNA 组和 CFA +P2X7R-shRNA 组的 L5 背根神经节相比,CFA +P2X7R-shRNA 组的 L4背根神经节中 P2X7R 蛋白水平显著降低。
行为学分析显示,在 CFA 注射后所有观察时间点,CFA +P2X7R-shRNA 大鼠的 PWTs和PWLs均显著高于CFA +scr-shRNA大鼠。AUC分析进一步表明,与CFA +scr-shRNA组相比,CFA +P2X7R-shRNA组大鼠的机械性痛觉过敏和热痛觉过敏累积减轻。蛋白质印迹分析显示,与CFA +scr-shRNA组相比,CFA +P2X7R-shRNA组大鼠同侧L4背根神经节中p-P38MAPK水平显著降低,但总P38MAPK水平未发生变化。然而,与CFA +scr-shRNA组相比,CFA +P2X7R-shRNA组大鼠的L5背根神经节中磷酸化和总P38MAPK水平均未发生变化(图 3F)。ELISA 结果进一步显示,与 CFA +scr-shRNA 组或L5背根神经节相比,CFA +P2X7R-shRNA组大鼠的TNF-α水平显著降低(图 3G)。这些结果表明,敲低SGCs的P2X7R可通过 P38MAPK/TNF-α 通路减轻CFA诱导的炎症性疼痛。
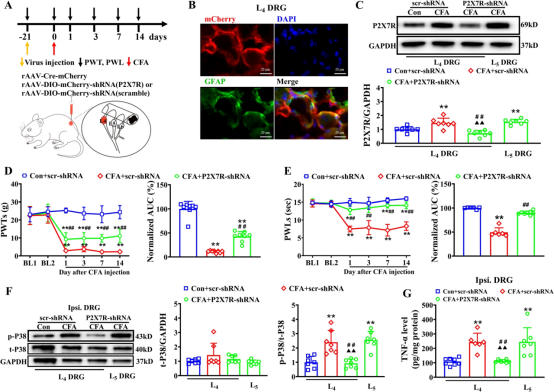
图3
抑制p38激活可减轻CFA大鼠背根神经节中的炎症性疼痛和TNF-α水平
为了确定p38MAPK是否参与CFA大鼠的机械性痛觉过敏和热痛觉过敏及其与P2X7R的关系,我们采用与前面相同的方法,通过腰椎导管给予p38抑制剂SB203580或其溶媒(图 4A)。与溶媒组相比,SB203580的腰椎注射显著减轻了CFA大鼠的同侧机械性痛觉过敏和热痛觉过敏(图 4B 和 C)。然而,P2X7R的过度表达并未被逆转(图 4E)。这些结果表明,CFA诱导的DRG中P2X7R表达与p38磷酸化无关,而CFA诱导的DRG中TNF-α上调可通过抑制p38激活被抑制,表明p38MAPK是P2X7R在介导CFA诱导的炎症性疼痛中的下游介质。
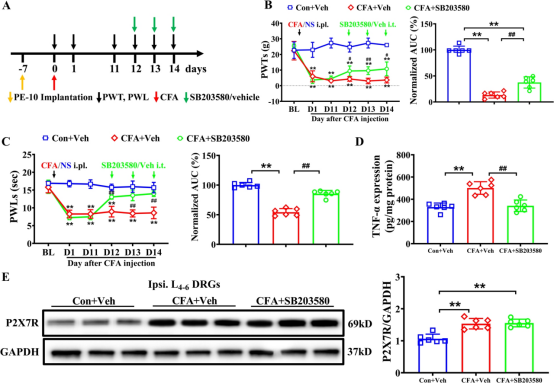
图4
电针通过抑制P2X7R和P38MAPK/TNF-α通路减轻CFA诱导的炎症性疼痛
为了观察电针(EA)对CFA诱导的炎症性疼痛的影响,我们从CFA注射后的第 8 天到第 14 天,对大鼠后肢的双侧ST36和BL60穴位进行2/100Hz的EA刺激(图 5A)。通过开放场测试评估,7次电针治疗方案对运动功能无显著影响(补充图2)。在基线时,各组之间未观察到PWTs和PWLs的显著差异。与对照组大鼠相比,CFA大鼠在CFA注射后第1天到第14天的同侧PWTs和PWLs显著降低。在EA干预期间,CFA +EA 组的同侧PWTs和PWLs高于CFA和CFA +sham EA组。AUC分析进一步证实EA对机械性痛觉过敏和热痛觉过敏的累积减轻作用。作为一种非药物干预,EA 在CFA大鼠中表现出时间限制的镇痛效果(补充图 3),与临床观察到的其短暂治疗持续时间一致。为了研究 EA 的镇痛效果是否与抑制 P2X7 介导的 P38MAPK/TNF-α 通路有关,我们研究了EA对P2X7R过度表达和P38MAPK/TNF-α通路激活的影响。此外,我们还研究了使用选择性激动剂激活P2X7R对EA镇痛效果的影响。重复的 EA刺激在CFA大鼠的L4–6背根神经节中显著减少了P2X7R的过度表达,而假EA无此效果(图 5D)。免疫荧光进一步分析显示,与CFA组和CFA +sham EA组相比,EA 治疗显著减少了同侧背根神经节中P2X7R阳性细胞的数量,伴随着SGC激活减少和 P2X7R/SGC共定位减少(图 5E),表明EA治疗后SGC激活减弱。如图5F所示,所有组之间的L4-6背根神经节中总P38MAPK蛋白表达无明显差异。然而,与对照组大鼠相比,CFA大鼠的p-P38MAPK蛋白表达显著增加(通过磷酸化与总蛋白的比值测量)。相比之下,EA治疗组大鼠的L4–6背根神经节中p-P38MAPK蛋白表达显著下调。ELISA结果显示,EA显著抑制了CFA模型诱导的TNF-α水平增加(图 5G)。为了进一步确定EA对CFA大鼠的镇痛效果是否通过外周P2X7R介导,我们研究了选择性P2X7R激动剂BzATP对EA效果的影响。从CFA注射后的第12天到第14天,每天在EA刺激前通过腰椎导管给予BzATP(280nM/L,10μL)一次(图 6A)。BzATP 显著抵消了EA对CFA诱导的机械性痛觉过敏和热痛觉过敏的镇痛效果(图 6B 和 C)。这种拮抗作用也在未处理大鼠中观察到(补充图 4A 和 B)。此外,它还逆转了EA诱导的TNF-α水平降低和p38MAPK磷酸化减少。
补充图2
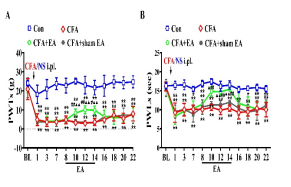
补充图3
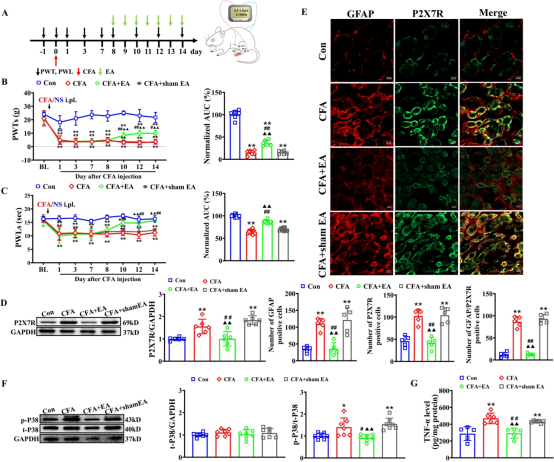
图5
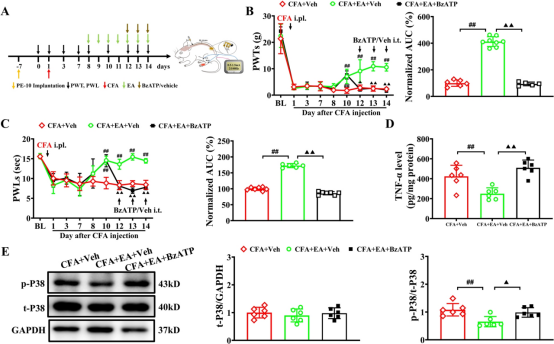
图6
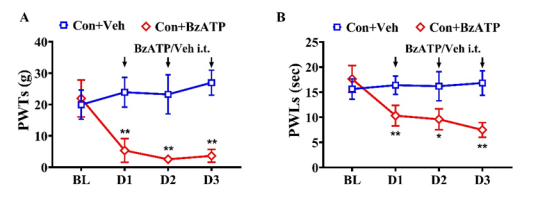
图4A,B
EA 通过调节P2X7R减少CFA大鼠SGCs中的TNF-α分泌
为了进一步确定EA对CFA大鼠SGCs中TNF-α分泌的影响以及研究SGCs中P2X7R在这一过程中的作用,我们首先从各组大鼠的L4-6背根神经节中培养SGCs,然后进行药理干预。收集各组细胞的上清液,并测量TNF-α浓度,以评估各组SGCs分泌的TNF-α产量变化。使用细胞免疫荧光鉴定细胞特异性,用GFAP(SGCs 的激活特异性标记物)对培养细胞进行染色和标记。结果证实成功富集了培养的SGCs(图 7A)。RTCA结果显示,在体外培养的SGCs中,其生长活性正常,且未受P2X7R特异性拮抗剂A740003(最终浓度 1μM)或激动剂BzATP(最终浓度 100μM)添加的影响(图 7B 和 S5)。如图 7C 所示,与Con +Med组相比,CFA +Med组的SGCs释放的TNF-α水平显著更高。P2X7R拮抗剂A740003显著降低了SGC上清液中的TNF-α水平,与CFA +Med组相比。此外,与CFA +Med组相比CFA +EA +Med组的TNF-α水平显著降低。当在培养基中加入BzATP溶液以激活SGCs中的P2X7R时,上清液中的TNF-α水平显著增加。这些结果表明,EA通过调节P2X7R减少了CFA大鼠SGCs中的TNF-α分泌。
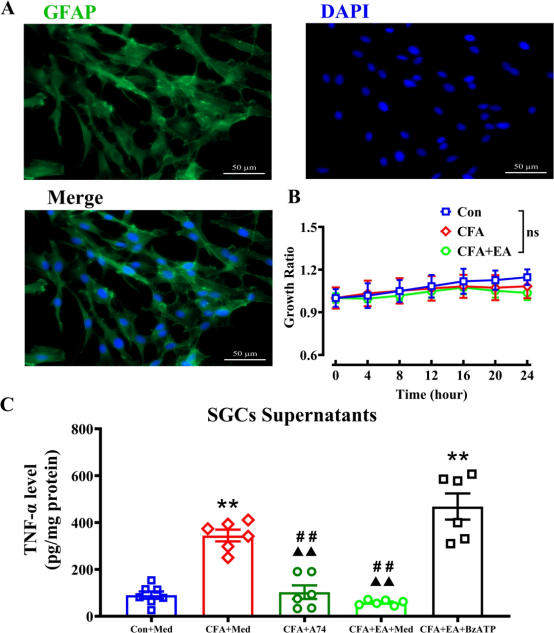
图7
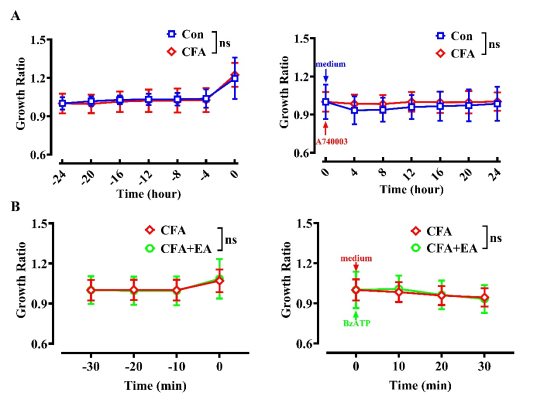
补充图5
4 讨论
本研究探讨了SGCs中P2X7R及其下游通路在慢性炎症性疼痛中的作用,以及EA通过调节P2X7R介导的信号通路发挥镇痛效果的细胞机制。我们的研究结果表明,SGCs中P2X7R的激活导致P38MAPK磷酸化增加,以及SGCs中TNF-α分泌增加,从而促进由CFA诱导的慢性炎症性疼痛。此外,EA通过抑制P2X7R介导的P38MAPK/TNF-α通路发挥抗炎和镇痛效果。在这里,我们为EA的镇痛机制提供了新的实验依据。
作为外周和中枢神经系统之间的重要通信中心,背根神经节(DRG)神经元感知来自身体不同部位的各种感觉,如机械、热、化学和有害刺激,并将感觉信息传递到大脑皮层进行进一步处理。DRG神经元之间不通过突触接触相互作用,而是被一层SGCs 包围,形成一个物理隔离的单元。这种神经元胞体和SGCs之间的结构排列表明,它们之间的通信是躯体活动的关键决定因素。P2X7R广泛分布于中枢和外周神经系统以及免疫系统,在各种疼痛过程中发挥重要作用。在本研究中,免疫荧光标记证实P2X7R仅位于CFA大鼠背根神经节中围绕神经元的SGCs内,与先前报道一致。此外,我们观察到CFA大鼠的L4-6背根神经节中P2X7R表达显著上调,与早期发现一致。使用特定拮抗剂A740003药理抑制P2X7R显著减少了CFA处理动物的疼痛过敏。同样,通过DRG内注射AAV载体shRNA靶向敲低P2X7R表达显著减轻了机械性痛觉异常和热痛觉过敏。这些发现强调了SGCs中P2X7R在介导与慢性炎症性疼痛相关的疼痛过敏中的关键作用。针灸(包括电针)被广泛认为是一种补充和替代疗法,用于缓解疼痛。
然而,SGCs中P2X7R在EA对炎症性疼痛模型的镇痛效果中的作用尚不清楚。我们的研究结果表明,EA可能通过多种潜在途径调节SGCs中的P2X7R 表达:首先,EA 在激活特定感觉纤维类型方面具有众所周知的能力,可能不同地影响SGC网络。低频 EA(2Hz)优先激活Aδ纤维和低阈值机械感受器(LTMRs),它们与SGC形成功能性缝隙连接。这可能通过嘌呤能信号(ATP 释放)和随后的胶质网络调节触发活动依赖性P2X7Rs下调。其次,我们观察到的p38磷酸化减少(图 2E)表明EA可能中断P2X7R介导的神经 - 胶质反馈环,其中:(1)伤害感受器激活释放 ATP →(2)激活 SGCs 上的 P2X7Rs →(3)促进 TNF-α 释放 →(4)进一步敏化神经元。EA 效果的短暂性(补充图 3)支持这种信号介导的机制,而不是永久性受体改变。然而,LTMRs 与伤害感受器在其中是否发挥主导作用需要进一步研究,使用选择性纤维消融模型。重要的是,我们的rAAV介导的SGC特异性敲低(图 3)证实,仅调节SGCs中的P2X7R就足以产生显著的镇痛效果,尽管中枢机制可能协同发挥作用。本研究推进了我们对EA通过靶向P2X7R介导的信号通路缓解炎症性疼痛的机制的理解。
为了进一步阐明P2X7R激活在慢性炎症性疼痛模型中SGCs内的作用,我们关注了SGCs的作用和功能。这些细胞已知产生多种生物活性物质,包括ATP、谷氨酸和细胞因子,如肿瘤坏死因子、白细胞介素 - 1β 和分形趋化因子等细胞因子。其中,TNF-α 是一种已确立的促炎细胞因子,作为疼痛介质发挥作用,在外周和中枢敏化的发展中起着关键作用。然而,尚不清楚CFA大鼠SGCs中P2X7R的激活是否可以调节TNF-α 产生以及EA如何影响这一过程。为了深入了解SGCs释放的TNF-α水平的变化,我们从Con、CFA和CFA +EA组大鼠的L4-6背根神经节中培养 SGCs。我们的结果表明,CFA大鼠的SGCs释放的TNF-α水平显著更高,通过阻断P2X7R功能可以减轻这种增加。值得注意的是,与CFA +Med组相比,CFA +EA组的SGCs产生的 TNF-α 水平显著降低。此外,当SGCs与BzATP共培养时,与CFA +EA组相比,显示出显著更高的TNF-α水平。这些结果表明,P2X7R的激活通过促进SGCs中TNF-α的释放,有助于CFA诱导的慢性炎症性疼痛中的痛觉过敏。重要的是,这些效应可以通过EA有效减轻,突显了其调节炎症反应的潜力。
众所周知,MAPK通路(尤其是P38MAPK)的激活改变了神经可塑性,并有助于疼痛过敏。在脊髓和背根神经节组织中,已观察到急性炎症性疼痛模型和持续性炎症性疼痛模型中磷酸化P38MAPK显著增加。这些通路的激活增强了炎症因子(如TNF-α 和IL-1β)的表达,这些因子进一步促进了疼痛介质的释放,最终导致伤害感受器敏化。先前的研究表明,在CFA诱导的炎症性疼痛小鼠模型中,L4-6背根神经节中磷酸化P38MAPK表达上调,通过抑制P38MAPK磷酸化可以缓解这些模型中的疼痛过敏。有趣的是,使用拮抗剂A740003阻断P2X7R已被证明可以减少DRG中的p-P38MAPK表达。鉴于炎症性疼痛在其发展和维持中的关键作用,我们试图研究CFA诱导的慢性炎症性疼痛中P38MAPK磷酸化与P2X7R激活之间的关系。我们的结果表明,CFA大鼠的L4-6背根神经节中P38MAPK磷酸化在建模后14天显著增加,与先前的发现一致。值得注意的是,使用A740003抑制P2X7R功能或敲低P2X7R表达显著抑制了P38MAPK的激活。这些结果表明,P2X7R介导的P38MAPK激活在慢性炎症性疼痛的病理生理学中发挥关键作用。
因此,我们推测通过P2X7R抑制介导的EA镇痛效果可能主要涉及抑制P38MAPK信号通路。药理P2X7R拮抗剂(A740003)模仿EA的镇痛效果,但由于系统性副作用,其临床应用受到限制。相比之下,EA提供了局部P2X7R抑制,而无非靶向毒性。SGC 特异性P2X7R敲低复制了EA的益处,证实SGCs是精准镇痛的细胞靶点。与 NSAIDs 或阿片类药物不同,EA避免了胃肠道、心血管或成瘾风险。我们的开放场测试证实无运动障碍。先前的研究表明,阻断脊髓P38MAPK通路的激活可能代表EA 在CFA大鼠中的抗炎镇痛效果。在本研究中,EA治疗显著减少了CFA大鼠L4-6 背根神经节中SGCs的P2X7R、p-P38MAPK表达以及TNF-α分泌。这些结果表明,EA通过抑制SGCs中P2X7R介导的P38MAPK/TNF-α信号通路对外周炎症性疼痛发挥镇痛效果。EA在CFA诱导的炎症性疼痛中的镇痛效果的细胞机制尚不清楚。我们的研究结果表明,SGCs中P2X7R、TNF-α 和P38MAPK激活的上调与慢性炎症性疼痛的维持内在相关。EA 通过抑制这些通路来缓解疼痛。然而,没有直接证据表明抑制P38MAPK激活或中和SGCs中TNF-α表达对慢性炎症性疼痛的具体影响,以及这些机制之间的精确相互联系。因此,需要进一步的研究,采用先进和精确的实验方法,以确认SGCs中P2X7R介导的P38MAPK/TNF-α通路在EA镇痛效果中的全部作用。这些研究将为 EA 在管理炎症性疼痛中的作用提供更深入的分子基础。
5 结论
本研究揭示了SGCs中P2X7R在介导慢性炎症性疼痛中外周痛觉过敏中的精确作用。EA通过抑制SGCs中的P2X7R表达,进而抑制P38MAPK/TNF-α 通路的激活,发挥其抗炎和镇痛效果。这些发现强调了靶向外周SGCs中P2X7R以阐明EA镇痛效果的细胞机制的潜力。
中西合璧述评
本文采用“动物模型+行为学检测+分子生物学+药理学干预+基因敲低+体外细胞实验”的多层验证体系。例如,通过CFA建立稳定炎性痛模型,结合Von Frey和Hargreaves测试量化痛觉,再用蛋白质印迹、免疫荧光等验证分子表达,同时利用rAAV实现SGCs特异性P2X7R敲低,排除其他细胞干扰,结果可信度高。但是穴位特异性的分子依据不足:仅选择足三里(ST36)和昆仑(BL60)穴位,未对比其他非镇痛穴位(如无关对照穴位)的干预效果,无法排除“非特异性刺激效应”。
猜你喜欢
- Reg Anesth Pain Med:脊髓电刺激治疗慢性腰椎术后疼痛,12 个月连续活动监测揭示客观疗效与功能改善
- academic radiology:CT放射组学在预测甲状腺乳头状癌淋巴结转移中的应用
- 总是毫无原由地出汗?原因在于这6点!
- 2020年03月18日每日养生健康简报,星期三!健康是一种生活态度!
- 自测食商
- JOURNAL OF PATHOLOGY:局部和转移性阉割抗性前列腺癌中HOXB13表达模式的特征
- LIVER TRANSPLANTATION:使用右肝移植活体供体肝移植中胆道狭窄的解剖分类和临床结果
- 土豆吃完苦会中毒吗 土豆中毒喝醋還是饮茶
- 红烧鸡块的做法-咸鲜味炖菜谱
- 四川多地查获数批问题冻肉
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)