首页 > 医疗资讯/ 正文
心脏舒张是一个复杂的过程,涉及到各种相互关联的心脏生理特征,它与心脏的收缩特性一起决定了每搏输出量。围手术期心肌缺血再灌注损伤和左心室舒张功能障碍(diastolic dysfunction, DD)的特征是左心室在充足的前负荷下无法获得足够的血容量。舒张功能障碍的基线情况和围手术期舒张功能障碍对各种心脏疾病的术后并发症、住院时间和主要临床结果均有影响。年龄、女性、高血压、左心室肥大、糖尿病和围手术期缺血再灌注损伤等多种基线和围手术期因素都会增加舒张功能障碍的风险。指南中推荐的诊断标准尚未在围手术期情境中得到验证,仍需进一步明确。及时诊断舒张功能障碍对有效地治疗术后低心输出量综合征可能至关重要。这意味着需要采取个体化的液体输注策略、控制心率和心律、识别外部病因以及应用具有舒张效应的药物。本综述整合并归纳了有关心脏外科手术中舒张功能障碍各个方面的零散信息以供临床参考。
左心室舒张功能障碍通常被描述为在前负荷适当以及二尖瓣血流不受限制的条件下,左心室无法容纳适量的血液并维持足够的心脏搏出的情况。基线因素如年龄、女性、高血压、左心室肥大、糖尿病、肥胖、心房颤动和贫血都是已确定的导致射血分数保留的心力衰竭 (HFpEF) 的高危因素,除此之外围手术期缺血再灌注损伤也在术后舒张功能障碍风险中起主要作用。尽管在大多数心脏病患者中都有一定程度的舒张功能障碍,但通常不需要积极干预。然而,认识到舒张功能障碍在术后低心输出量综合征发展中的作用至关重要,因为针对这些情况的治疗方法可能存在很大差异。
左心室舒张功能障碍目前在临床上常被忽视且研究不足,本综述旨在总结左心室舒张功能障碍的病理生理学、诊断、预后重要性和治疗考虑方面的现有证据和最佳实践。尤其值得心脏麻醉医师、重症监护专家、心脏外科医生、心脏病专家以及其他参与心脏病患者围手术期管理的专业人员关注。
历史
早在60年前,心肌舒张功能受损与不同心脏疾病之间的关系就已得到初步认识。这些早期研究者观察到,左心室压力-容积关系的模式因各种病理生理条件而异,例如急性心肌缺血、急性和慢性容量超负荷以及左心室肥大。这些观察结果的潜在机制在当时尚不清楚,通常归因于心肌结构的异常。随着对ATP 依赖性Ca2+交换在心脏舒张中的作用的认识,对左心室舒张功能障碍病理生理的进一步理解也得以不断地加深。因而随着研究数据的更新,先前将心脏舒张视为被动过程的概念已发生了变化。
1972年发表了一份由6名复发性肺水肿患者组成的病例系列的早期报告,尽管这些患者在在放射学检查中心脏大小保持不变。十年后,在40%的充血性心力衰竭患者中描述了左心室舒张功能障碍作为心力衰竭(HF)主要原因的患病率。随着对该综合征的认识不断提高,HFpEF一词在论文中出现的频率越来越高,自1985年以来其提及率逐渐增加。随着医疗保健的进步, HFpEF的患病率多年来有所增加,在症状性心力衰竭C1 期和 C2 期患者中分别达到 77% 和 65%。此外,在综合重症监护病房和脓毒症患者中观察到左心室舒张功能障碍与不良预后之间的关联,并被认为是使撤离机械通气变得复杂化的因素。
Kitabatake等人于1982年首次报道了通过超声心动图测量二尖瓣血流来间接评估舒张期,这使得舒张功能障碍的评估在常规临床实践中更加便捷。随后,将该方法与其他用于舒张功能评估的侵入性方法,例如左心室造影和放射性核素血管造影)进行了对比验证,其诊断和预后价值也得到了广泛的研究。
病理生理
对舒张病理生理的全面描述超出了本综述的范围,可在其他地方查阅。舒张是一个复杂的过程,涉及各种相互关联的心脏生理特性的交互作用,例如收缩功能、心室舒张、心室顺应性、右心室和左心室之间的交互作用、充血状态的冠状动脉效应、心包的限制、心律和心房功能。临床上,将舒张过程分为四个时期,即等容舒张期、快速充盈期、减慢充盈期和心房收缩期。Brutseart 等人提出了一种更简化的心动周期划分方法,将其分为三个过程:(1)收缩、松弛和充盈(图1)。需要注意的是,上述三个过程并不完全与舒张过程中的四个周期吻合,并且彼此之间有部分重叠。因此,舒张始于收缩中期,持续至等容舒张期,并在快速充盈期末结束。充盈始于快速充盈期的开始,包括减慢充盈期,并在心房收缩后结束。
早期舒张过程在一定程度上受到先前收缩过程的调节,这被称为“弹性回缩”。收缩力的增加会使舒张增强,这与收缩末期储存的势能有关。这一能量与收缩末期容积成反比。收缩和舒张都依赖于瞬时心肌细胞激活的相同生化过程。因此,舒张受负荷、失活和不同步等因素控制:
负荷。研究表明,心肌壁应力的增加(由于收缩晚期动脉压力负荷高)会导致心肌舒张功能受损。在老年人和高血压患者中,心肌收缩力受损和血管僵硬度增加的情况较为常见。
失活。失活依赖于钙稳态以及肌浆网泵和Na+/Ca2+交换器从细胞质中去除钙的能力。这些能量依赖性的过程会随着心脏肥大和缺血而衰弱。值得注意的是,细胞内Ca2+水平的下降速度与舒张并不直接相关。显然,降低至某个阈值以下是舒张发生的必要条件,但超过此阈值后,进一步的舒张速率并不依赖于随后的Ca2+清除。在发生缺血再灌注损伤的极端病例中,可能会出现不完全舒张,称为心脏挛缩或“石头心”,这是由失活机制的严重受损引起的。
不同步。对于像心脏这样复杂的泵来说,心壁不同区域收缩和舒张速率的轻微不同步在生理上是正常的。然而,当心动周期的区域性差异变得显著时,就会导致整体舒张功能受损。
在心动周期的充盈期,血液在快速充盈期、减慢充盈期被动地充盈左心室,并通过心房收缩注入额外的血液。充盈的有效性受心率、心律和心肌结构特征等因素的影响。心动过速会缩短减慢充盈期,而当心率超过每分钟90至100次时,此期通常会消失。心房搏动对左心室舒张末期容积的贡献会随着年龄的增长而增加,最高可达40%,凸显了保持窦性心律的重要性。左心室的结构特征决定了其顺应性,并影响整个舒张期。“有效心腔顺应性”一词反映了心腔在舒张充盈期间随压力变化而改变容积的能力。心肌肥大、纤维化、淀粉样变性、瘢痕形成和其他疾病会导致心脏顺应性下降。
导致术后舒张功能障碍的外在因素有很多。这些因素包括容量或压力超负荷(包括肺动脉高压),以及心包积液和胸腔积液、肺过度充气以及肠扩张。考虑这些外在因素至关重要,因为它们可能与舒张功能障碍的内在原因相似,但在某些情况下可能得到迅速解决。
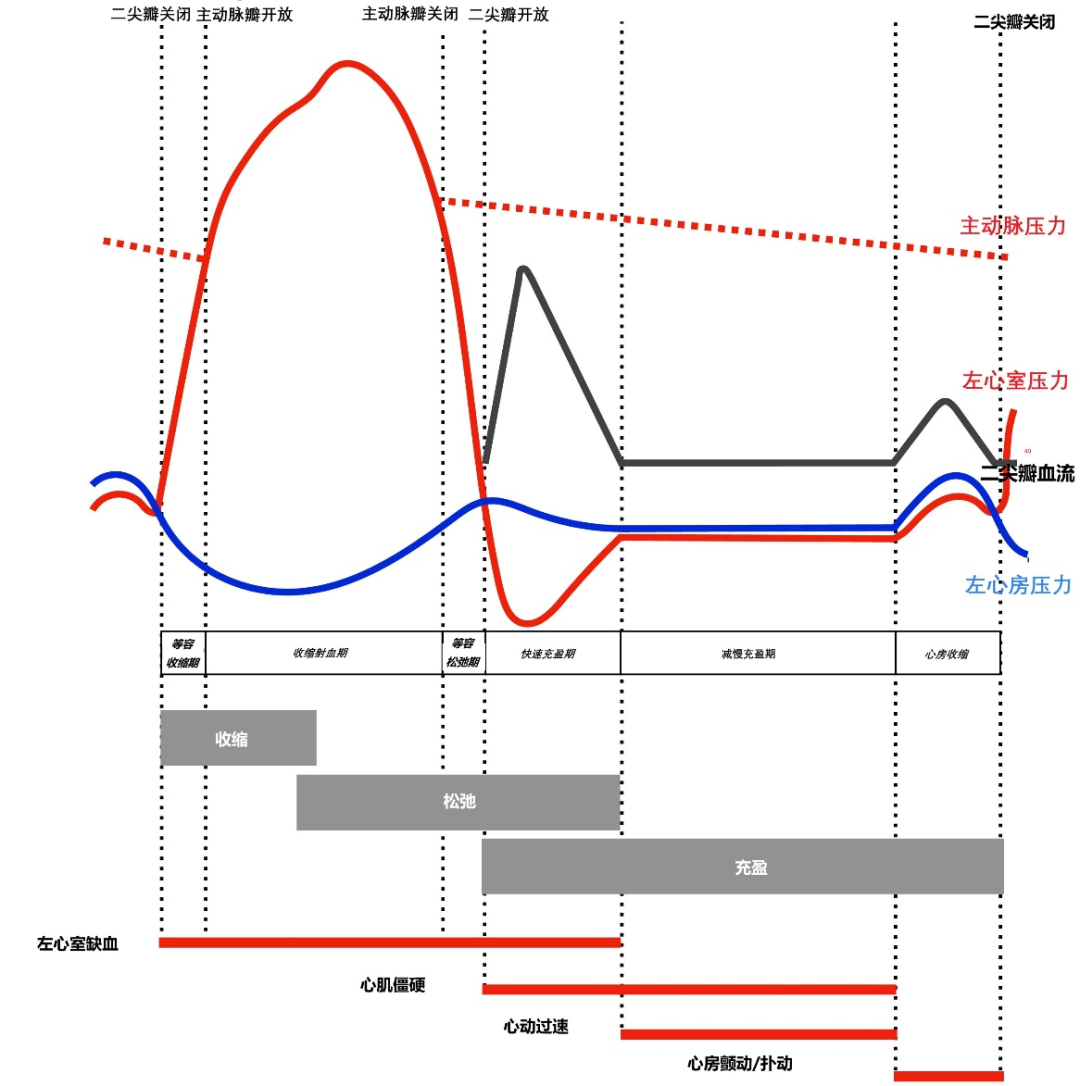
图 1 舒张功能障碍的病理生理学。上图展示了在心动周期的六个阶段,主动脉、左心室和左心房的压力曲线与心脏功能三个相互关联的过程相关:收缩、松弛和充盈。舒张功能障碍的主要病理生理原因(缺血、心肌僵硬、心动过速、心房颤动或扑动)与它们所扰乱的心动周期阶段相关。
诊断
超声心动图
超声心动图常用于评估舒张功能,也是评估患者围手术期情况的重要方法。根据现行指南,超声心动图检查应包括寻找患者(包括接受心脏外科手术的患者)左心室舒张功能受损、恢复力减弱和舒张僵硬度增加的征象。评估左心室充盈压至关重要,因为左心室舒张末期压力升高而容积不增加,强烈提示明显的舒张功能障碍。
近期的心脏外科手术研究已采用了2016年美国超声心动图学会和欧洲心血管成像协会针对超声心动图评价左室舒张功能的建议,将经胸超声心动图作为研究工具。相关参数的描述和获取方法见补充表1。目前诊断舒张功能障碍的指南不适用于围手术期,这一点已得到反复确认。这是由多种围手术期因素的影响造成的,如胸骨的切开、动态变化的负荷条件和正压通气。
将2016年之前所做的研究与最近的研究进行比较具有挑战性,这是由于2009年和 2016 年指南中提出的舒张功能障碍评估策略并不相同。在一项涉及主动脉瓣狭窄患者的研究中,比较了不同的舒张功能评估方法,发现对于舒张功能障碍的估计存在显著差异。具体而言,根据 2009 年指南建议,最初被归类为 I 级舒张功能障碍的个体中,有39.3% 患者根据 2016 年指南被重新归类为舒张功能正常。此外,根据 2009 年指南分类的个体中有44 %(62/140)在应用 2016 年指南时被重新归类为不同的等级。
根据 2016 年的指南建议,大约10%至30%的患者舒张功能“不确定”。2016年指南提出了新的左心室舒张功能参数,用以加强心脏外科手术中的超声心动图评估。舒张功能障碍的一个重要标志是左心房功能,可通过使用斑点追踪超声心动图测量左心房应变来定量评估(补充表 1)。最近的研究表明,左心房应变与左心室舒张末期压力、左心房压力和NT-proBNP水平相关,即使对于因主动脉瓣反流和主动脉瓣狭窄而接受主动脉手术的患者也是如此。在一组接受择期非体外循环冠状动脉搭桥术的患者队列中,左心房应变,尤其是储层相,与舒张功能障碍分级显著相关。左心房储层应变值<19% 可有效预测左心室充盈压升高。在Fontan患者中,左心房应变储层相增加 (p=0.04) 与基线心脏指数较高相关。然而,在这些患者中,导管插入术时心房应变与心室舒张末期压力之间无相关性。多变量 Cox 比例风险分析显示,储层应变与综合临床结果呈负相关 (HR 0.96, p=0.03)。
另一种可用的方法是测量整体纵向应变以及早期二尖瓣流入速度与早期舒张应变率之比 (E/e'sr),而不是传统的 E/e' 比值。E/e'sr比值已被认为是一种测量左心室充盈压的非侵入性方法,多项研究表明,与基于多普勒的 E/e' 比值相比,它与侵入性测量获得的左心室充盈压之间具有更好的相关性。已经证明E/e'sr可用于接受冠状动脉旁路移植术的冠状动脉疾病患者。在一项涉及652名接受独立CABG的患者的重要研究中发现,E/e'sr 是结局的独立预测因子,这与 E/e'不同。研究表明,在 CABG手术前,E/e'sr可以独立预测任何原因导致的死亡风险,尤其是对于收缩功能得以保留的患者,这使该参数优于E/e'。
最近的研究证实了在术中使用经食管超声心动图研究E/e'sr的可行性。Labus及其同事证明,在CABG手术中可以评估基于应变的左心室舒张功能测量值并使用应变对舒张功能障碍进行分级。基于应变的测量表明冠状动脉旁路移植术后左心室松弛和顺应性受损,而传统的超声心动图参数无法检测到这一点。另一项研究发现在心脏外科手术中进行经食管超声心动图检查时,e'sr与舒张功能障碍的阶段之间存在显著相关性 (r=-0.64, p<0.0001)。舒张晚期峰值纵向应变率小于0.68 1/s对预测2级或3级舒张功能障碍的敏感性为80%,特异性为81%。因此,分析舒张期心肌应变可以为围手术期使用经食管超声心动图检测舒张功能障碍提供一种更灵敏的方法。该方法考虑了负荷条件的动态变化,可以为围手术期左心室舒张功能的变化提供更深入的见解。
评估心脏病患者舒张功能的一种不太常用的方法是估计左心室僵硬程度。该方法由Klotz等人提出并验证,它基于舒张末期压力-容积关系,参照先前从侵入性研究中确定的公式(舒张末期压力=11.96+0.596*E/e'),使用单次心跳方法非侵入性地估计舒张末期压力。一项对 1893 名主动脉瓣狭窄患者的研究证明了由舒张末期压力-容积关系推测得出的左心室腔僵硬程度对主动脉瓣置换术后全因死亡率的影响。在 4.2 年的随访期内,尽管主动脉瓣置换术成功,但对于左心室射血分数正常或降低的患者,较高的心腔舒张僵硬程度与较低的生存率相关(风险比:重度vs轻度左心室僵硬度为2.7;p<0.0001)。
虽然经食管超声心动图在评估舒张功能方面准确有效,但在某些情况下或因出于其他原因而实施时,其应用可能存在挑战。然而,关于心脏外科手术期间使用经食管超声心动图测量左心室舒张功能变化及其与经胸超声心动图之间的一致性研究有限。一项纳入98例患者的小型队列研究表明,经胸超声心动图与经食管超声心动图在舒张功能障碍分级方面的一致性较差,在可评估队列中,54%的患者存在≥1级的差异,10%的患者存在≥2级的差异。
利钠肽
舒张功能障碍的外部体征在心力衰竭的诊断中起着至关重要的作用,尤其是在左心室射血分数保留的情况下。
BNP或NT-proBNP水平的测量被广泛用于确定所有类型心力衰竭的诊断和预后,包括由 舒张功能障碍引起的HFpEF。利钠肽水平与左心室舒张期壁张力和左心室舒张末期压力直接相关。利钠肽水平升高与心力衰竭患者发生主要不良心血管事件、再次入院和心血管死亡的风险增加密切相关。在心力衰竭管理期间筛查 BNP 和 NT-proBNP 水平也为评估治疗效果提供了额外的价值。上述指标已被用于评估大型临床试验中数千名舒张功能障碍患者的医疗管理,例如PARAGON-HF和NEAT-HFpEF试验。
然而,值得注意的是,在临床环境中测量 BNP 水平的敏感性高于特异性,因此它更适合于排除舒张功能障碍,而不是确认其存在。各种心脏和非心脏因素都可能导致这些生物标志物升高,包括心房颤动、既往心脏手术、肾衰竭、贫血和肺动脉高压。
侵入性设备
另一种有助于评估和管理心力衰竭患者的方法是肺动脉压(PAP)监测。该方法能够可靠地指示左心房的充盈压,而许多治疗心力衰竭的药物都针对左心房充盈压。PAP监测使临床医师能够在充血性心力衰竭症状出现之前评估心力衰竭的动态,从而能够在相对安全的时间段内选择药物治疗方案。PAP升高是左心室充血的早期征兆,并且与心力衰竭临床事件风险增加相关。降低PAP与心力衰竭住院率成比例下降相关,无论左心室射血分数如何。
目前,用于门诊患者 PAP 持续监测的设备有两种:CardioMEMS HF 设备和Cordella 系统。CardioMEMS HF设备的应用在随机临床试验(CHAMPION、GUIDE-HF)中得到了评估,证明了 PAP 监测对心力衰竭患者的有效性。在CHAMPION试验中,与对照组相比,植入 PAP 传感器后 6、15 和 18个月内因进行性心力衰竭而住院的人数显著减少。根据 PAP 值调整药物治疗。GUIDE-HF 试验扩大了纳入患者的范围,包括纽约心脏协会功能分级 II 至 IV 级的心力衰竭患者。此外,有心力衰竭临床表现但未因BNP水平升高而近期住院的患者也被纳入。出乎意料的是,经过12个月的随访,两组之间没有统计学上的显著差异。因此,这些试验结果是相互矛盾的,需要进一步讨论。Cordella HF系统在两项非随机临床试验(SIRONA、SIRONA 2)中进行了研究,这两项试验均表明,在植入装置后30天、90天和12个月,该系统降低了心力衰竭住院率,改善了生活质量,并增强了患者自理能力。一项名为 PASSPORT-HF 的新临床试验已宣布启动,该试验旨在评估 Cordella HF 系统在纽约心脏协会 III 级心力衰竭患者中的疗效。
左心室舒张功能障碍在心脏手术中的预后价值
已有多项研究调查了心脏外科手术患者的舒张功能障碍与主要不良心脏事件(MACE)之间的联系。然而,由于评估策略的差异,比较 2016 年之前的数据具有挑战性。尽管如此,早期的分类表明,无论左心室射血分数如何,术前舒张功能障碍的存在都与较高的术后死亡率和 MACE 相关。重要的是,III级舒张功能障碍患者的死亡率明显较高。这一结果在接受CABG和主动脉瓣置换术的患者中得到了观察,并得到了荟萃分析的支持。最近的研究使用了新的舒张功能障碍分类,发现舒张功能障碍与心脏手术后的MACE 或其他负面结果之间存在关联。这些关联已在主动脉瓣狭窄、主动脉瓣反流和冠状动脉疾病患者,接受 CABG、开放和经导管主动脉瓣置换术患者中得以证实。另外,一些研究将右心室的舒张功能障碍与术后心力衰竭和肺动脉瓣置换术联系起来。此外,单心室舒张功能障碍与 Fontan 手术后运动耐力降低、功能健康状况下降和动脉僵硬程度增加有关。然而,缺乏关于二尖瓣疾病患者舒张功能障碍的信息,这凸显了评估此类患者舒张功能的复杂性。
舒张功能障碍和术后低心输出量综合征
射血分数保留的心源性休克可能由多种原因引起,例如肥厚型心肌病、瓣膜疾病、心包缩窄、心肌炎以及限制性或浸润性心脏病。舒张功能受损是心脏外科手术后低心输出量综合征的主要原因,这是一种相对少见的疾病,但可能伴有其他病理生理形式的心源性休克。难以定量评估舒张功能障碍在术后低心输出量综合征发展中的作用,并且缺乏这方面的观察性数据。然而,普遍认为舒张功能障碍是一种未被充分认识的现象,其表现不具特异性。其症状很容易被归因于其他疾病和合并症。如果在低心输出量综合征治疗过程中未能识别舒张功能障碍,则可能会使患者的预后恶化。需要注意的是,目前尚无确凿的数据能够强烈推荐任何特定的干预措施或药物来治疗心脏外科手术后的左心室舒张功能障碍。此处总结了在重症监护病房中评估舒张功能障碍患者的一般原则以及使用具有松弛特性的药物的注意事项。
最近,一篇专家意见书提出了CHEOPS集束化方案,即评估左心室舒张功能障碍危重患者的框架。作者强调了胸部超声检查、血流动力学评估、呼气末正压优化以及个性化液体管理的重要性,并建议在血流动力学稳定后立即停用液体。
治疗
对于左心室舒张功能障碍患者的管理如同走钢丝。任何偏离相对狭窄的血流动力学特征的情况都可能加剧低心输出量综合征的发生。具体而言,在舒张功能障碍的患者中左心室容量降低依赖于左心房压力升高,前负荷降低会导致左心室舒张末期容量下降,而前负荷增加则会增加肺充血的可能性。治疗方案可分为三个步骤(图 2)。
第一步是排除出血、心包填塞和心肌缺血等紧急情况。此后,重点进行舒张功能障碍的主要诊断并尝试确定其病理生理学。由于松弛性和顺应性均决定舒张功能,因此这些特征的本质差异决定了具体的治疗方法。因此,由松弛障碍引起的舒张功能障碍对前负荷的耐受性更高并依赖于窦性心律,而顺应性降低与固定的每搏输出量和较高的基线前负荷有关,使其对液体管理没有反应。上述考虑以及血流动力学干预和通气优化属于该方案的第二步。使用肺动脉导管或其他侵入性高级血流动力学评估方法可能有助于滴定适当的血管活性药物,以将心脏指数维持在1.8~2.2 L/min/m2的可接受范围内。第三步体现了个体化的液体管理方法,强调了使用肺部超声和静脉充盈超声(VExUS) 选择性评估体循环和肺循环的时机。
心律和心率控制
维持窦性心律和心脏复律对于心脏病患者的血流动力学稳定至关重要,因为心房搏动可产生高达40%的左心室舒张末期容积。此外,越来越多的证据表明,对于心房颤动和HFpEF 患者,节律控制策略可能比心率控制更有益。心动过速可能通过增加心肌需氧量和缩短心休息期(减慢充盈期)来损害左心室舒张。肌丝对Ca2+脱敏引起的频率依赖性松弛加速现象是健康心肌的生理反应,但在左心室舒张功能障碍和肥大心肌中会减弱。
尽管β受体阻滞剂在心脏外科手术中的应用仍存在争议,但其心脏保护作用和抗心律失常作用已得到充分证实。β受体阻滞剂可能对舒张功能障碍患者有益,因为它们可以降低心肌能量需求并延长舒张期。伊伐布雷定可能是一种颇具吸引力的治疗选择,因为它能够降低心率而不影响正性肌力功能。近期研究表明,伊伐布雷定可以增加每搏输出量,减少对静脉-动脉体外膜肺氧合支持的需求,并降低心源性休克患者对血管加压药的需求。伊伐布雷定也可用于减轻儿茶酚胺类药物的不良变时性作用。对于正在接受多巴酚丁胺治疗的心动过速患者,伊伐布雷定可有效控制心率,进而有助于改善心脏指数、每搏输出量和收缩压。
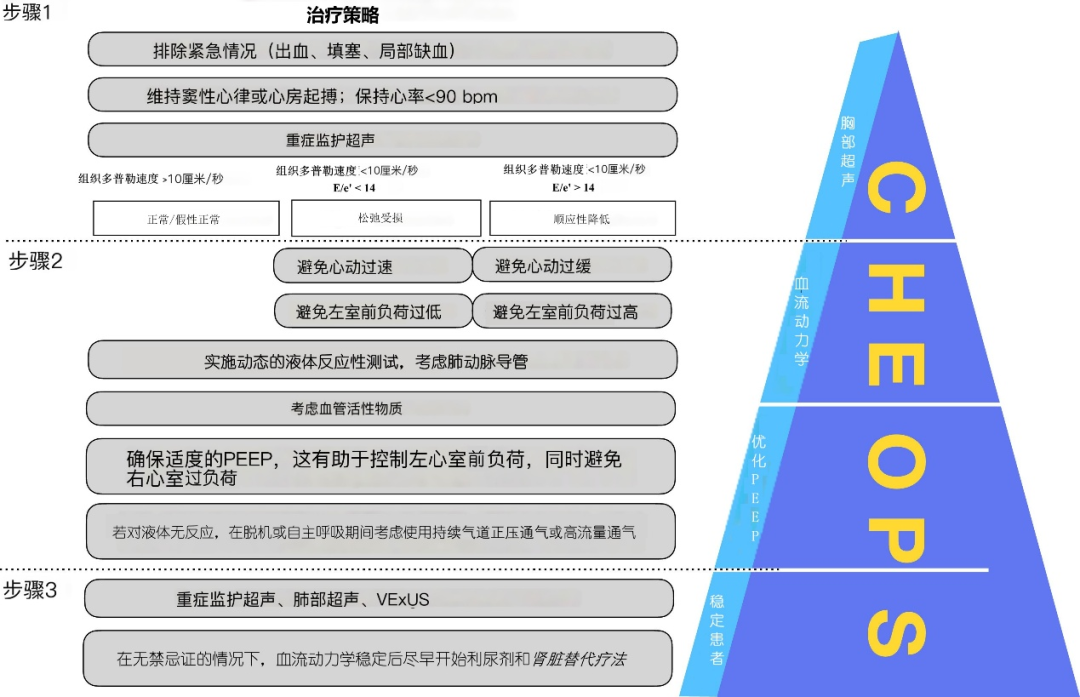
图 2。用于评估疑似术后舒张功能障碍的心脏病患者的三步法。以上策略已根据当前 ASC 指南和之前发表的文章进行了调整。第一步,建议进行胸部超声检查以确保尽可能维持窦性心律或心房起搏。应进行重症监护超声检查,包括收缩和舒张功能评估。该方案建议一种简单的方法来评估松弛受损是否伴有顺应性降低,因为这些病理生理状态对左心室前负荷和心率的耐受性不同。这应该在第二步,优化血流动力学和 PEEP 期间考虑到。在此步骤中,建议对血流动力学进行高级评估、PEEP 优化和适当的药物干预,以改善左心室舒张功能。合适的血管活性药物种类繁多,可能不仅限于β受体阻滞剂、硝酸盐、去甲肾上腺素、多巴酚丁胺、米力农、左西孟旦及其组合。第三步,一旦血流动力学稳定,应在仔细重新评估患者的容量状态后考虑移除液体。
血管加压药和正性肌力药
与治疗心源性休克的建议类似,去甲肾上腺素可被视为左心室舒张功能障碍患者稳定血流动力学的一线药物。对心脏病患者来说,充足的心肌氧供应至关重要。在这种情况下,去甲肾上腺素是达到目标舒张压和维持最佳冠状动脉灌注的首选药物。然而,重要的是要记住,过高的后负荷会增加心肌耗氧量、收缩末期压力和容量,这可能会加重舒张功能障碍。去甲肾上腺素能够增加前负荷,并通过将非应力性容量调动到循环中来改善静脉回流,这可能在松弛功能受损、液体反应性存在的情况下有益。然而,在顺应性降低、每搏输出量受限的情况下,它会加重肺充血。
常见的正性肌力药物,例如儿茶酚胺、磷酸二酯酶Ⅲ抑制剂和左西孟旦,能够通过弹性回缩机制改善心肌松弛。这包括增强的收缩末期储存能量的弹性回弹。然而,这些药物的松弛作用并不相同,其原因在于其作用机制的差异。同样值得注意的是,当变时性作用过度时,任何正性肌力药物的松弛作用都会减弱。
据观察,使用多巴酚丁胺可改善充血性心力衰竭和冠状动脉疾病患者的左心室松弛。然而,一些作者质疑多巴酚丁胺真正的松弛特性,因为松弛参数对收缩持续时间和心率有很高的依赖性,而这两者都受到该药物的影响。也有证据支持PDE3抑制剂的积极松弛作用。PDE3抑制剂改善松弛作用与肌浆网Ca2+ATPase活性加速有关,从而导致肌浆网Ca2+摄取更快。这种影响可能是由于肌浆网膜结合PDE3受到抑制,导致肌浆网中环磷酸腺苷 (cAMP) 局部升高所致。儿茶酚胺和PDE3 抑制剂可能改善松弛的另一种机制与收缩蛋白对细胞质 Ca2+含量增加产生了脱敏有关。
与儿茶酚胺和PDE3抑制剂不同,左西孟旦不会增加心肌细胞中的cAMP和Ca2+。这可能很重要,因为相似浓度的cAMP会产生不同的正性肌力和松弛作用。因此,细胞质中cAMP的增加与正性肌力作用呈线性关系,而与松弛作用呈对数关系。换句话说,当cAMP浓度达到特定水平时,可观察到最大的松弛作用,而此时在较低程度上引发正性肌力作用。此外,左西孟旦以Ca2+浓度依赖性方式与肌钙蛋白C结合,在心动周期的收缩阶段选择性地在高细胞内Ca2+浓度下使其敏感。一项对起搏乳头肌的体外研究已明确证实,左西孟旦缺乏松弛作用,且具有剂量依赖性的正性肌力作用。
许多临床研究已经证明左西孟旦具有积极的松弛作用,表明它能改善心力衰竭患者的 右心室和左心室收缩和舒张功能。在一项对30名接受 CABG 手术的患者的随机研究中,发现与硝酸甘油相比,左西孟旦可缩短减速时间和等容舒张时间并增加 E/A比值。同样,在另一项对 22 名接受血管成形术的心源性休克患者的随机研究中,与多巴酚丁胺相比,左西孟旦显著缩短了等容舒张时间和 E/A比值。然而,谨慎地解释这些评估舒张功能的研究非常重要,因为超声心动图指标会受到心率、前负荷和后负荷的影响。为了克服这一局限性,Jörgensen 等人对 23 名接受主动脉瓣置换术的患者进行了一项随机安慰剂对照研究。在该研究中,作者评估了在维持前负荷和后负荷条件下,左西孟旦与安慰剂相比的效果。左西孟旦通过增加峰值E和峰值A并缩短等容舒张时间,表现出积极的松弛作用。
钙通道阻滞剂
非二氢吡啶类钙通道阻滞剂与 β 受体阻滞剂可作为心房颤动和HFpEF患者控制心率的一线药物。然而,在心脏外科手术后的初期,务必仔细考虑使用这些药物的潜在风险/预期收益比,尤其是在存在心脏缺血的情况下。研究表明,维拉帕米可改善特发性肥厚型心肌病患者的心肌松弛功能。然而,在其他原因导致的左心室舒张功能障碍患者中并未观察到这种效果。
机械心脏支持
机械循环支持装置在心源性休克病例中的应用日益广泛。这些装置有助于改善心肌能量,从而对舒张功能产生积极影响。尚未发现任何大型研究探讨机械循环支持装置对严重左心室舒张功能障碍患者的影响。少数研究探讨了机械循环支持装置对左心室松弛特征的影响。
主动脉内球囊泵 (IABP) 的作用机制在于降低射血期间左心室后负荷,并改善舒张期冠状动脉灌注压。这两种作用均可改善心脏松弛。Khir及其同事已证实,使用 IABP 可改善左心室游离壁延长和E波峰值速度。这些改善与增强的冠状动脉血流密切相关,并且取决于所使用的具体治疗方式。在上述研究中观察到,比例为 1:1 的 IABP 周期可显著改善舒张特性。也已证实IABP对经食管超声心动图测得的舒张功能参数具有良好的影响。
研究表明,对于患有急性广泛前壁 ST 段抬高型心肌梗死并伴有心源性休克的患者,在冠状动脉成形术前放置左心室卸载装置Impella可改善梗死后 19.8 天计算机磁共振成像上的收缩期和舒张期应变率。
结论
尽管左心室舒张功能障碍是一般人群心力衰竭的明确病因,但在心脏外科手术后却常常被忽视或低估。舒张功能障碍的病因和病理生理学的多样性导致临床上无法提供通用且简单的治疗指南。此外,指南推荐的诊断标准尚未得到验证,故在围手术期的适用性较差。然而,如果舒张功能障碍是术后低心输出量综合征的病因,那么及时诊断至关重要。舒张功能障碍的治疗需要个体化,其基础是排除外在原因(例如心包填塞)、使心率和心律正常化、预防心肌缺血以及优化前、后负荷。根据症状,可以使用多种血管活性药物,从β受体阻滞剂到具有松弛效应的正性肌力药物。需要进一步研究来阐明和验证围手术期舒张功能障碍的标准,以及预防干预措施和治疗策略。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)