首页 > 医疗资讯/ 正文
近日,重庆医科大学基础医学院蒋宁研究团队在Advanced Science杂志发表题为“MTFR2-Mediated Fission Drives Fatty Acid and Mitochondrial Co-Transfer from Hepatic Stellate Cells to Tumor Cells Fueling Oncogenesis”,以揭示脂肪酸与线粒体从肝星状细胞共转移至癌细胞,推动肝癌的进展。重庆医科大学张腊博士、周宝勇博士后、杨俊博士后为该论文的共同第一作者,该校附属第一医院黄佐天、吴忠均以及基础医学院蒋宁为共同通讯作者。
肝细胞癌(HCC)作为一种常见且恶性程度高的肿瘤,严重威胁人类健康。在HCC边缘区域内的癌细胞具有独特代谢以满足其侵袭特征,然而其依赖脂肪酸氧化(FAO)获取能量的机制尚不明确。该研究团队发现肿瘤边缘激活的肝星状细胞(aHSCs)中,线粒体裂变调节因子2(MTFR2)发挥关键作用,通过促进线粒体分裂,实现脂肪酸和线粒体向HCC细胞的转移;在癌细胞内,脂肪酸作为燃料,线粒体作为工厂,协同增强FAO水平,为肿瘤生长提供支持(图1)。这一发现表明,靶向MTFR2驱动的线粒体分裂或许能成为干扰肿瘤细胞与基质微环境代谢交互的新型治疗策略,相关研究成果具有重要的临床应用潜力。

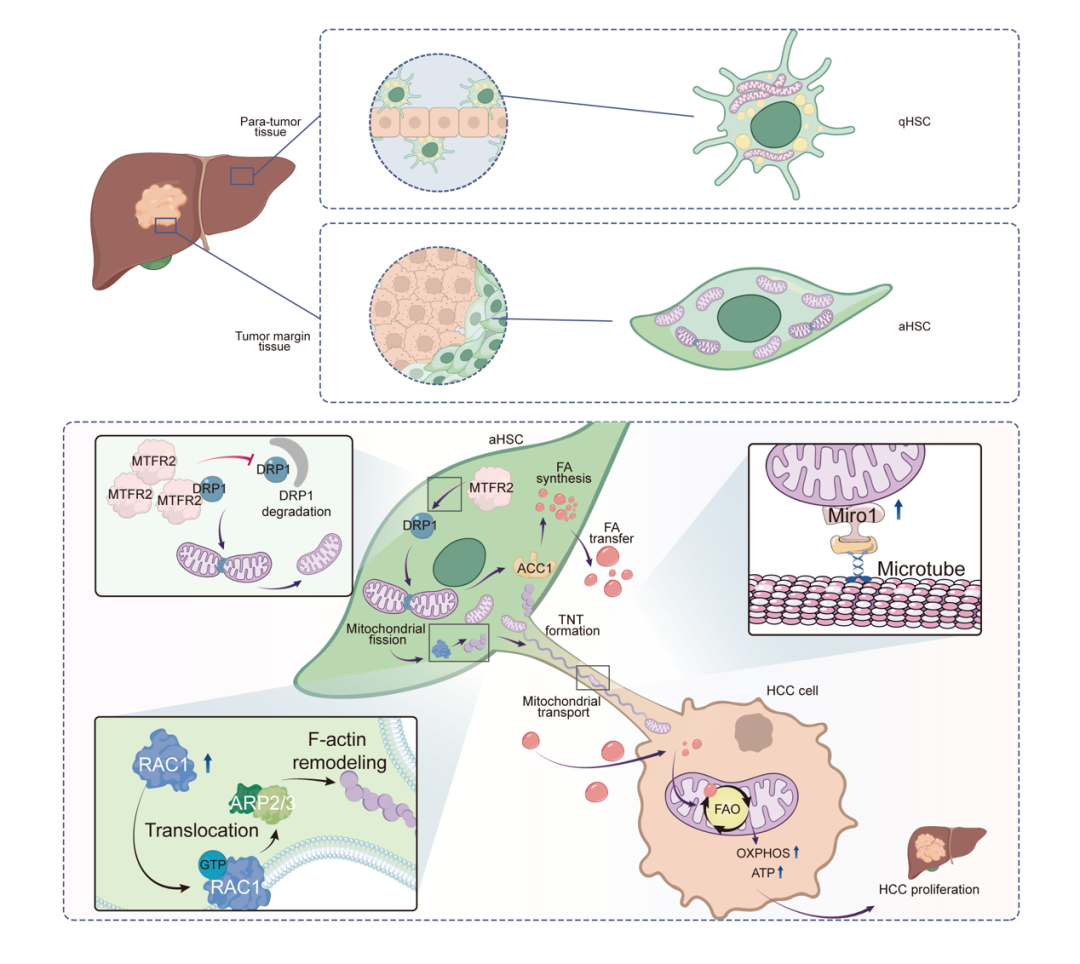
图1:在HCC肿瘤微环境中,aHSCs利用MTFR2协调双重代谢级联反应,推动肝癌进展。aHSCs中MTFR2上调引发依赖DRP1的线粒体分裂,随后,ACC1上调促进脂肪酸合成,脂肪酸储存到脂滴后转移至肝癌细胞。同时,线粒体分裂加速隧道纳米管(TNTs)形成促进线粒体转移。最终,肝癌细胞利用转移来的脂肪酸和线粒体增强脂肪酸氧化,增加ATP生成,增殖能力增强。
该研究团队首先通过分析HCC患者及小鼠原位瘤模型组织样本发现,肿瘤边缘的HSCs显著激活,且线粒体分裂活跃。进一步分析转录组数据表明,MTFR2在aHSCs中显著上调,体外实验证实MTFR2介导的线粒体分裂在aHSCs中活跃。功能实验证实,MTFR2调控 aHSCs线粒体动力学,对HCC细胞的增殖和凋亡产生重要影响,促进HCC细胞增殖,抑制其凋亡(如图2所示)。
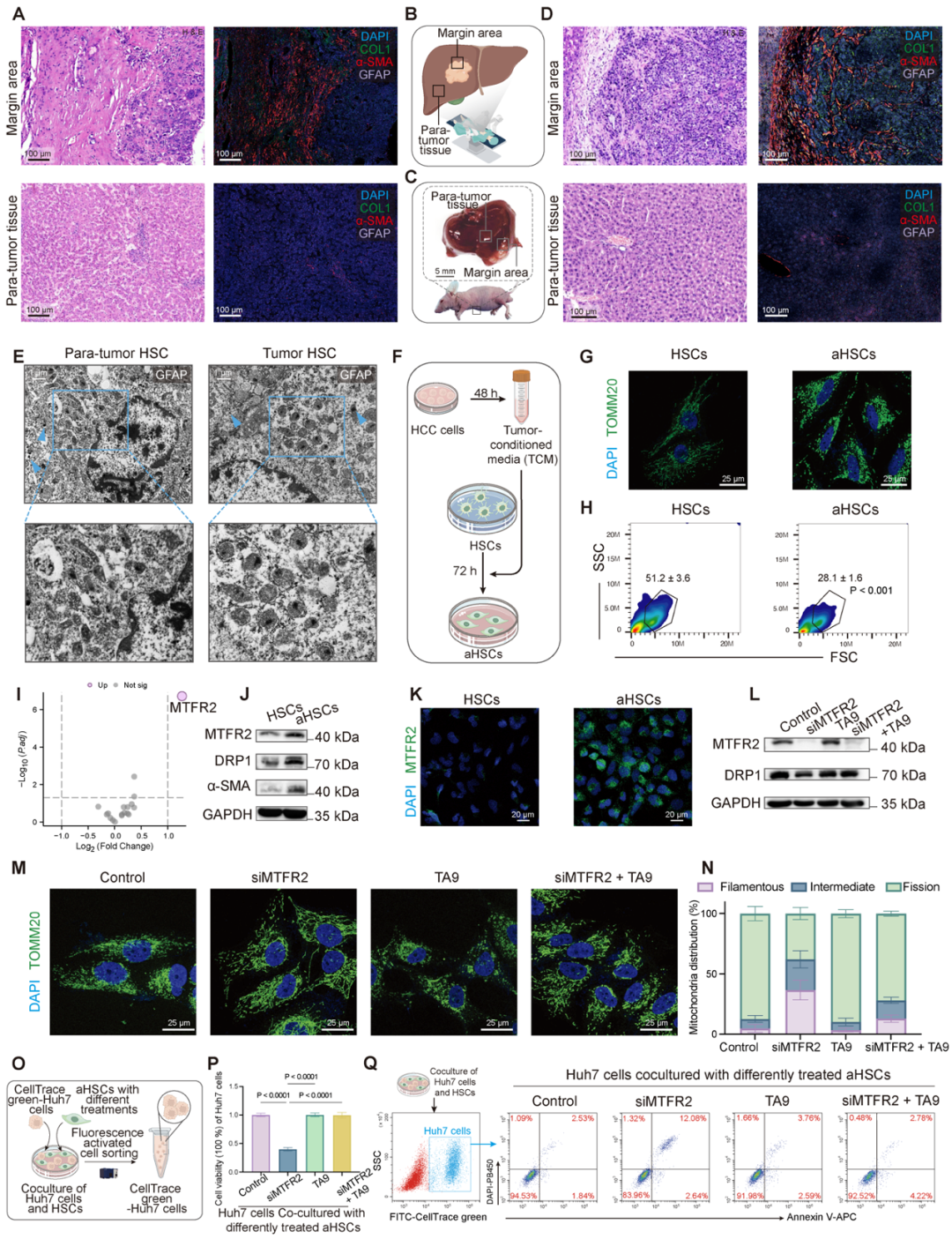
图2:aHSCs中MTFR2介导的线粒体分裂促进HCC的进展(来源:AdvSci)。
代谢重编程对肿瘤进展至关重要,既往研究发现HCC肿瘤边缘以FAO为主要代谢途径,该团队利用HCC患者组织样本同样证实HCC边缘区FAO限速酶 CPT1A显著上调。通过共培养实验,团队发现aHSCs可促使HCC 细胞中CPT1A表达升高。深入研究发现,MTFR2驱动的aHSCs线粒体分裂能够增强HCC细胞的FAO,为肿瘤细胞提供能量并减轻DNA损伤,从而推动HCC进展。当抑制FAO时,即便恢复aHSCs中MTFR2介导的线粒体分裂,HCC细胞的活力、ATP生成仍会降低,DNA 损伤加剧,更加强调了MTFR2对HCC的促进作依赖于FAO(图3)。
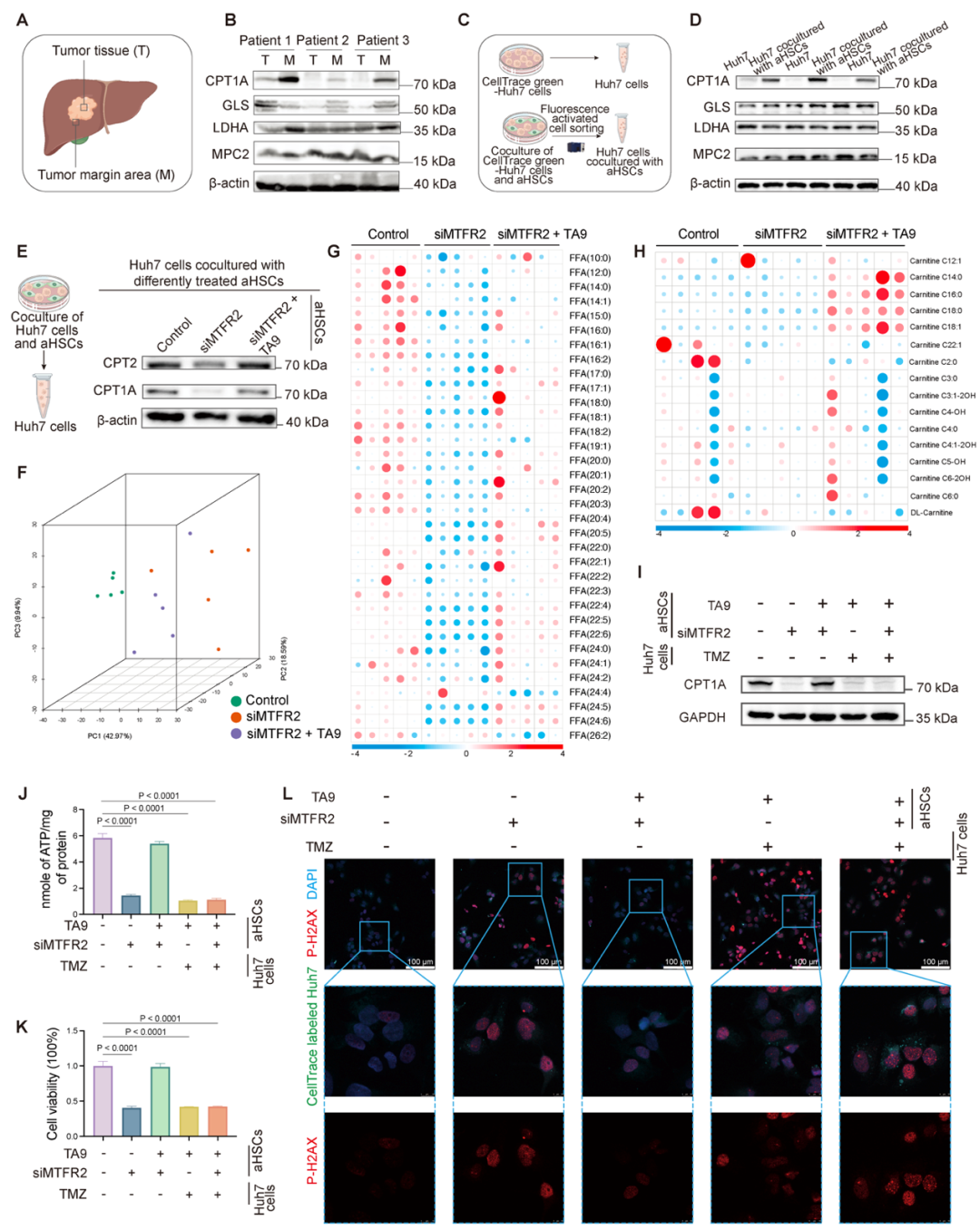
图3:aHSCs中MTFR2介导的线粒体分裂通过加速HCC细胞中的FAO水平促进HCC进展(来源:AdvSci)。
团队进一步发现,HCC细胞依赖外源脂肪酸,而aHSCs可通过MTFR2依赖的线粒体分裂上调脂肪酸合成关键酶ACC1增加脂肪酸合成,并将脂肪酸转移至HCC细胞促进其增殖。此外,抑制脂肪酸摄取会显著抑制HCC细胞增殖,表明脂肪酸转移在肿瘤生长中具有关键作用(图4)。
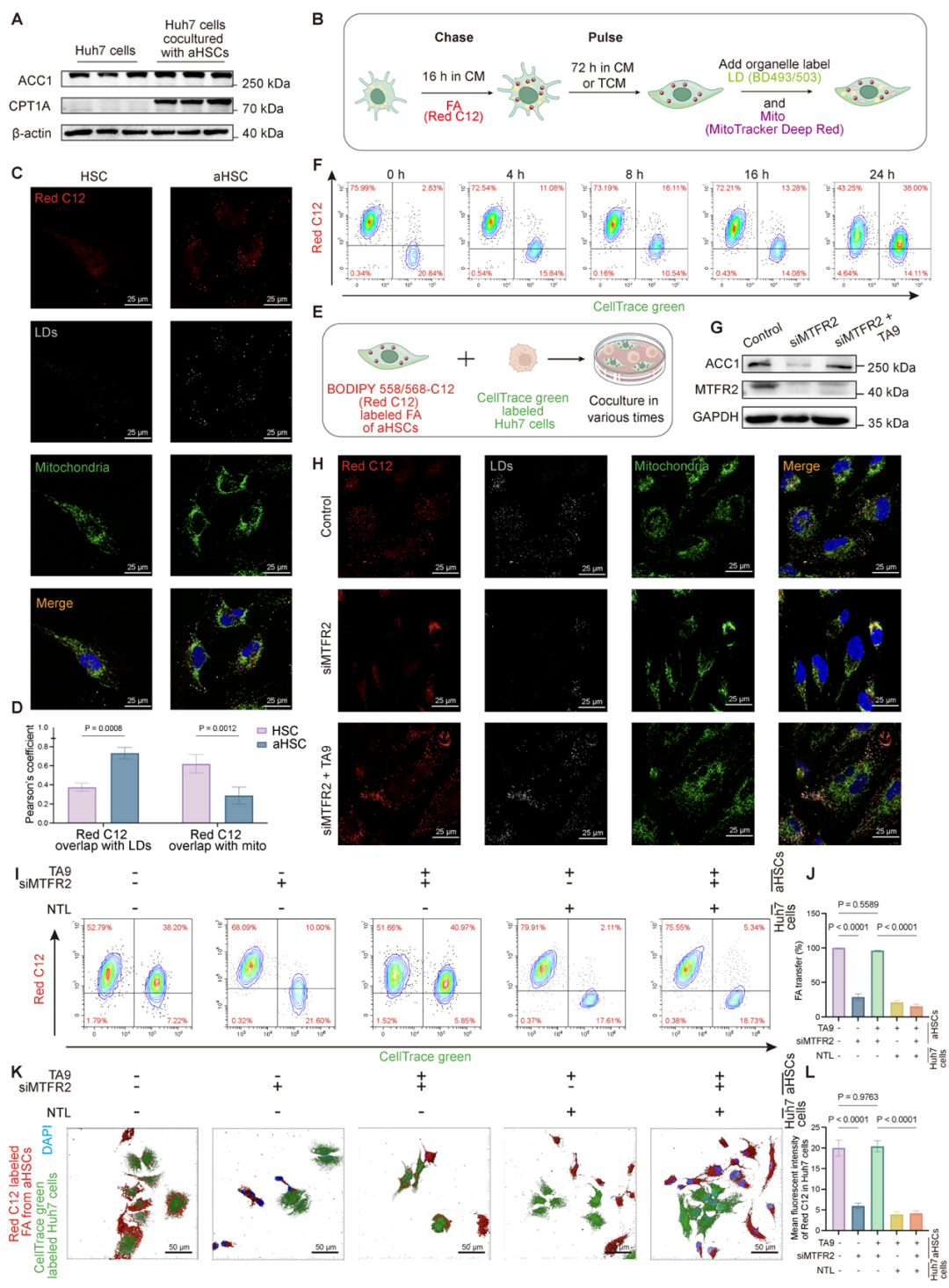
图4:aHSCs增强脂肪酸的合成并转移到癌症细胞,促进增殖(来源:AdvSci)。
考虑到FAO需要充足的线粒体以处理脂肪酸,团队进一步研究发现aHSCs与HCC细胞之间存在隧道纳米管(TNTs),而aHSCs可通过TNTs向HCC细胞转移线粒体。MTFR2 在这一过程中发挥重要调控作用,敲低MTFR2会减少TNT 形成,抑制线粒体转移;功能实验显示,抑制线粒体转移会显著降低HCC细胞活力,影响关键线粒体蛋白表达,突出了MTFR2驱动的线粒体转移对肿瘤代谢和增殖的重要支持作用(图5)。

图5:αHSCs中MTFR2驱动的线粒体分裂促进线粒体转移到HCC细胞,促进肿瘤进展(来源:AdvSci)。
在体内实验中,团队构建了MTFR2敲低的HSCs稳转株,并将其与MHCC-97H细胞共注射到小鼠体内。结果显示,敲低MTFR2会显著抑制HSCs促进肿瘤生长的能力,使肿瘤重量、体积减小,Ki67阳性细胞减少,关键FAO酶水平降低,线粒体转移减少(图6),进一步强调MTFR2依赖的线粒体分裂对HCC细胞FAO的关键作用。
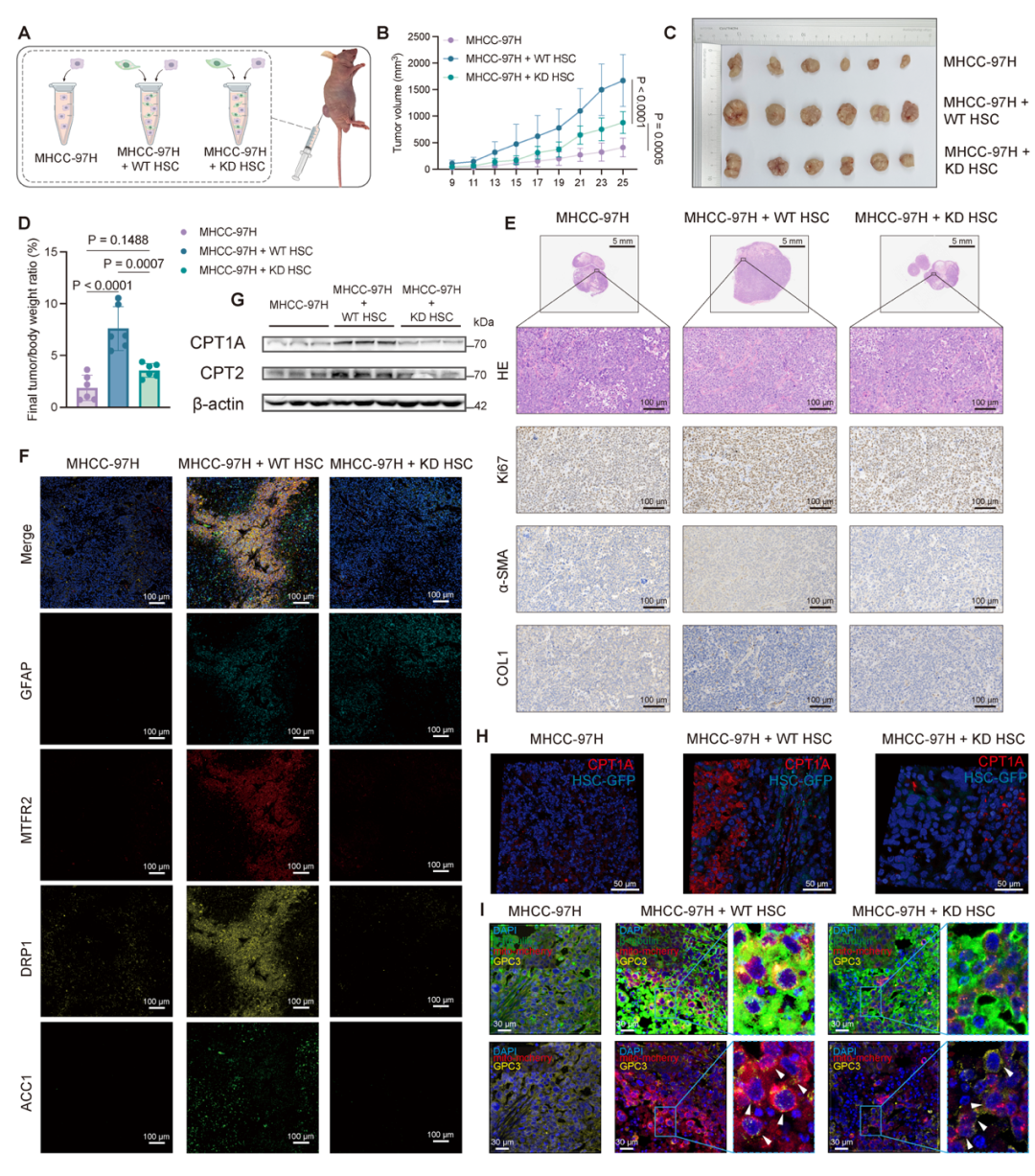
图6:体内实验中aHSCs中的MTFR2在驱动肿瘤进展(来源:AdvSci)。
机制研究表明,MTFR2通过抑制DRP1的溶酶体降解来稳定线粒体分裂关键蛋白DRP1,进而促进线粒体分裂。此外,恢复DRP1表达能够挽救因MTFR2敲低导致的脂肪酸和线粒体转移受阻、肿瘤细胞增殖受抑制等情况,表明 MTFR2 促进肿瘤进展的机制在很大程度上依赖于DRP1(图7)。
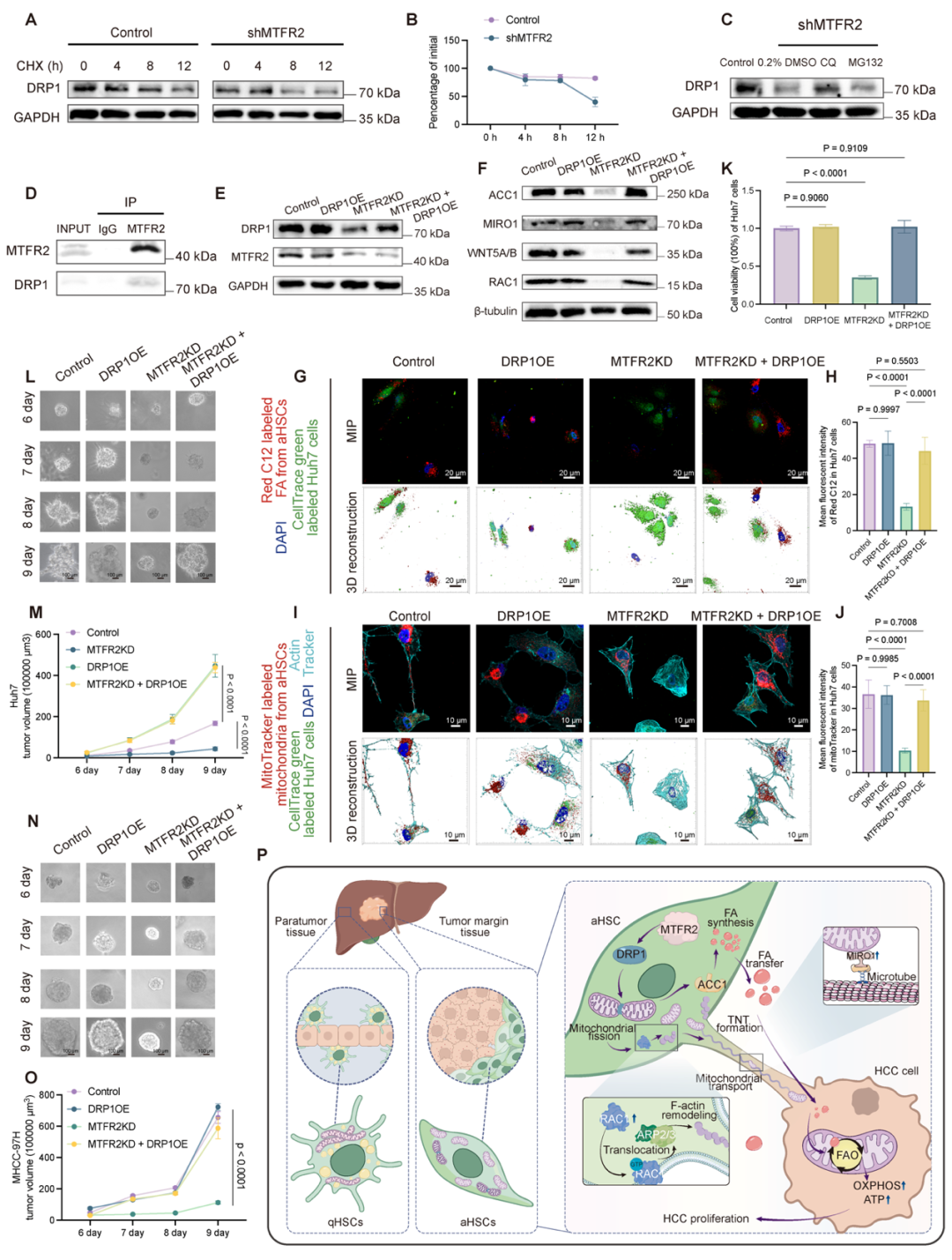
图7:MTFR2通过DRP1实现对HCC增殖的促进作用(来源:AdvSci)。
基于上述结果,在这项研究中,研究人员揭示了MTFR2在HSCs与HCC细胞代谢交互中的核心作用。MTFR2通过促进线粒体分裂,实现脂肪酸和线粒体从HSCs向HCC细胞的转移,为肿瘤生长提供能量和代谢支持。这一发现为肝癌治疗提供了潜在的新靶点。这种针对MTFR2的研究思路,如同开发双靶点治疗策略一样,在代谢和细胞功能层面上对肿瘤细胞进行双重干预,有望显著改善肝癌的治疗效果。未来,基于MTFR2的研究可以进一步拓展,如同改进纳米载体靶向性一样,通过更精准地调控MTFR2的功能,使其能够应用于更多类型的肝癌治疗,甚至可能为其他肿瘤的治疗提供借鉴。
原文链接:
https://doi.org/10.1002/advs.202416419
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)