首页 > 医疗资讯/ 正文
扩张型心肌病(DCM)是心力衰竭的主要诱因之一,目前缺乏有效治疗手段,5年生存率低于50%。DCM具有较高的遗传相关性,约50%的病例与遗传突变相关。其中,编码心脏肌钙蛋白T (cTnT)的基因TNNT2突变是DCM的主要致病因素,已有研究发现cTnT突变主要引起心肌细胞内肌小节结构紊乱。线粒体作为心肌细胞的“动力工厂”,其空间分布受肌原纤维严格限制,形成动态的线粒体网络,以支撑心肌收缩的能量需求。然而,肌小节和线粒体间如何通过分子通讯或对话来维持线粒体稳态和心脏功能,一直是领域内的核心问题。
2025年5月27日,苏州大学胡士军/沈振亚合作团队在Circulation杂志上发表了题为“The disruption of cTnT-mediated sarcomere-mitochondrial communication results in dilated cardiomyopathy”的研究论文。本研究利用患者特异性诱导多能干细胞(iPSCs)模型,首次绘制出心肌收缩单元与心脏能量代谢枢纽的分子对话图谱,揭示了cTnT突变蛋白通过“肌小节-线粒体通讯”障碍导致DCM的全新病理机制,为开发靶向线粒体稳态治疗策略提供了理论基础。

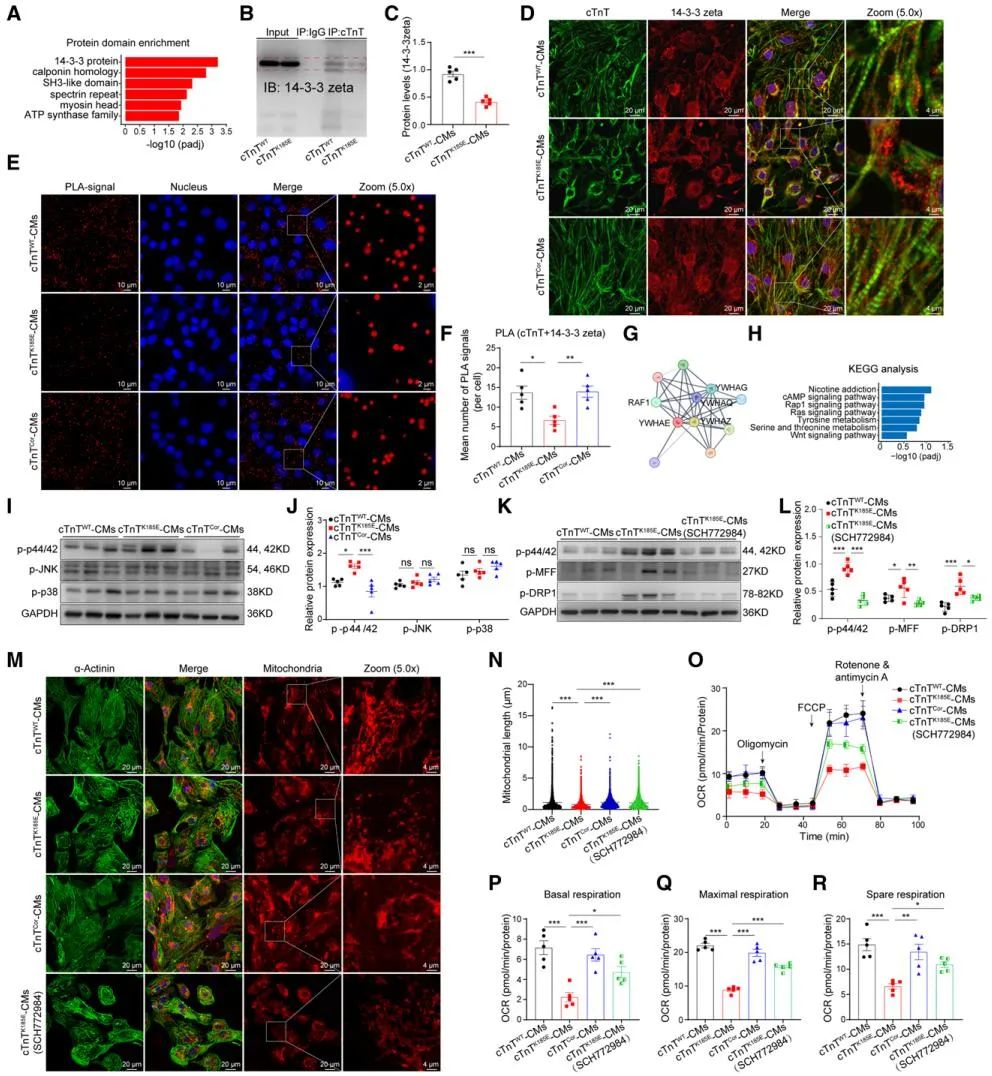
本研究通过全外显子测序,在遗传性DCM家族中筛选出新型致病cTnT突变位点(p.K185E)。为突破传统研究模型的局限,团队利用患者特异iPSCs衍生心肌细胞、自主开发的腔室化血管化心脏类器官(Cell Prolif. 2024;57(8):e13631)以及点突变转基因小鼠模型,联合分析DCM病理特征,首次发现cTnT (p.K185E)突变不仅破坏心肌细胞内肌小节结构,还可导致线粒体网络片段化和功能紊乱。免疫共沉淀质谱组学显示,cTnT不仅是心肌收缩单元的力学传感器,更是线粒体代谢网络的调控中枢;而cTnT与14-3-3的蛋白相互作用是“肌小节-线粒体对话”的关键分子桥梁。
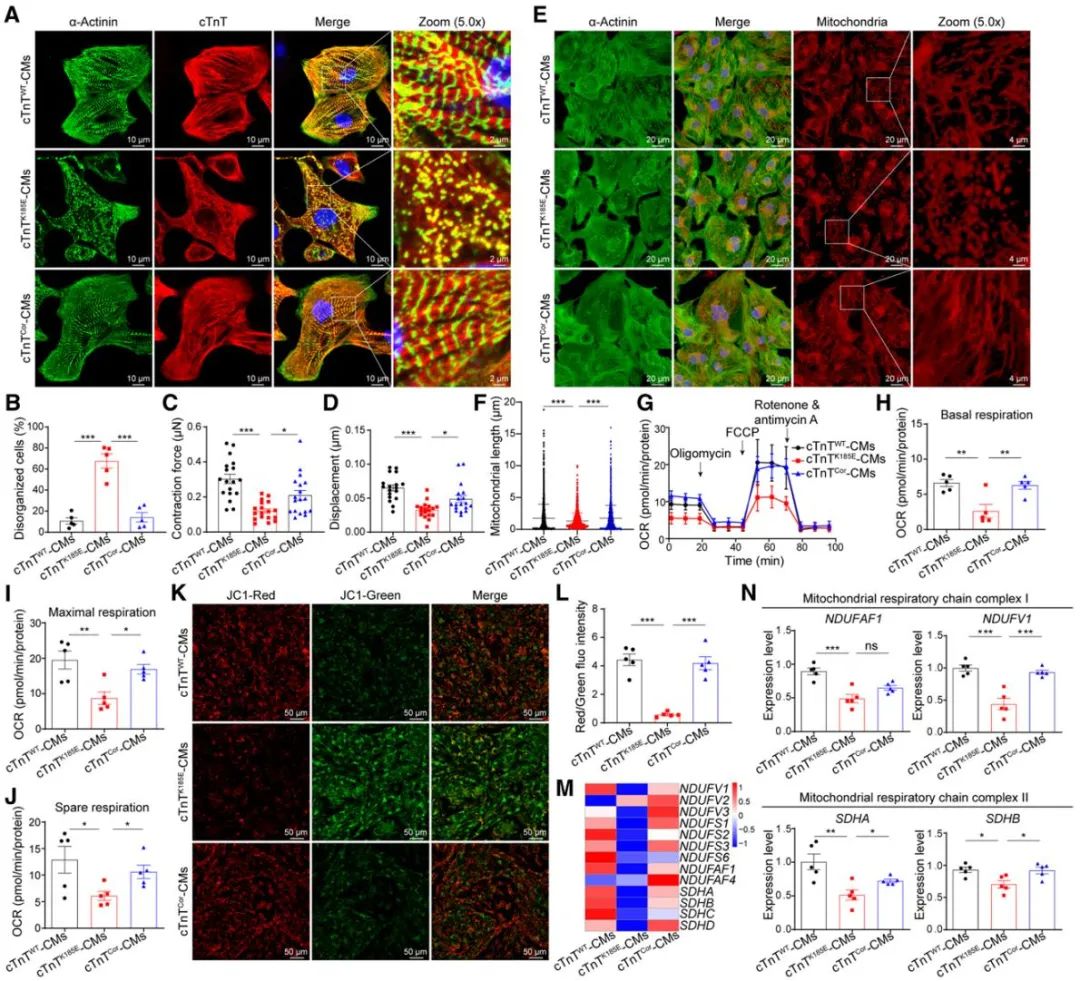
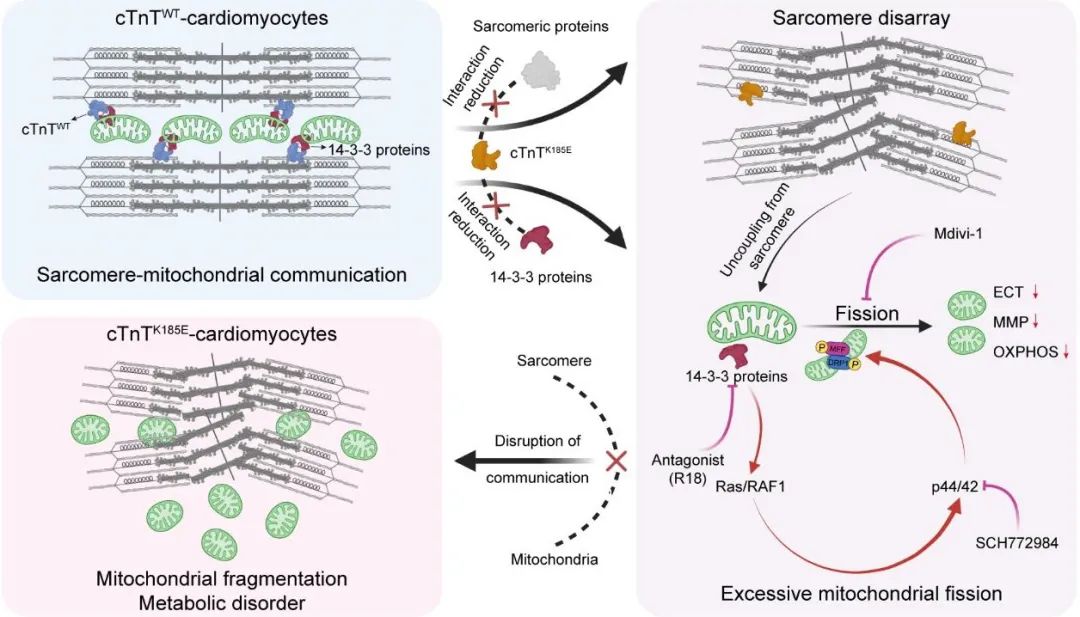
研究团队进一步发现,cTnT (p.K185E)突变引发cTnT与14-3-3蛋白的结合受损,导致“肌小节-线粒体通讯”解偶联。游离的14-3-3蛋白进而激活RAS-RAF1-p44/42信号通路,磷酸化线粒体分裂调控蛋白MFF和DRP1,最终导致线粒体过度分裂和代谢功能紊乱。这些发现为理解DCM的发病机制提供了新视角。
研究团队不仅在cTnT突变的3D心脏类器官和小鼠模型中再现了DCM临床病理特征和线粒体代谢异常表型,证实cTnT (p.K185E)突变是人类DCM发生发展的关键风险因素;更具临床转化价值的是,该团队发现靶向抑制线粒体分裂的小分子化合物Mdivi-1可有效逆转DCM疾病表型,显著改善DCM小鼠的心功能。该研究为突破包括DCM在内的心脏疾病传统治疗手段,开创“能量代谢重塑”新范式提供了重要依据。
苏州大学心血管病研究所叶领群副研究员和雷伟副教授、华中科技大学同济医学院附属协和医院刘隽炜主任医师为该论文的共同第一作者。苏州大学心血管病研究所/苏州大学附属第一医院的胡士军教授和沈振亚教授为该论文的共同通讯作者。该工作还得到了阿拉巴马大学伯明翰分校张建一教授和河北北方学院赵振奥副教授的指导和帮助。
论文链接:
https://doi.org/10.1161/CIRCULATIONAHA.125.071523
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)