首页 > 医疗资讯/ 正文
癌症恶病质(Cancer Cachexia)是一种复杂的代谢综合征,表现为骨骼肌萎缩、体重下降、脂肪减少等,严重影响患者的生活质量和预后。尽管其在晚期癌症患者中较为常见,但目前对于其发病机制的理解仍然有限,缺乏有效的治疗手段。近年来,研究发现炎症因子在恶病质的发展中可能起到关键作用,但这些因子如何进入肌肉并促进恶病质的进展仍不清楚。此外,血管内皮细胞(ECs)作为血液与组织之间的第一道防线,其功能障碍可能在恶病质中扮演重要角色。本研究旨在探讨血管内皮功能障碍是否是癌症恶病质的关键介质,并揭示其潜在的分子机制。
近日,国际权威期刊Nature Cancer上在线发表了题为“Skeletal muscle endothelial dysfunction through the activin A–PGC1α axis drives progression of cancer cachexia”的最新研究成果。该研究通过多种肿瘤模型(包括胰腺癌、结肠癌、肺癌和黑色素瘤模型),发现肌肉血管密度的减少先于肌肉萎缩发生。研究进一步揭示,随着肿瘤进展,循环中的激活素A(Activin A)水平升高,远程抑制肌肉内皮细胞中过氧化物酶体增殖物激活受体γ共激活因子1α(PGC1α)的表达,从而诱导血管渗漏。通过恢复内皮细胞中PGC1α的活性,可以在荷瘤小鼠中保留血管密度和肌肉质量。这些发现表明,恢复肌肉内皮功能可能是治疗癌症恶病质的有价值的方法。

研究者使用了多种小鼠模型,包括自发性胰腺癌模型(KPC小鼠)、以及多种同种异体移植肿瘤模型(如CT26结肠癌、LLC1肺癌和B16F10黑色素瘤)。这些模型涵盖了不同的肿瘤类型和生长阶段,用于研究肌肉血管密度与肌肉萎缩之间的关系。此外,研究还涉及了人类样本的分析,比较了癌症患者和非癌症对照组的肌肉血管密度。
通过透明组织断层扫描技术,研究者观察到在多种肿瘤模型中,肌肉血管密度的减少先于肌肉萎缩发生。例如,在KPC小鼠中,5个月大的小鼠体重下降超过10%,而3个月大的小鼠则没有这种差异。进一步的分析显示,3个月大的KPC小鼠肌肉血管密度已经显著降低,而肌肉萎缩则在5个月大时才明显。这种血管密度的减少不仅在KPC模型中观察到,还在其他三种肿瘤模型中得到了验证。
研究发现,循环中的激活素A水平在恶病质小鼠中显著升高。激活素A是一种已知的肿瘤衍生因子,能够远程抑制肌肉内皮细胞中PGC1α的表达。通过构建腺相关病毒(AAV)过表达激活素A的小鼠模型,研究者发现高剂量的激活素A能够显著降低肌肉血管密度,并增加肌肉内皮细胞的凋亡和内皮-间充质转化(EndMT)。
PGC1α在维持内皮细胞功能和血管完整性中起着关键作用。研究者通过单细胞RNA测序(scRNA-seq)分析发现,在恶病质小鼠的肌肉内皮细胞中,PGC1α的表达显著降低。进一步的实验表明,PGC1α的缺失会导致内皮细胞凋亡增加、血管渗漏和炎症细胞浸润。此外,通过恢复PGC1α的表达,可以显著改善肌肉血管密度和肌肉质量。
综上所述,本研究揭示了肌肉内皮功能障碍在癌症恶病质中的关键作用,并提出了激活素A-PGC1α轴作为潜在的治疗靶点。通过恢复肌肉内皮细胞中PGC1α的活性,可以有效改善肌肉血管密度和肌肉质量,为癌症恶病质的治疗提供了新的思路。未来的研究可以进一步探索这一轴在不同肿瘤类型和疾病阶段中的作用机制,并开发针对该轴的特异性治疗策略。
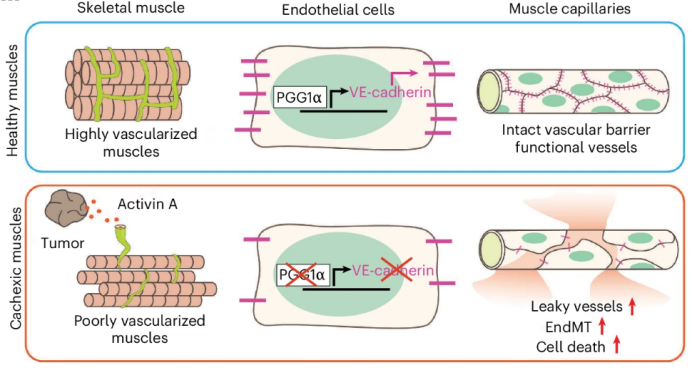
图 本研究模式图
原始出处:
Skeletal muscle endothelial dysfunction through the activin A-PGC1α axis drives progression of cancer cachexia. Nat Cancer. 2025 May 26. doi: 10.1038/s43018-025-00975-6. Epub ahead of print. PMID: 40419762.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)