首页 > 医疗资讯/ 正文
帕金森病(Parkinson’s disease, PD)是一种常见的神经退行性疾病,其特征是运动迟缓、静止性震颤和肌强直等经典症状。尽管目前的多巴胺替代疗法能够在一定程度上缓解症状,但并不能延缓疾病的进展。因此,寻找新的治疗药物成为了帕金森病研究领域的关键任务。
龙胆苦苷(Gentiopicroside,GPS),是从龙胆科植物(如龙胆草、秦艽等)中提取的一种环烯醚萜苷类化合物。它在传统医学中有着悠久的应用历史,近年来,随着现代药理学研究的深入,龙胆苦苷的多种药理作用逐渐被揭示,引起了科学界和医药界的广泛关注。
近期,一项发表在《Journal of Advanced Research》上的研究为我们带来了新的希望。该研究揭示了通过靶向胆汁酸受体TGR5激活Nrf2抗氧化信号通路,从而减轻帕金森病症状的潜力。

图1 论文首页
GPS改善帕金森病小鼠的运动功能和神经退行性
在MPTP诱导的帕金森病小鼠模型中,GPS显著改善了小鼠的运动功能障碍。具体表现为在旷场实验中,GPS处理的小鼠活动距离显著增加;在旋转杆实验中,小鼠的停留时间延长;在竿实验中,小鼠的转身时间和总时间缩短。这些结果表明GPS能够显著改善帕金森病小鼠的运动协调能力。
在神经退行性方面,免疫荧光染色结果显示,MPTP处理导致小鼠黑质致密部(SNpc)中酪氨酸羟化酶(TH)阳性神经元数量显著减少,而GPS处理能够剂量依赖性地逆转这一变化。此外,GPS还减轻了MPTP诱导的纹状体(STR)中TH阳性纤维密度的降低。西方印迹分析进一步证实了GPS处理能够上调帕金森病小鼠SNpc和STR区域中TH蛋白的水平。这些结果表明GPS对帕金森病小鼠的多巴胺能神经元具有保护作用。
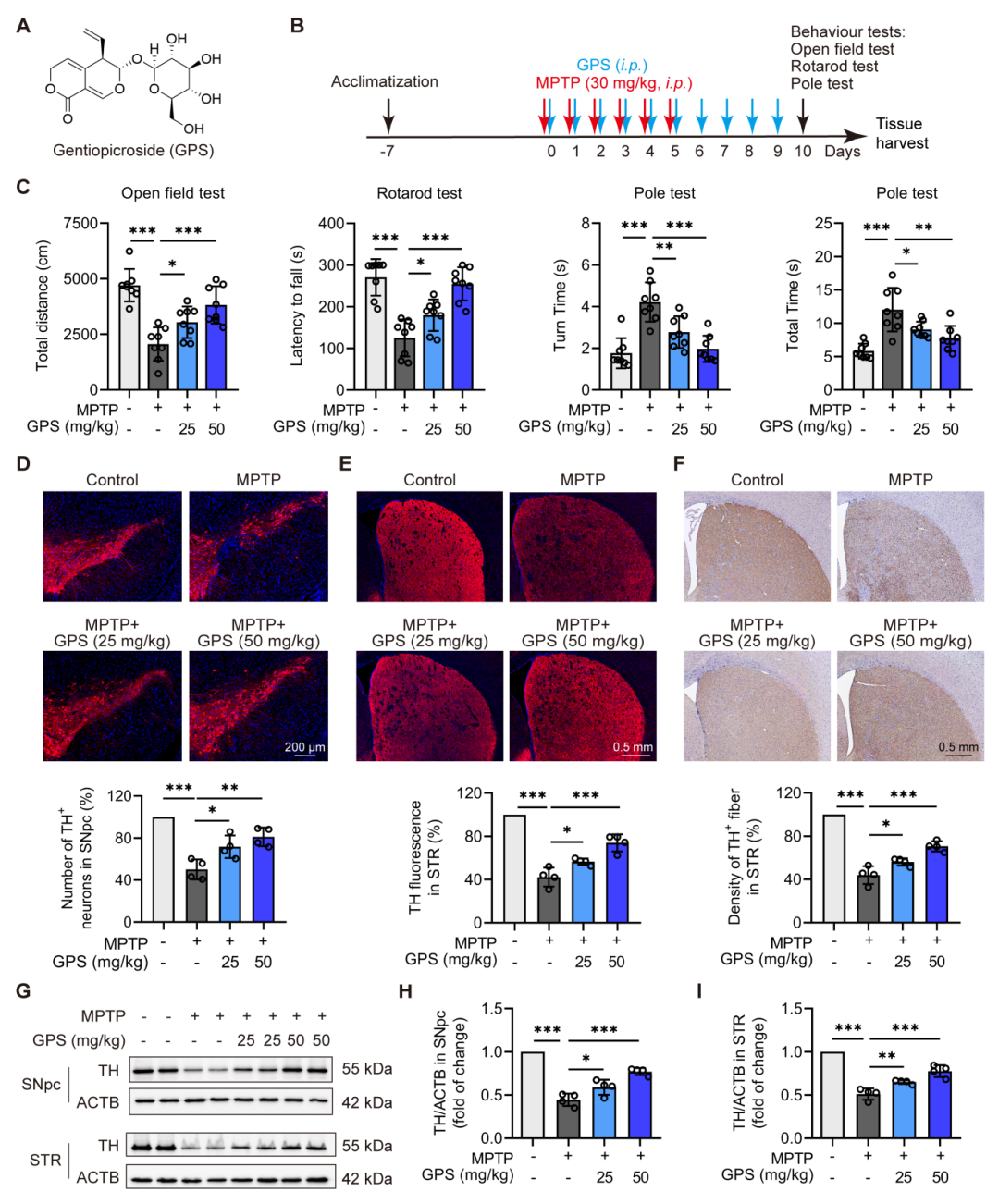
图2 GPS改善了MPTP- 531诱导的PD小鼠的运动缺陷和多巴胺能神经变性
GPS减轻MPP+诱导的细胞毒性
在体外实验中,研究人员发现GPS能够显著减轻MPP+诱导的SH-SY5Y细胞毒性。CCK-8实验结果显示,GPS预处理能够剂量依赖性地提高MPP+处理后的细胞存活率。此外,Hoechst 33342/PI双染实验也表明,GPS处理显著降低了MPP+诱导的细胞死亡率。这些结果表明GPS对MPP+诱导的细胞损伤具有显著的保护作用。
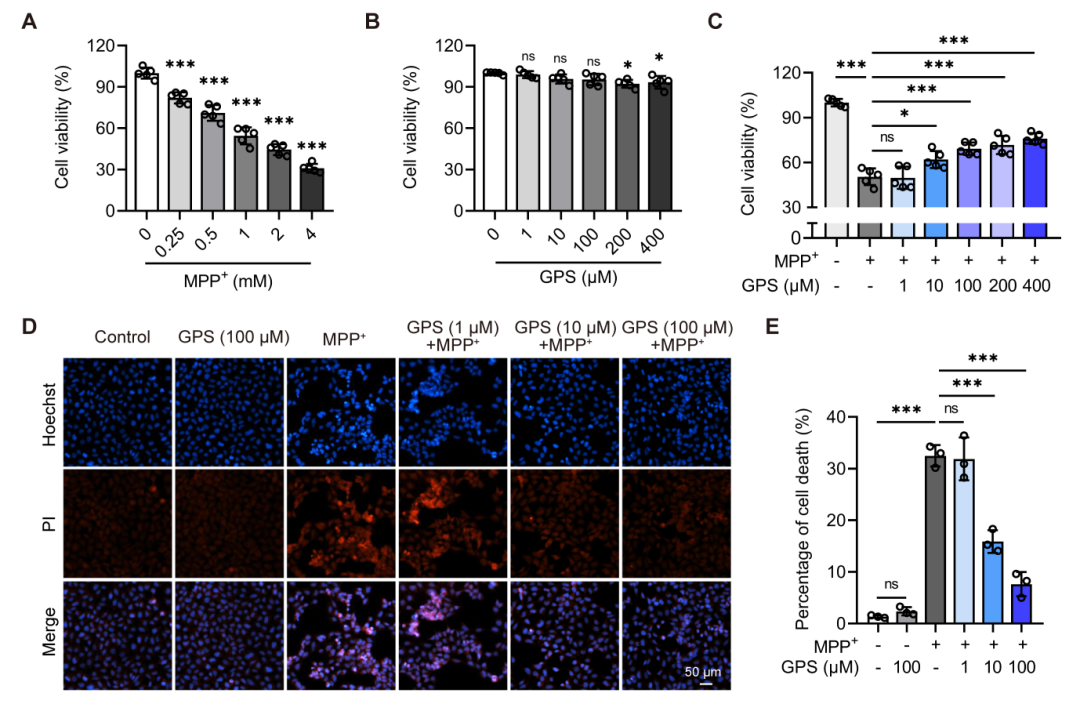
图3 GPS减弱MPP+诱导的SH-SY5Y细胞神经毒性
GPS调节转录组谱
为了深入探究GPS的作用机制,研究人员对MPP+处理的SH-SY5Y细胞进行了全基因组RNA测序分析。结果表明,与对照组相比,MPP+处理的细胞中有1918个差异表达基因(DEGs)。而与MPP+组相比,GPS处理的细胞中有733个DEGs,其中包括598个下调基因和135个上调基因。基因本体(GO)和京都基因与基因组百科全书(KEGG)富集分析显示,GPS上调了与G蛋白偶联受体信号通路、cAMP信号、多巴胺代谢和活性氧代谢过程相关的基因表达,而下调了与转录调控、内质网应激、信号转导和凋亡过程相关的基因。这些结果提示GPS可能通过调节抗氧化过程发挥神经保护作用。
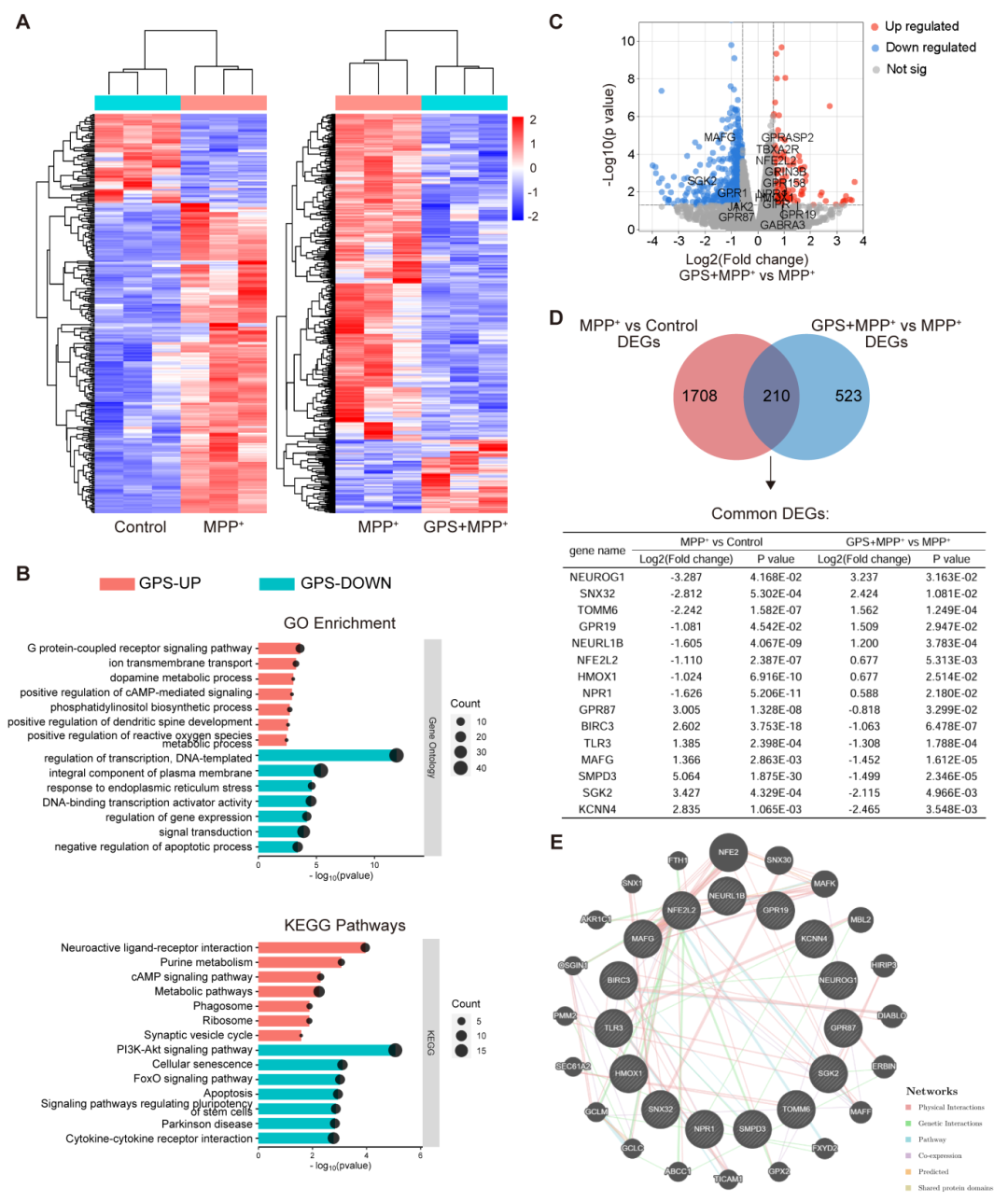
图4 GPS对MPP+处理的SH-SY5Y细胞转录谱的影响
GPS抑制氧化应激和线粒体功能障碍
根据RNA测序结果,研究人员进一步探究了GPS对氧化应激的影响。实验结果显示,GPS处理能够降低帕金森病小鼠STR区域和MPP+处理的SH-SY5Y细胞中的丙二醛(MDA)含量,并恢复超氧化物歧化酶(SOD)活性。DCFH-DA和MitoSOX荧光染色结果显示,GPS剂量依赖性地抑制了MPP+诱导的细胞内和线粒体中活性氧(ROS)的积累。此外,GPS处理还逆转了MPP+诱导的线粒体膜电位的崩溃。这些结果表明GPS显著减轻了MPP+诱导的氧化应激和线粒体功能障碍。
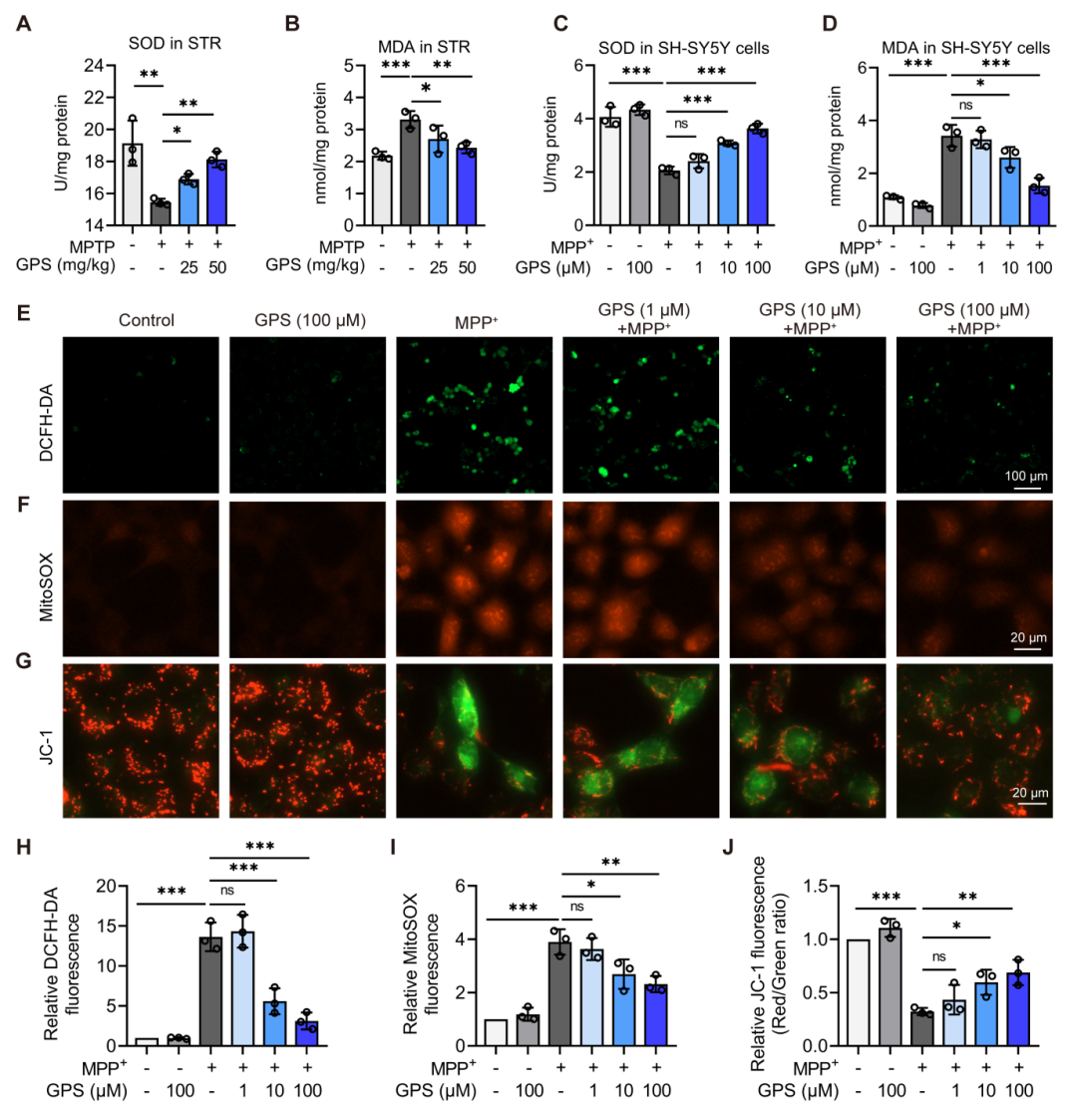
图5 GPS抑制MPP+诱导的氧化应激和线粒体功能障碍
GPS激活Nrf2/HO-1抗氧化通路
研究人员发现GPS能够显著恢复MPP+诱导的Nrf2及其效应分子血红素氧合酶-1(HO-1)蛋白表达的降低。此外,GPS还增加了Nrf2在细胞核中的含量,并提高了核/细胞质Nrf2比率。免疫荧光染色结果也显示,GPS处理显著增加了MPP+处理的SH-SY5Y细胞中Nrf2和HO-1的荧光强度。这些结果表明GPS通过促进Nrf2的核转位激活了Nrf2/HO-1抗氧化通路。
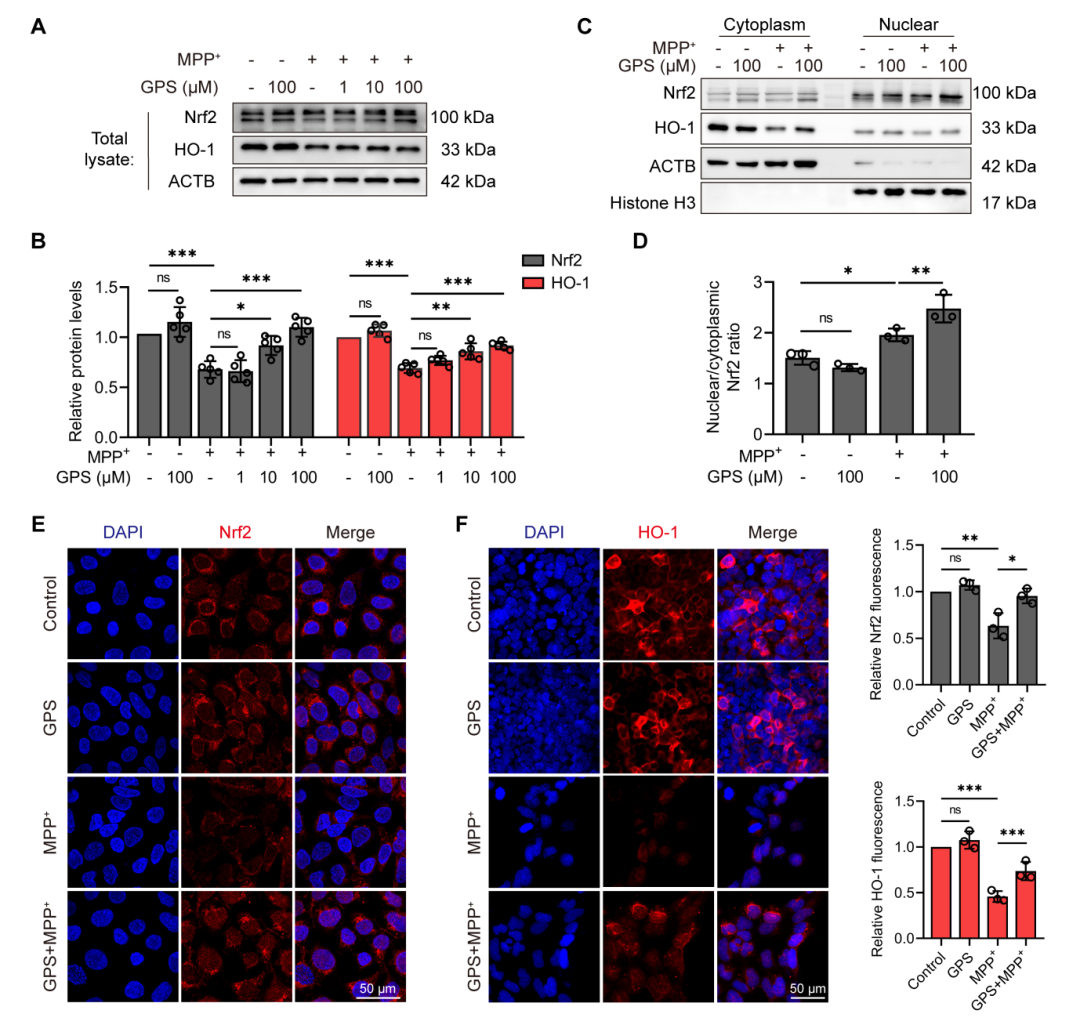
图6 GPS激活MPP+诱导的SH-SY5Y细胞Nrf2/HO-1抗氧化途径
GPS靶向并激活胆汁酸受体TGR5
研究人员通过分子对接、细胞热位移实验(CETSA)、微尺度热泳实验(MST)和cAMP定量分析等方法,证实了GPS能够靶向并激活TGR5。分子对接结果显示,GPS与TGR5的结合能为-7.80±0.87 kcal/mol,且GPS能够稳定地插入TGR5的胆汁酸结合口袋。CETSA实验表明,GPS能够显著提高TGR5的稳定性。MST实验进一步证实了GPS与TGR5的直接结合,其平衡解离常数(Kd)为27.5±13.9 μM。此外,GPS在表达人类TGR5的HEK-293T细胞中能够剂量依赖性地增加cAMP水平,表现出部分激动剂的特性。这些结果表明GPS能够靶向TGR5,并通过激活TGR5发挥神经保护作用。
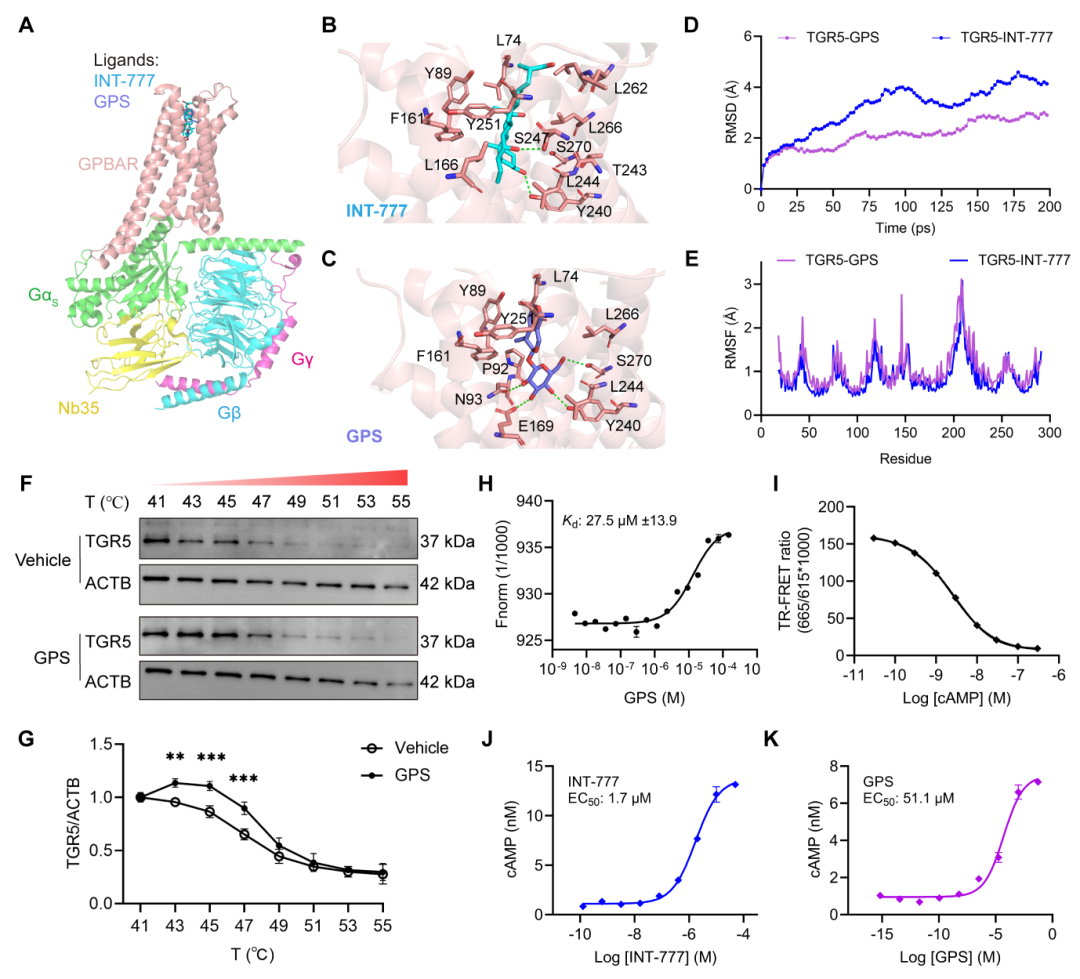
图7 GPS定位并激活胆汁酸受体TGR5
GPS通过TGR5/cAMP/Nrf2通路减轻神经损伤和氧化应激
为了进一步验证GPS是否通过TGR5发挥其神经保护作用,研究人员利用特异性小干扰RNA(siRNA)沉默TGR5,并使用TGR5拮抗剂SBI-115阻断TGR5活性。结果表明,TGR5沉默或抑制显著削弱了GPS对MPP+诱导的神经毒性的保护作用,并阻断了GPS介导的Nrf2抗氧化信号通路的激活。此外,研究人员还评估了GPS对TGR5/PKA/CREB通路的影响。结果表明,GPS能够通过TGR5/cAMP/PKA/CREB通路激活Nrf2抗氧化信号通路,从而减轻帕金森病模型中的神经损伤和氧化应激。
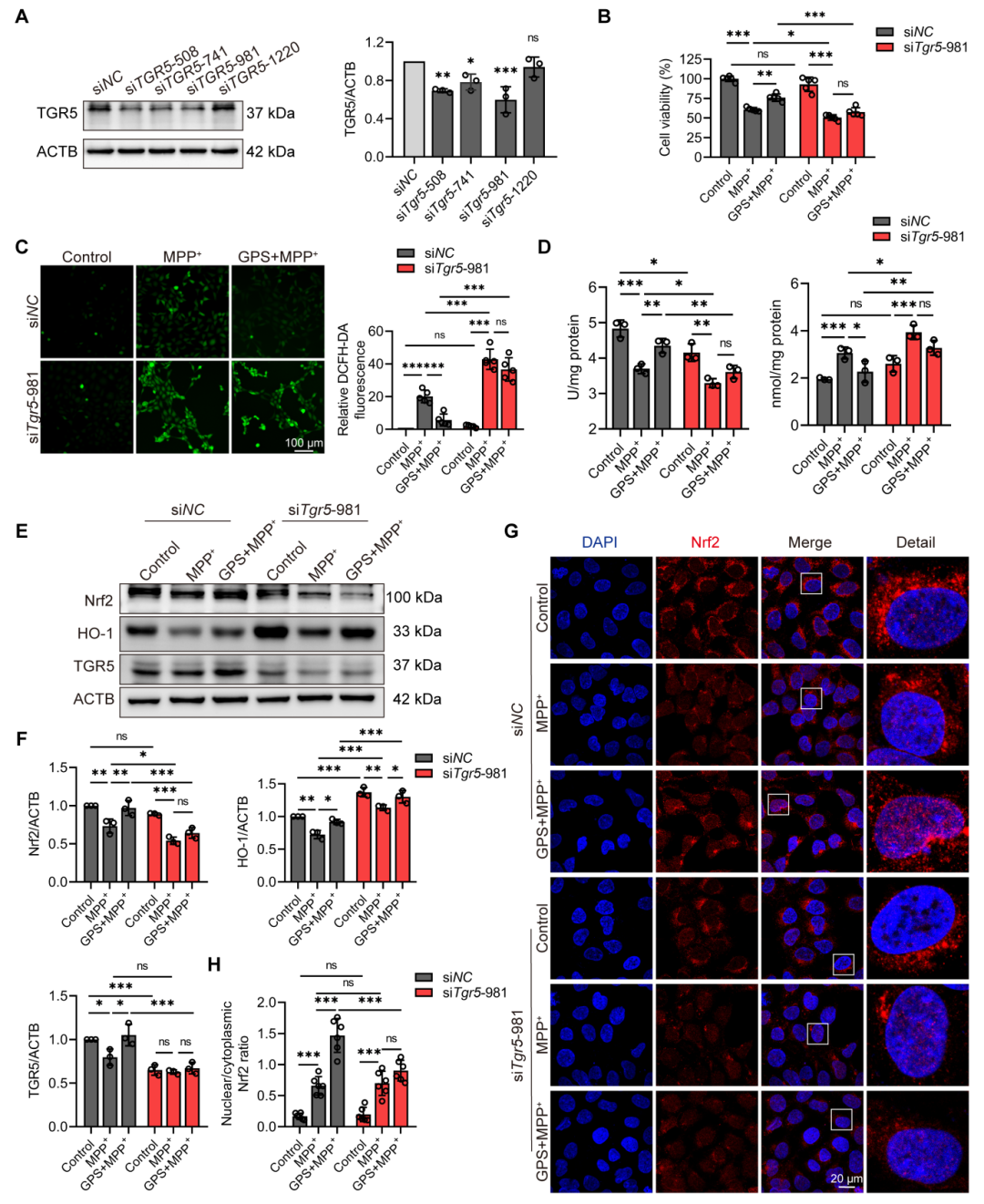
图8 GPS通过激活TGR5改善了592体外神经元损伤和氧化应激
Tgr5基因敲除小鼠实验
为了进一步验证TGR5在GPS神经保护作用中的关键作用,研究人员利用Tgr5基因敲除(KO)小鼠进行了实验。结果表明,TGR5缺失加剧了MPTP诱导的运动功能障碍和多巴胺能神经元损伤。更重要的是,GPS对MPTP诱导的帕金森病小鼠的运动功能障碍和多巴胺能神经元损伤的改善作用在Tgr5-KO小鼠中被显著削弱。这些结果进一步证实了TGR5在GPS神经保护作用中的不可或缺的作用。
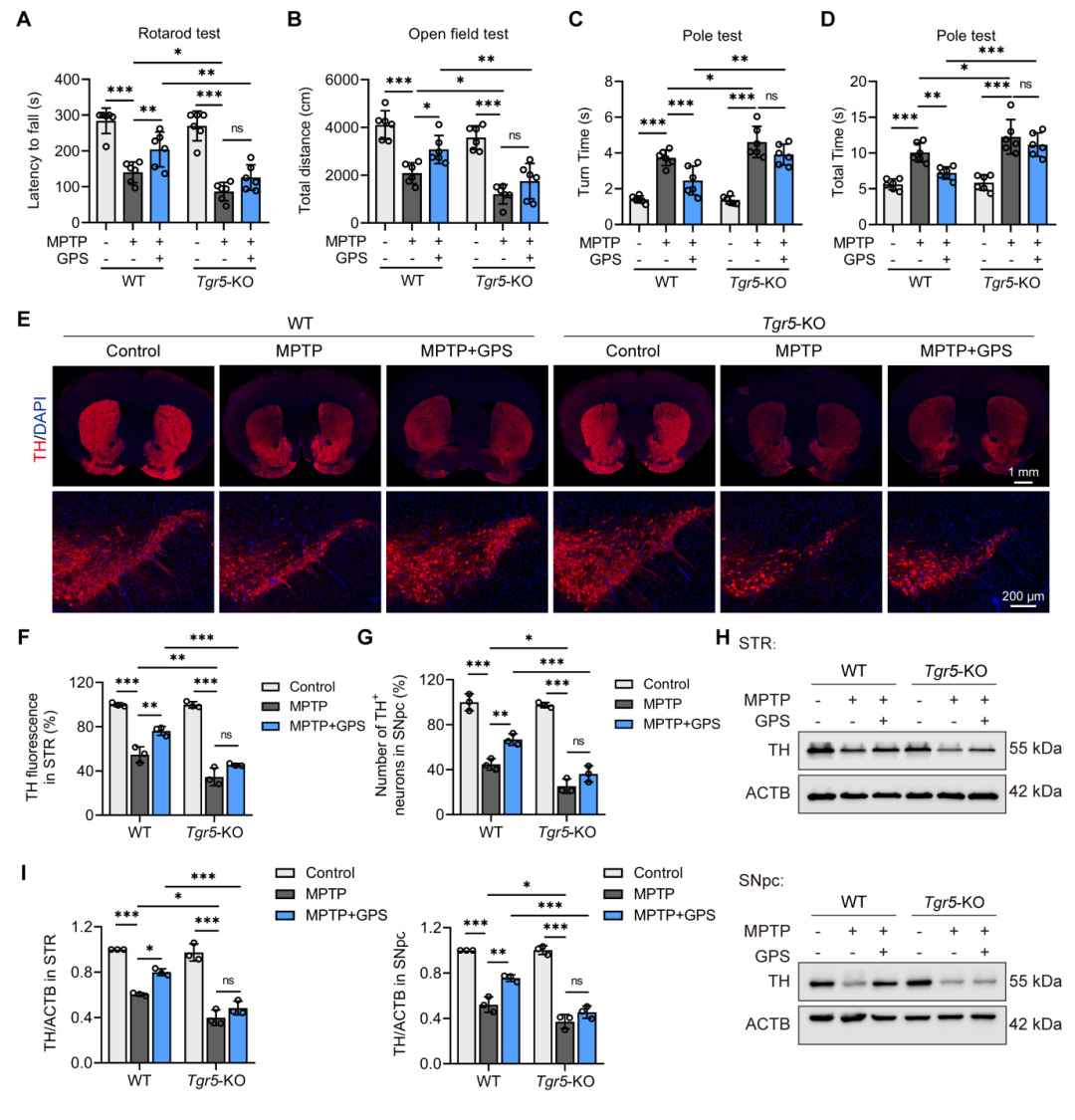
图9 Tgr5基因敲除消除了GPS对MPTP治疗的PD 604小鼠的神经保护作用
小结
本研究首次揭示了GPS通过靶向TGR5激活Nrf2/HO-1抗氧化信号通路,减轻帕金森病模型中的氧化应激和线粒体功能障碍,从而发挥神经保护作用。这一发现不仅为GPS作为帕金森病治疗候选药物提供了有力的证据,还强调了TGR5在帕金森病发病机制中的重要性。此外,该研究还为开发新型TGR5激动剂提供了新的思路,有望为帕金森病的治疗带来新的突破。
参考文献:
Gao Y, Tang X, Yao J, Sun T, Chen Y, Cheng C, Yang J, Wang B, Liu A, Yang L, Zhao M. Targeting the bile acid receptor TGR5 with Gentiopicroside to activate Nrf2 antioxidant signaling and mitigate Parkinson's disease in an MPTP mouse model. J Adv Res. 2025 May 23:S2090-1232(25)00356-X. doi: 10.1016/j.jare.2025.05.039. Epub ahead of print. PMID: 40414345.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)