首页 > 医疗资讯/ 正文

目前关于液体活检(LBx)在预测抗EGFR治疗转移性结直肠癌(mCRC)疗效中的作用,证据有限。CAPRI-2 GOIM 是一项 II 期临床试验,旨在探究在RAS/BRAF 野生型(WT)转移性结直肠癌(mCRC)患者中,通过三线治疗应用液体活检(LBx)全面基因组分析(CGP)指导的、基于西妥昔单抗的治疗方案的效果。LBx-CGP 在基线时以及一线和二线治疗出现疾病进展时进行。若疾病进展时检测到 RAS/BRAF WT 循环肿瘤 DNA,则通过将西妥昔单抗与不同的化疗方案联合,继续进行 EGFR 治疗阻断。主要终点是根据 RECIST 1.1 标准评估的总体缓解率(ORR)。通过 LBx-CGP 检测的肿瘤分子特征与治疗效果进行相关性分析。
该分析纳入了 192 例 RAS/BRAF WT、微卫星稳定型mCRC患者,这些患者接受了 FOLFIRI 方案联合西妥昔单抗治疗,且在基线时进行了LBx-CGP并可评估疗效反应。137 例潜在抗 EGFR 药物耐药基因(RAS/BRAF/EGFR/PIK3CA/MAP2K1/MET/RET/ALK/ROS1/NTRK/NF1/FGFR及 HER2 扩增;“阴性超选择” 病例)WT肿瘤的患者,其ORR为 78.1%,突变患者 ORR 为 54.5%[优势比(OR)2.95,95%CI 1.44-6.10,P=0.001]。“阴性超选择” 患者的中位无进展生存期为 12.35 个月(95%CI 10.58-15.4 个月),而突变患者为 8.68 个月(95%CI 4.87-12.1 个月)[风险比 0.64,95%CI 0.44-0.92,P = 0.017]。致病性变异(PVs)的高癌细胞克隆性与更差的中位无进展生存期(3.55个月,95%CI 2.57个月至未达到)相关,而 PV 低癌细胞克隆性患者的中位无进展生存期为 9.63 个月(95%CI 7.16 个月至未达到,P = 0.21)。一线治疗失败后,约五分之一的患者出现潜在抗 EGFR 药物耐药基因的获得性 PVs,而大多数患者(78.5%)仍维持 RAS/BRAF WT 循环肿瘤 DNA。
这些结果支持LBx-CGP的整合,用于RAS/BRAF WT mCRC抗 EGFR 治疗的疗效实现和使用优化。
-
液体活检CGP可识别抗 EGFR 药物的潜在耐药机制;
-
基于LBx的分子超选择可能有助于预测 FOLFIRI 联合西妥昔单抗的疗效;
-
低克隆性的 “阳性超选择” 患者可能对抗 EGFR 治疗有响应;
-
一线抗 EGFR 治疗进展后,78.5% 的患者仍维持 RAS/BRAF WT状态。
研究背景
mCRC患者一线治疗的选择基于临床病理特征和肿瘤分子特征。对于RAS/BRAF WT、微卫星稳定型(MSS)的mCRC患者,抗EGFR治疗(使用抗EGFR单克隆抗体西妥昔单抗或帕尼单抗)联合FOLFIRI或FOLFOX化疗是标准治疗,也是左侧原发肿瘤的优选方案,尽管大多数患者在初始治疗应答后会出现癌细胞耐药并进展。
越来越多的证据表明,对肿瘤组织进行更深入的分子评估(尤其是通过全基因组分析,CGP)可能改善患者筛选和抗EGFR治疗的疗效。然而,单一肿瘤组织活检的固有局限性在于无法捕捉转移性癌症的空间和时间异质性。基于液体活检(LBx)的CGP可通过循环肿瘤DNA(ctDNA)反映不同转移部位的基因组变异,并在疾病进展过程中通过重复检测提供动态分子特征,从而克服这些局限性。PARADIGM试验的探索性生物标志物分析表明,基线LBx可能有助于更好地识别从抗EGFR治疗中获益的mCRC患者。但目前仍需更多证据,且LBx在临床实践中的应用仍有限(主要在肿瘤组织不可获取时使用)。
LBx的ctDNA分析的另一潜在优势是能够从疾病进展过程中可能出现的癌细胞克隆角度更好地定义肿瘤分子异质性。此外,大多数癌细胞中的分子致病性变异(PV,克隆性突变)而非部分癌细胞中的变异(亚克隆突变)可能影响分子靶向治疗的疗效。然而,目前关于癌细胞克隆性对mCRC患者抗EGFR药物疗效潜在影响的数据有限。
CAPRI-2 GOIM是一项前瞻性单臂II期试验,旨在评估RAS/BRAF WT MSS mCRC患者中三线治疗方案的疗效。每线治疗基线时均通过LBx-CGP指导治疗。研究者最近在CAPRI-2 GOIM试验中发现,一线治疗前使用相同验证的下一代测序平台进行的LBx-CGP与肿瘤组织CGP具有高度一致性。本文报告了基线LBx-CGP在识别肿瘤分子异质性和癌细胞克隆性中的价值,这些特征可能更好地预测FOLFIRI联合西妥昔单抗的疗效。此外,疾病进展(PD)时的LBx-CGP可识别无抗EGFR药物耐药突变的患者,这些患者可能在一线进展后继续从EGFR治疗阻断中获益。
研究方法
入组患者为 RAS/BRAF WT、MSS的 mCRC 患者,接受 FOLFIRI(氟尿嘧啶 + 亚叶酸钙 + 伊立替康)联合西妥昔单抗作为一线治疗。治疗前血浆样本采用 FoundationOne Liquid(F1L)CDx 检测进行分析。在一线和二线治疗出现疾病进展(PD)后,通过 F1L CDx LBx结果指导后续治疗选择:若ctDNA为 RAS/BRAF WT,二线治疗采用 FOLFOX(氟尿嘧啶 + 亚叶酸钙 + 奥沙利铂)联合西妥昔单抗,三线治疗采用伊立替康联合西妥昔单抗;若 ctDNA 检测为 RAS/BRAF V600E 突变(MUT),则二线 / 三线治疗分别采用 FOLFOX 联合贝伐珠单抗或研究者选择的方案(三氟尿苷/替吡嘧啶或瑞戈非尼)。
研究结果
研究患者群体:
2021年7月至2023年11月期间,共筛查240例患者,排除48例,192例接受FOLFIRI联合西妥昔单抗治疗的患者纳入试验,这些患者基线时通过F1L CDx进行了LBx-CGP检测且存在可测量病灶(详细见图1)。患者特征见表1。
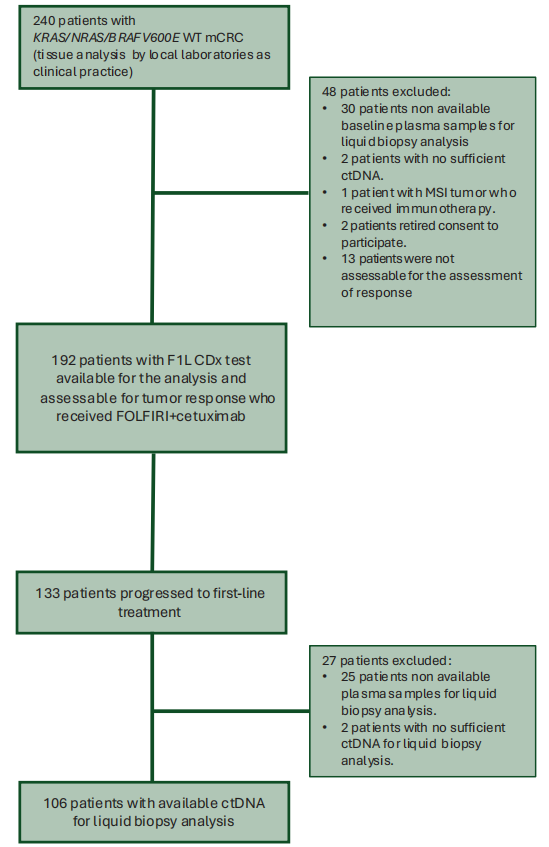

图1
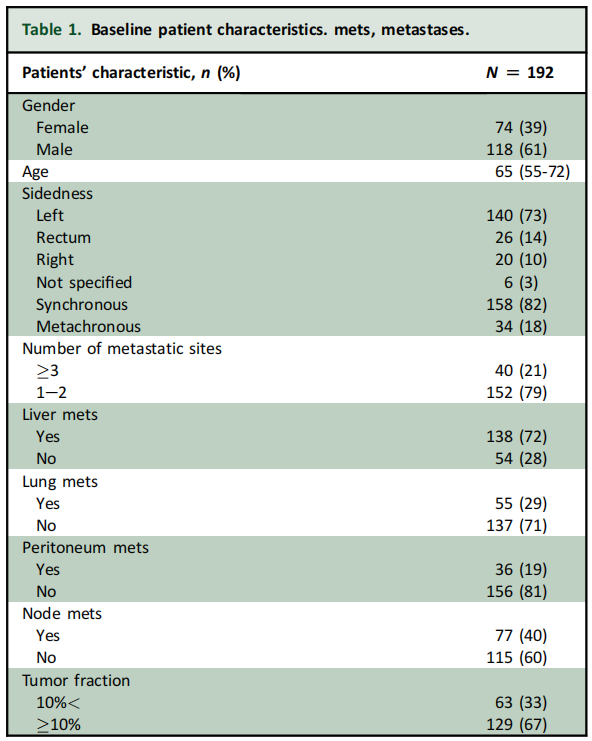
表1
基于基线分子基因组分析FOLFIRI联合西妥昔单抗的疗效:
在192例经当地实验室评估为RAS/BRAF WT的研究队列中,ORR为71.3%(95% CI 64.3%-77.5%)。192例患者中13例(6.8%)最佳疗效为PD(图2A)。因此,疾病控制率(DCR,疾病稳定+缓解OR)为93.2%(95% CI 88.4%-96.1%)。中位随访20.1个月(IQR 15.4-27.7个月),记录到133例PD事件,中位无进展生存期(mPFS)为11.2个月(95% CI 9.67-13.5个月)。包括已知预后因素的亚组分析显示,不同亚组的PFS无差异。
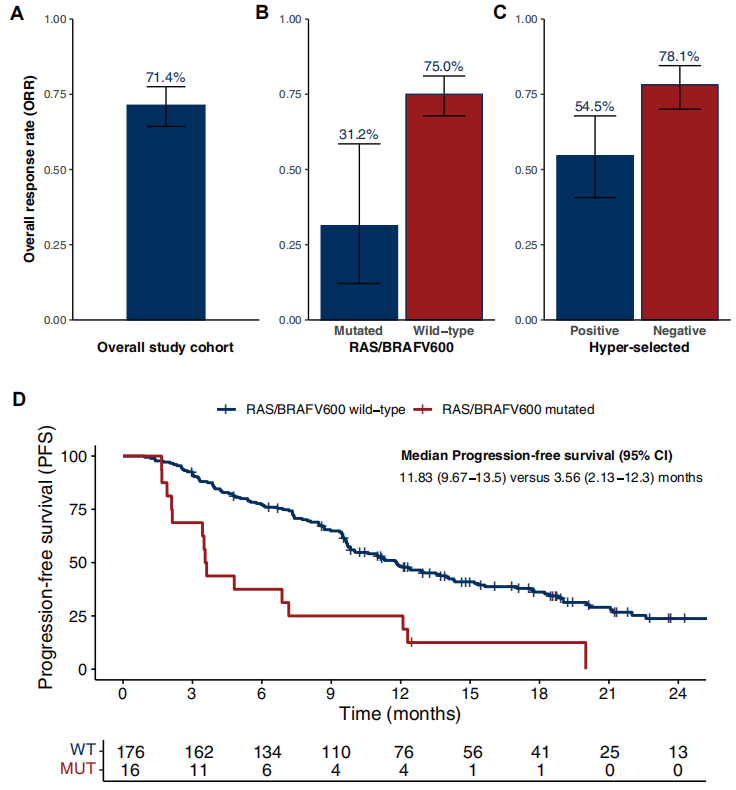
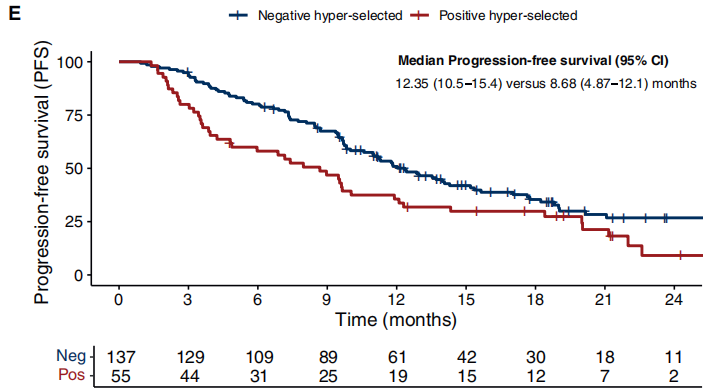

图2
基线F1L CDx分析有助于更好地确定这些肿瘤的分子特征,并更精确地识别FOLFIRI联合西妥昔单抗的疗效。事实上,在RAS/BRAF WT ctDNA患者中,ORR为75.0%(95% CI 67.8%-81.0%),而RAS/BRAF V600E MUT ctDNA患者为31.2%(95% CI 12.1%-58.5%)[OR 6.52,95% CI 1.96-25.31,P=0.0006](图1B);DCR分别为95.5%(95% CI 90.9%-97.8%)和68.8%(95% CI 41.4%-87.7%)(P<0.0001)。无任何潜在抗EGFR药物耐药突变的ctDNA患者(“阴性超选择”病例:RAS/BRAF/EGFR/PIK3CA/MAP2K1/MET/RET/ALK/ROS1/NTRK/NF1/FGFR WT且HER2未扩增)ORR为78.1%(95% CI 70.0%-84.5%),而存在任一上述突变的患者为54.5%(95% CI 40.6%-67.8%)(OR 2.95,95% CI 1.44-6.10,P=0.001)(图2C),DCR分别为96.4%(95% CI 91.2%-98.6%)和85.5%(95% CI 72.7%-93.0%)(P=0.01)。
值得注意的是,若从分析中排除16例RAS/BRAF V600E MUT ctDNA病例,其他抗EGFR药物耐药基因的WT和MUT ctDNA之间仍存在数值差异(ORR:78.1%,95% CI 70.1%-84.5% vs. 64.1%,95% CI 47.2%-78.3%,OR 1.99,95% CI 0.85-4.57,P=0.093)。此外,RAS/BRAF WT ctDNA患者的mPFS为11.83个月(95% CI 9.67-13.5个月),而RAS/BRAF V600E MUT ctDNA患者为3.56个月(95% CI 2.13-12.3个月)(HR 0.32,95% CI 0.19-0.56,P<0.0001)(图2D)。
阴性超选择WT ctDNA患者的mPFS为12.35个月(95% CI 10.58-15.4个月),而至少存在一个突变的患者为8.68个月(95% CI 4.87-12.1个月)(HR 0.64,95% CI 0.44-0.92,P=0.017)(图2E)。排除RAS/BRAF V600E MUT ctDNA患者后,WT ctDNA患者的mPFS数值上也优于突变ctDNA患者(12.35个月,95% CI 10.58-15.4个月 vs. 9.61个月,95% CI 7.97-20个月,HR 0.8,95% CI 0.53-1.23,P=0.32)。
分子致病性变异的癌细胞克隆性对FOLFIRI联合西妥昔单抗疗效的影响:
基线时,F1L CDx检测到64个抗EGFR药物耐药PVs(图3A)。192例肿瘤中9例(4.7%)存在多种抗EGFR药物耐药PVs共发,其中6例同时携带RAS和BRAF PV。
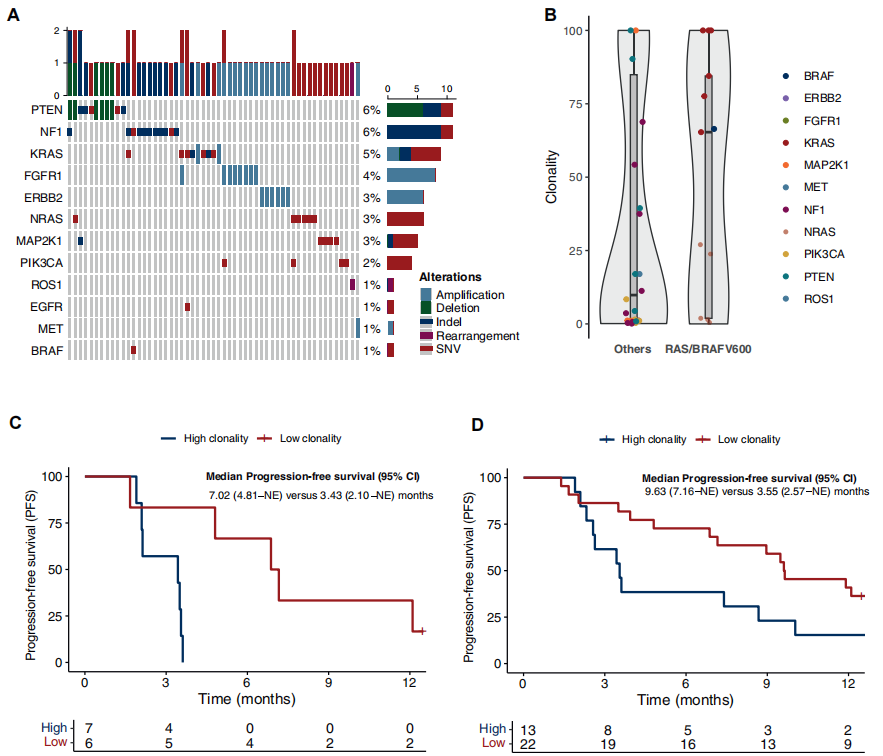

图3
16例RAS/BRAF V600E MUT ctDNA病例的中位VAF和中位癌细胞克隆性分别为1.5%(IQR 0.28%-24.0%)和65.3%(IQR 1.9%-84.4%)。值得注意的是,55例存在任一扩展抗EGFR药物耐药基因变异的病例中,中位VAF和中位克隆性分别为1.6%(IQR 0.1%-20.5%)和17.0%(95% CI 1.1%-87.3%)(图3B)。
对FOLFIRI联合西妥昔单抗最佳疗效为PD的患者,RAS/BRAF V600E PVs的中位克隆性更高(92.2%,95% CI 63.8%-100.0% vs. 27.0%,95% CI 1.5%-66.4%,P=0.14),其他抗EGFR药物耐药PVs的中位克隆性也更高(61.4%,IQR 41.6%-92.2% vs. 17.0%,IQR 1.1%-77.5%,P=0.10)。此外,15例癌细胞亚克隆PVs(克隆性<10%)患者中仅1例(6.7%)对FOLFIRI联合西妥昔单抗的最佳疗效为PD,而40例癌细胞克隆性PVs患者中有7例(17.5%)出现PD(OR 0.34,95% CI 0.01-3.09,P=0.4231)。
在RAS/BRAF V600E MUT肿瘤患者中,观察到癌细胞克隆性突变增加与mPFS恶化直接相关(克隆性每增加10%的HR为1.20,95% CI 0.99-1.46)。通过最小P值法,确定RAS/BRAF V600E MUT病例定义高或低癌细胞克隆性的最佳临界值为27%(bootstrap 95% CI 13.7%-32.1%)。在这方面,高克隆性RAS/BRAF V600E MUT肿瘤患者的mPFS显著差于低克隆性RAS/BRAF V600E MUT肿瘤患者(3.43个月,95% CI 2.10个月-未达到 vs. 7.02个月,95% CI 4.81个月-未达到,HR 0.08,95% CI 0.01-0.76,P=0.02)(图3C)。
类似地,对于存在其他抗EGFR药物耐药基因PVs的患者群体,PVs的癌细胞克隆性增加与mPFS恶化趋势相关(克隆性每增加10%的HR为1.04,95% CI 0.94-1.14,P=0.451)。使用最小P值法确定克隆性最佳临界值为39.4%(bootstrap 95%CI 9.7%-34.2%)。事实上,高克隆性突变患者的mPFS更差(3.55个月,95% CI 2.57个月-未达到),而低克隆性突变患者为9.63个月(95% CI 7.16个月-未达到,P=0.21)(图3D)。
疾病进展时抗EGFR药物耐药分子致病性变异的出现与清除:
FOLFIRI联合西妥昔单抗一线治疗进展后,133例患者中108例(81.2%)在治疗后血浆样本中进行了LBx-CGP检测。其中,2例F1L CDx检测无信息(失败率1.8%)。其余106例中,检测到157个PVs。KRAS(n=52)、EGFR胞外结构域(ECD)(n=30)、NRAS(n=16)和BRAF(n=15)是最常见的突变基因(图4A)。考虑同一肿瘤中的多种共发基因突变,KRAS(n=24,22.6%)、BRAF nonV600(n=12,11.3%)、NF1(n=9,8.4%)和EGFR ECD(n=8,7.5%)是进展时检测到的最常见PVs。在RAS/BRAF V600E MUT组中,KRAS是进展时最常见的获得性变异(n=16,17.7%),而NRAS和BRAF V600E分别在4例(4.4%)和2例(2.2%)患者中发现。值得注意的是,这些变异均出现在同时获得 KRAS 变异的病例中。
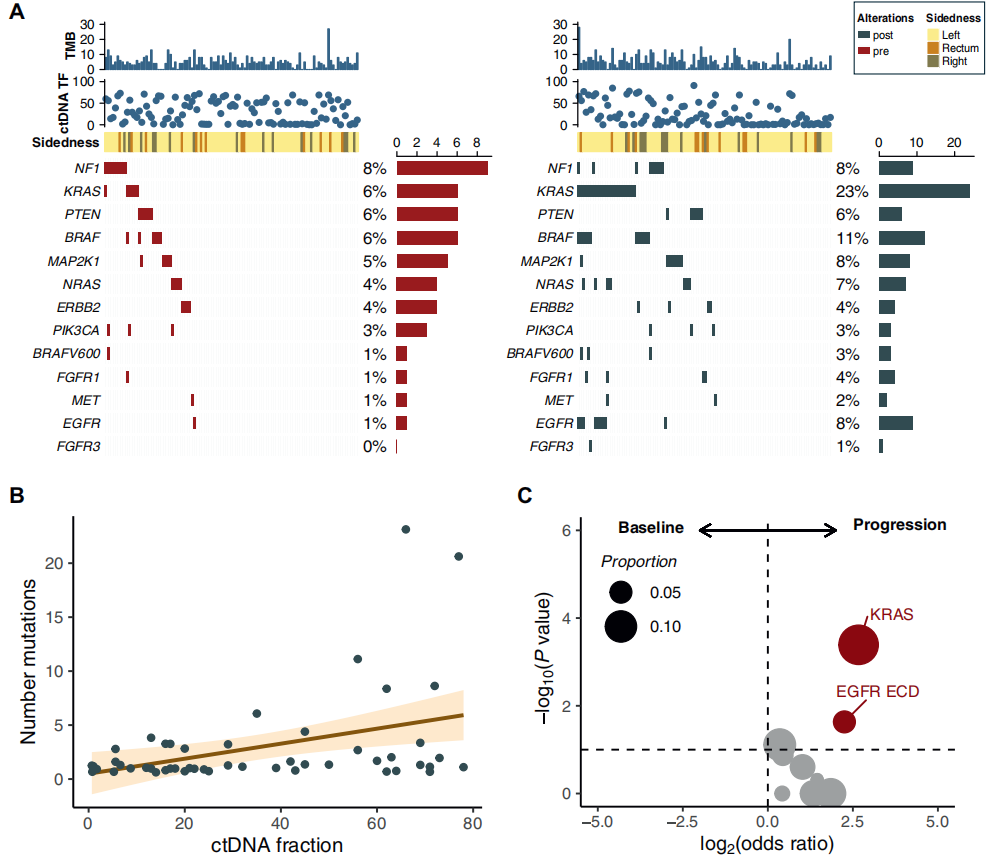
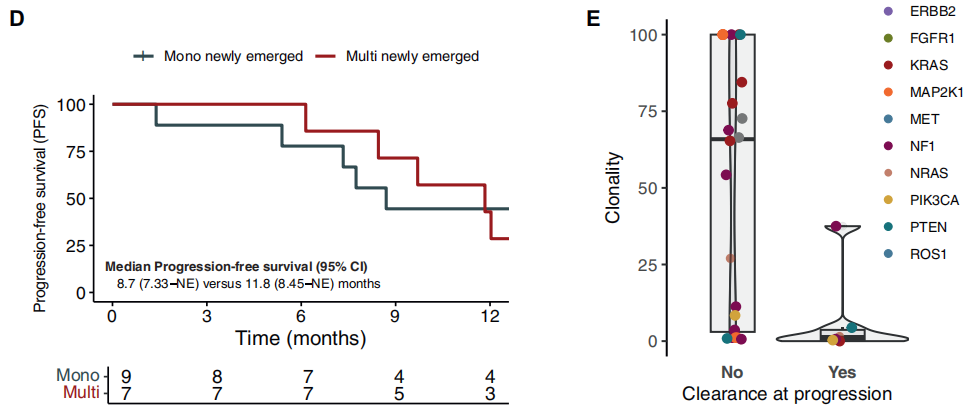


图4
ctDNA肿瘤分数(TF)与抗EGFR药物耐药PVs数量呈正相关(Kendall’s tau 0.25,P=0.02)(图4B)。存在抗EGFR药物耐药PVs的病例中检测到的ctDNA TF高于无耐药PVs的病例(29.0%,IQR 13.0%-62.5% vs. 8.65%,IQR 2.93%-17.0%,P<0.0001),且存在多个获得性PVs的患者高于单个获得性PVs的患者(50.5%,IQR 19.2%-63.7% vs. 21.0%,IQR 10.3%-44.0%,P=0.03)。
最后,若评估每位患者抗EGFR药物耐药基因的出现情况,KRAS(进展前n=6,进展后n=22,P<0.001,q=0.002)和EGFR ECD(进展前n=1,进展后n=9,P=0.01,q=0.22)是进展后样本中最常见的获得性突变(图4C)。
研究者进一步确定了进展时单个与多个获得性基因突变的影响。进展时出现多个获得性RAS/BRAF V600E PVs的病例存在mPFS更好的趋势(获得性单个PV:8.7个月,95% CI 7.33个月-未达到 vs. 获得性共发PVs:11.84个月,95% CI 8.45个月-未达到,P=0.15)(图4D)。这些发现可能是由于多个RAS/BRAF V600E PVs病例的癌细胞克隆性低于单个RAS/BRAF V600E突变病例[获得性共发PVs的克隆性:0.5%(IQR 0.3%-1.4%) vs. 获得性单个PV的克隆性:3.9%(IQR 1.7%-47.7%) vs. 基线单个PV的克隆性:63.4%(IQR 35.5%-70.5%),P<0.0001]。
先前假设化疗可能清除基线RAS/BRAF变异,从而潜在恢复抗EGFR药物敏感性。对于13例基线存在RAS/BRAF V600E PVs的患者,11例(84.6%)在PD后LBx-CGP检测中仍维持RAS/BRAF V600E MUT ctDNA。在基线LBx-CGP检测中,1例基线存在亚克隆KRAS G12R MUT ctDNA的患者和1例存在KRAS拷贝数增加的患者,在进展后检测中未检测到这些PVs。此外,基线LBx-CGP检测中存在抗EGFR药物耐药基因突变的患者中,8例在PD时出现PV清除。值得注意的是,这些患者的癌细胞克隆性突变低于PD时LBx-CGP检测中仍维持PVs的患者(0.65%,IQR 0.3%-4.4% vs. 65.3%,IQR 6.0%-100%,P=0.018)(图4E)。
最后,在PD时进行F1L CDx检测的106例患者中,93例基线时为RAS/BRAF WT ctDNA。值得注意的是,73/93例(78.5%)在PD时也检测到RAS/BRAF WT ctDNA,表明大多数FOLFIRI联合西妥昔单抗进展后的患者可能对抗EGFR治疗敏感,因此可在二线治疗中采用替代化疗(FOLFOX)联合西妥昔单抗。这种方法目前正在CAPRI-2 GOIM试验中作为二线治疗进行研究。
讨 论
mCRC是一种异质性疾病,其特征是存在大量基因变异。这些变异可能是存在于大多数癌细胞中的克隆性PVs(通常为“驱动”突变)和/或存在于部分癌细胞中的亚克隆性PVs(通常为“乘客”突变)。此外,癌细胞可能在抗癌治疗的选择性压力下积累额外突变。这种肿瘤分子的时空异质性可能削弱包括抗 EGFR 药物在内的靶向治疗的疗效。基于LBx的CGP可通过识别携带导致治疗耐药和疾病进展的 PVs 癌细胞克隆,描绘复杂的肿瘤分子图景。事实上,LBx-CGP 的固有优势在于能够评估更广泛的 PVs,估计ctDNA的TF,并通过特定基因变异评估癌细胞的克隆性。
CAPRI-2 GOIM 试验中 FOLFIRI 联合西妥昔单抗一线治疗的结果支持了基线 LBx-CGP 在提高 RAS/BRAF WT MSS mCRC 患者抗癌治疗疗效中的临床价值。与既往回顾性研究结果一致,前瞻性 CAPRI-2 GOIM 试验表明,一线治疗前对潜在参与 EGFR 药物耐药的基因进行扩展分子筛选,可识别出从 EGFR 治疗阻断中高度获益的患者。这些经过适当筛选的 mCRC 患者的 ORR、DCR 和 mPFS 分别为 78.1%、96.4% 和 12.35 个月。
值得注意的是,研究者观察到并非所有突变对 FOLFIRI 联合西妥昔单抗的疗效影响相同。RAS/BRAF V600E MUT ctDNA 亚组患者预后较差,mPFS<4 个月,ORR 约 30%,低于 mCRC 中单纯 FOLFIRI 治疗的预期值。这可能是由于大多数 RAS/BRAF V600E MUT ctDNA 患者具有更高的克隆性,这可能与更具侵袭性的疾病相关。因此,对于这些预后较差的患者,使用选择性 KRAS 或 BRAF V600E 抑制剂(如有)联合化疗或三联化疗可能是一种潜在的治疗选择。
此外,研究者观察到,在排除 RAS/BRAF V600E PVs 患者后,存在其他可能导致抗 EGFR 药物耐药基因变异的患者 ORR 为 64%,mPFS 为 9 个月。这些发现支持潜在抗 EGFR 药物耐药突变的作用存在层级差异的概念。在这方面,CAPRI-2 GOIM 试验表明,RAS/BRAF 以外基因的低癌细胞克隆性 PVs 患者可能仍能从抗 EGFR 治疗阻断中获益。综上所述,这些发现支持抗 EGFR 药物耐药突变的癌细胞克隆性是这些患者适当分子靶向治疗选择中最相关的临床决定因素这一概念。
当然,需要注意的是,约三分之一的患者 TF<10%,这可能会在尝试评估克隆性时产生影响。此外,样本量有限可能在计算最佳临界值时构成潜在偏倚。
尽管如此,在 Nakamura 及其同事的分析中,克隆性临界值 40% 可预测靶向治疗的活性。在这种间接比较的明显局限性下,本研究数据表明,39% 的临界值可能有助于预测对抗 EGFR 治疗无反应。当然,这一假设需要谨慎考虑,仍需进一步验证。
新出现的证据表明,一线治疗失败后,有一部分 mCRC 患者维持 RAS/BRAF WT ctDNA,因此可能在进展后仍从 EGFR 抑制中获益。PD时的 LBx-CGP 可能有助于识别这一人群。研究者在此报告,FOLFIRI 联合西妥昔单抗治疗失败时,仅少数患者出现抗 EGFR 药物耐药突变。事实上,约五分之四的 PD 患者检测到 RAS/BRAF WT ctDNA。这些数据与 Parseghian 及其同事的回顾性探索性分析一致,该研究指出,仅 9% 的化疗联合抗 EGFR 治疗进展患者会出现 RAS/BRAF 变异。根据 CAPRI-2 GOIM 试验设计,这些患者将化疗方案从 FOLFIRI 切换为 FOLFOX,并在二线治疗中继续接受西妥昔单抗。该部分研究目前正在进行中。此外,研究者计划在 LBx 分子超选择肿瘤中开展 III 期随机研究(CAPRI-III GOIM-TTD),以验证这一治疗策略。
最后,研究者研究了作为 PD 时获得性突变出现的抗 EGFR 药物耐药 PVs 的癌细胞克隆性。存在多个但亚克隆性 PVs 的患者与出现单个克隆性 PVs 的患者相比,PFS 更长。因此,获得性亚克隆性 PVs 可能是“乘客”突变,短暂性突变对抗 EGFR 药物耐药的影响可能较小。此外,这些基因变异可能在使用非交叉耐药化疗且不使用抗 EGFR 抑制剂的二线治疗期间被清除。因此,在这些患者的二线或后续治疗进展时可能检测到 RAS/BRAF WT ctDNA,他们可能从后续抗 EGFR 药物再挑战治疗中获益。
本研究存在一些局限性。事实上,尽管具有生物学和临床依据,结果的内部有效性以及与既往报告的一致性,但前瞻性单臂 II 期试验的样本量相对较小,且癌细胞克隆性对治疗效果分析的探索性性质,使得这些发现尽管具有临床相关性,但仍属于假设生成。在这方面,需要进一步研究以确定预测抗 EGFR 治疗疗效的最佳克隆性阈值,并在实践中推广 LBx-CGP 的应用。
CAPRI-2 GOIM 试验为 LBx-CGP 在 RAS/BRAF WT mCRC 管理中的作用提供了新证据。LBx 捕捉 mCRC 的异质性分子特征,并能够预测 FOLFIRI 联合西妥昔单抗的治疗疗效。此外,纵向 ctDNA 评估可指导个体化治疗选择,包括识别在后续治疗中切换化疗方案同时维持抗 EGFR 药物治疗可能获益的患者。
参考文献:
Ciardiello D, Boscolo Bielo L, Napolitano S, et al. Comprehensive genomic profiling by liquid biopsy portrays metastatic colorectal cancer mutational landscape to predict antitumor efficacy of FOLFIRI plus cetuximab in the CAPRI-2 GOIM trial. ESMO Open. 2025;10(4):104511. doi:10.1016/j.esmoop.2025.104511

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)