首页 > 医疗资讯/ 正文
心力衰竭的发病率和死亡率持续上升,给公共卫生系统带来了沉重负担。可变剪接作为一种关键的基因调控机制,是导致转录组与蛋白质组高度复杂性的主要因素。已有研究表明,可变剪接广泛参与心血管疾病的发生发展,然而,其在心力衰竭中的具体调控机制仍不完全明确。
2025年6月6日,哈尔滨医科大学寒地心血管病全国重点实验室杨宝峰院士/梁海海教授团队在国际顶级心血管期刊European Heart Journal杂志(影响因子38.1)发表了题为“Deficiency of the RNA-binding protein RBMS1 improves myocardial fibrosis and heart failure”的研究论文。该研究发现,RBMS1在心力衰竭进展中发挥关键作用,RBMS1通过调控LMO7基因第20号外显子的可变剪接,进而激活AP-1/TGF-β信号通路。临床用药去甲替林和特异性反义寡核苷酸靶向干预RBMS1可有效改善心力衰竭小鼠心脏功能,提示RBMS1可能成为治疗心力衰竭的新靶点。

首先,为了探索RBM家族成员在心力衰竭中的作用,该团队检测了心力衰竭小鼠的基因表达谱,发现RBMS1、RBMS3和RBM3在HF、MI和TAC小鼠模型中表达上调。随后进一步证实了RBMS1在心肌梗死小鼠心脏中表达变化最为显著,并富集于心脏成纤维细胞的细胞核内。
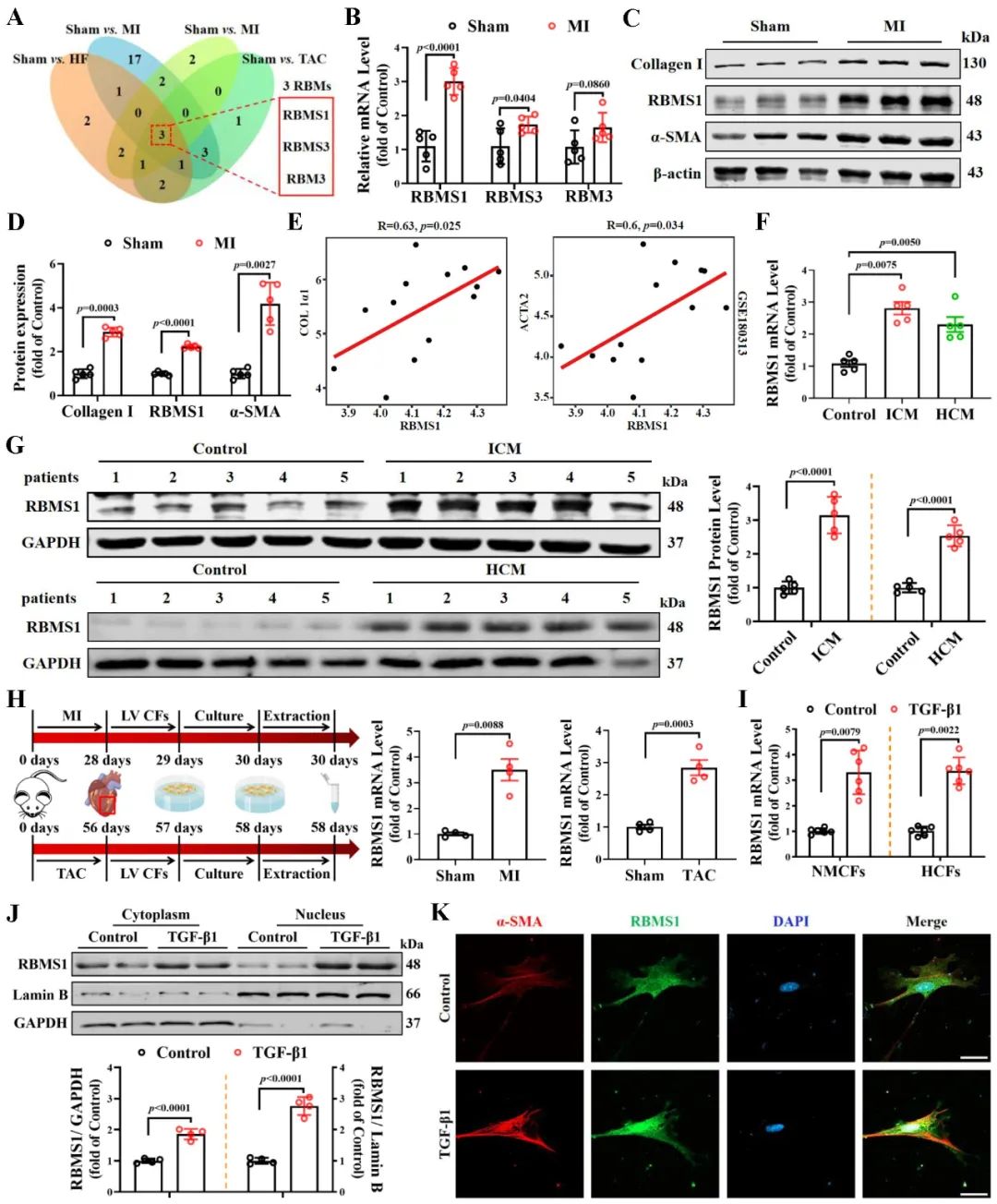
图1. RBMS1在心力衰竭患者和小鼠心脏中的表达增加
为了探究RBMS1在体内的功能,研究者在成纤维细胞中特异性敲除RBMS1,发现敲除RBMS1可显著改善心肌梗死小鼠的心脏功能。此外,敲除RBMS1可减少心肌梗死小鼠心脏中的胶原沉积、心肌结构紊乱和纤维化相关基因的表达。

图2. 成纤维细胞特异性敲除RBMS1改善HF小鼠的心肌纤维化和心脏功能
随后,研究团队通过RNA-seq进一步发现,RBMS1调控大量基因发生可变剪接并参与TGF-β1信号通路。琼脂糖凝胶实验证实了过表达RBMS1促进LMO7的20号外显子发生跳跃并生成LMO7-Δe20剪接异构体。RNA pull-down、RIP和MiniGene实验证实了RBMS1蛋白与LMO7 mRNA的结合及可变剪接位点。
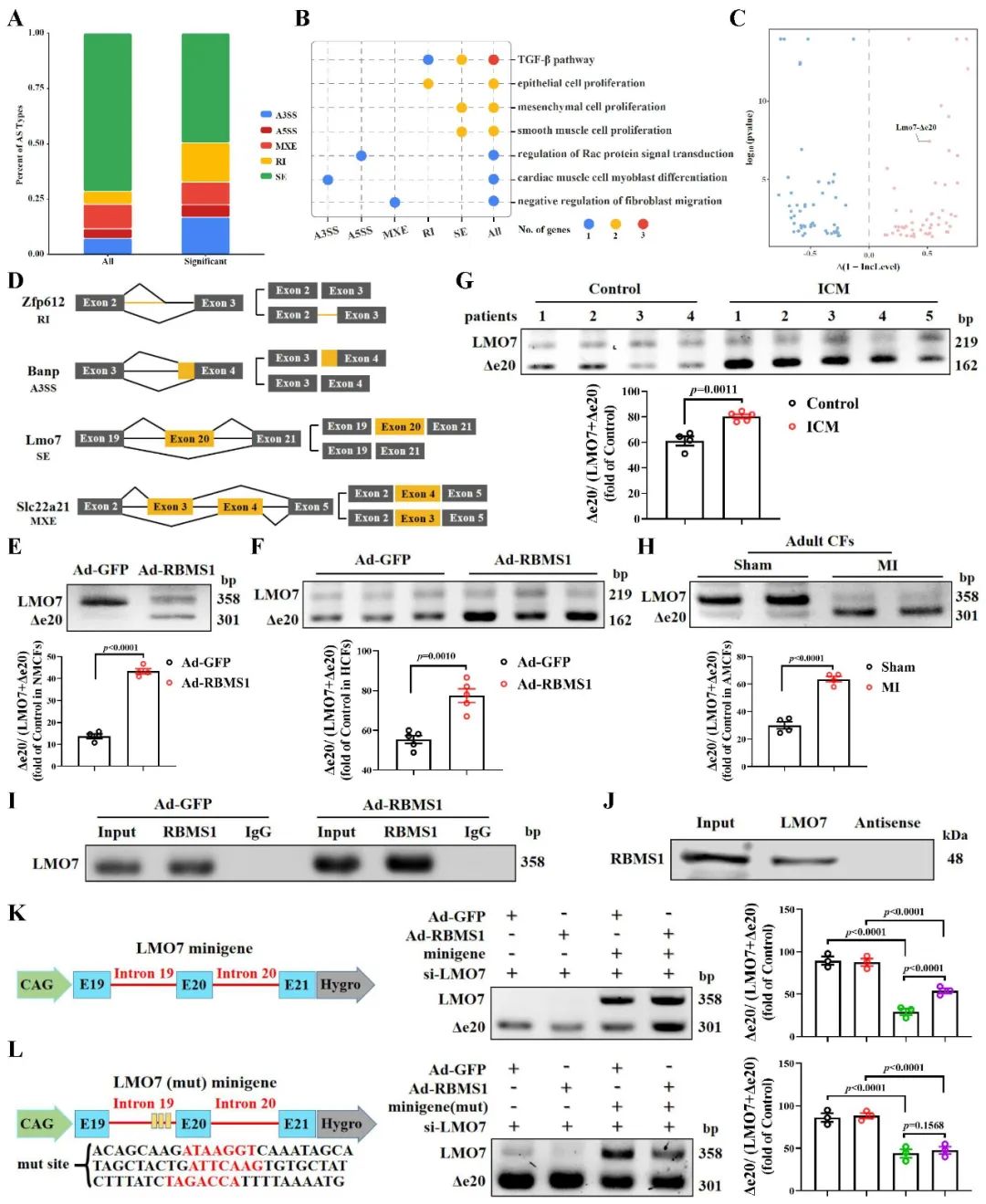
图3. RBMS1调控LMO7基因第20号外显子的可变剪接
之后为了评估LMO7-Δe20在心脏纤维化中的作用,研究者构建了过表达LMO7-Δe20的转基因小鼠,发现过表达LMO7-Δe20的小鼠出现心功能障碍、心脏肥厚、胶原沉积和心肌结构紊乱等症状,而TGF-β1抑制剂SB431542能显著改善过表达LMO7-Δe20引起的以上症状。
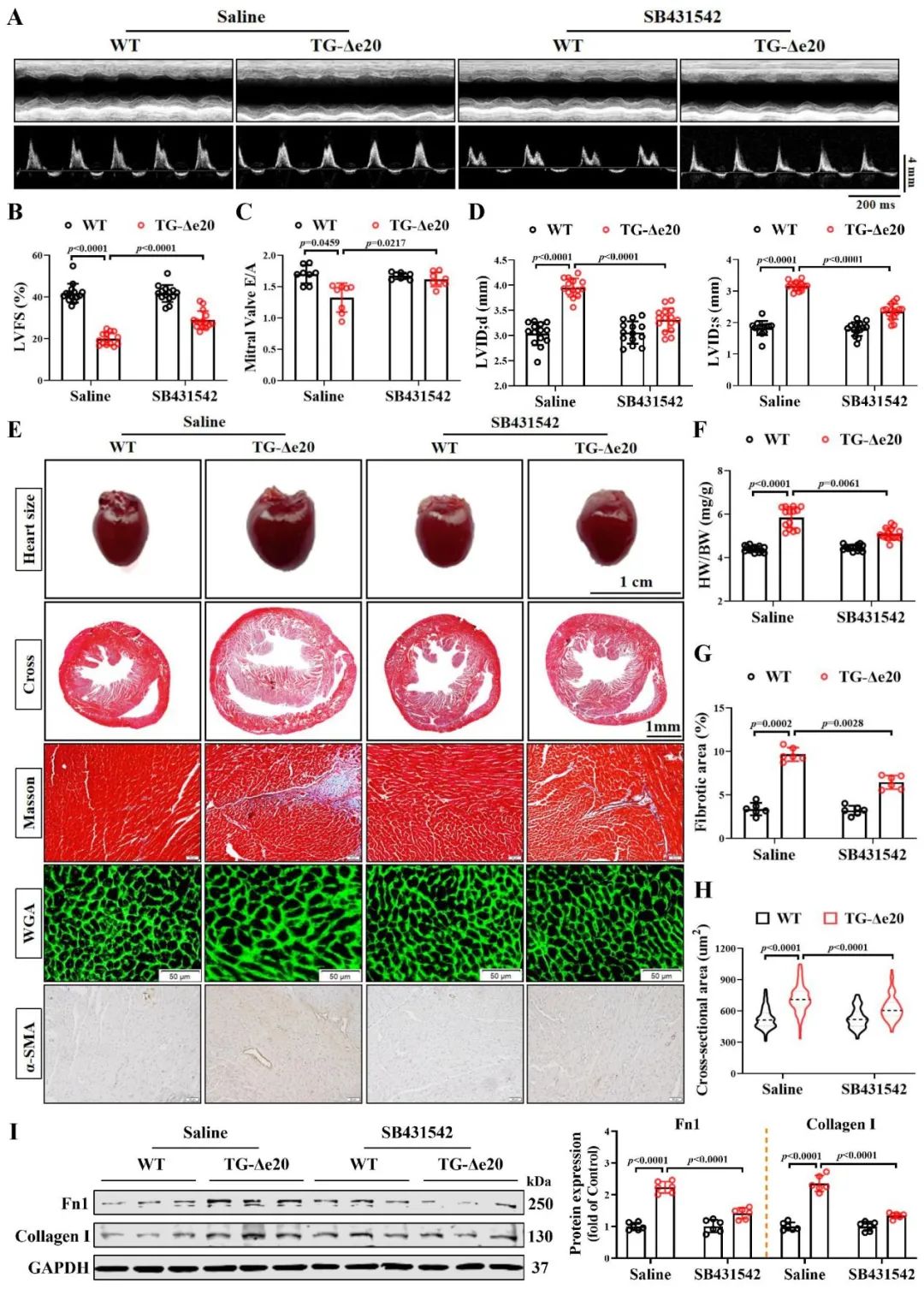
图4. LMO7-Δe20通过TGF-β1途径导致心肌纤维化和心力衰竭
最后,研究者发现靶向抑制RBMS1的表达(临床用药去甲替林和反义寡核苷酸)能显著改善心肌梗死小鼠的心脏功能并抑制心肌纤维化的进展。

图5. 去甲替林可改善心力衰竭小鼠心脏功能
综上,该团队证实了RBMS1在心力衰竭进展中的关键作用,RBMS1通过调控LMO7第20号外显子发生可变剪接并生成LMO7-Δe20剪接异构体,进而激活AP-1/TGF-β1信号通路。此外,临床用药去甲替林和反义寡核苷酸靶向干预RBMS1可减轻心力衰竭小鼠的心肌纤维化并改善心脏功能。该研究首次揭示了RBMS1在心力衰竭中的调控作用,为开发新型抗心力衰竭药物提供了理论依据和潜在靶点,具有重要的科学价值和临床意义。
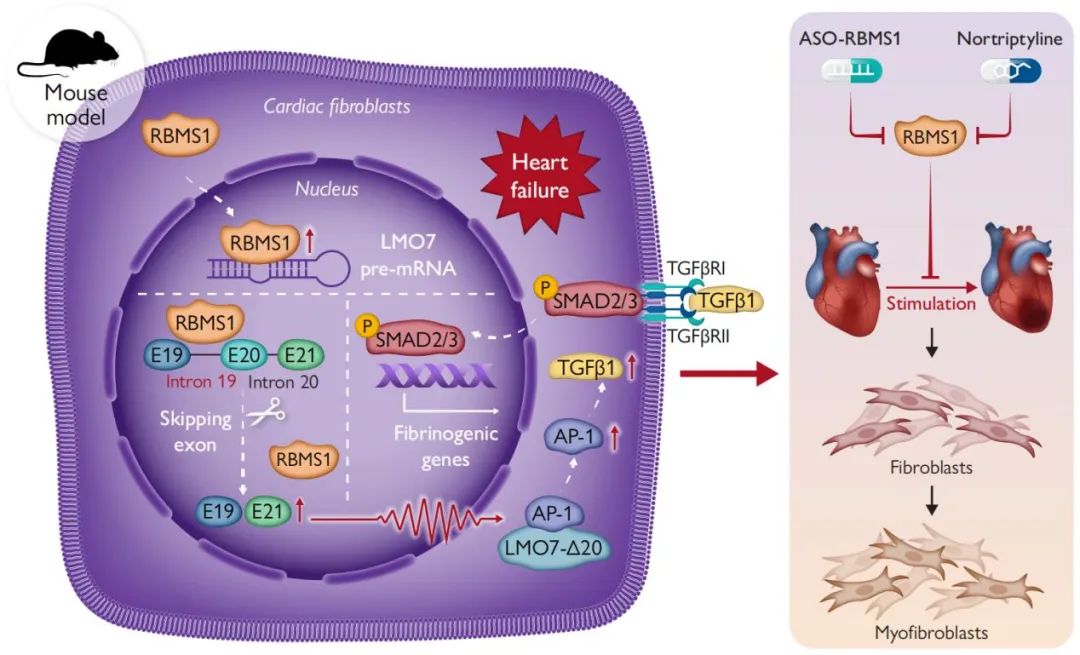
图6. RBMS1通过可变剪接和TGF-β信号通路参与心力衰竭
哈尔滨医科大学李亮亮博士后、国佳钰博士、冯佳悦硕士、李天宇副研究员为该论文的共同第一作者。哈尔滨医科大学的杨宝峰/梁海海教授和上海工程技术大学的单宏丽教授为该论文的共同通讯作者。该工作还得到了武汉大学中南医院刘金平和王斌教授的大力支持。
论文链接:
https://doi.org/10.1093/eurheartj/ehaf370
- 上一篇: 四川大学华西医院肝纤维检测仪等采购公告
- 下一篇: 云南省中医医院2肌电诱发电位仪医疗设备招标公告
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)