首页 > 医疗资讯/ 正文
在儿童常见的恶性脑瘤中,髓母细胞瘤(MB)是最具代表性的一种。近年来,随着分子分型的发展,研究者逐渐认识到MB并非单一疾病,而是包含了多个生物学特征差异巨大的亚型。其中,一种名为“SHH-3型”的MB正成为科学界关注的焦点。最新研究揭示,该亚型的髓母细胞瘤背后隐藏着一个基因角色:ELP1,扮演着重要角色。
近日,由 Shiekh Tanveer Ahmad 和 Paul A. Northcott 团队发表于 Cancer Cell 题为 Genetic modeling of ELP1-associated Sonichedgehog medulloblastoma identifies MDM2 as a selective therapeutic target 的文章,研究揭开ELP1基因如何影响儿童脑瘤的发生与发展,以及它如何为精准治疗打开新局面。

首先,研究团队使用UK Biobank大队列估算携带不同基因突变(ELP1、TP53、PTCH1、SUFU)的人群,发现SHH-MB中ELP1突变者的风险 ≈ TP53 ≈ PTCH1,均为0.3–0.5%,但SUFU突变风险显著更高(6.8%),主要集中在婴儿期;ELP1突变者的肿瘤高发期集中在10岁前。说明ELP1虽然不是最高危基因,但其风险期和SHH-MB发病高峰重合,因此很关键。研究人员建立了ELP1杂合缺失小鼠,发现其小脑中颗粒神经元祖细胞(GNPs)分化延迟,很多细胞停留在“幼年”状态(高表达Ki67),无法成熟为神经元(NEUN降低)。这意味着这些细胞长期保持增殖潜力,更容易“变坏”形成肿瘤。
进一步研究发现,ELP1缺失的小鼠GNPs在DNA复制阶段(S期)进程加快,同时激活了复制起始相关蛋白MCM2与CDK2激酶活性。这种"复制太快"会导致DNA损伤积累,像是拼图拼得太急容易出错一样。在这些ELP1缺失细胞中,研究者观察到了更多的DNA损伤(γ-H2AX增加)、修复活跃(RAD51增加)、但经典修复通路(53BP1)反而减少。p53通路表现出功能下降:关键下游蛋白p21减少、MDM2增加,使得细胞对DNA损伤的反应变得迟钝,这是一种癌变前状态。
通过将带有ELP1缺失和Ptch1突变的GNPs移植到小鼠脑中,研究者成功建立了类似人类SHH-3型MB的肿瘤模型。对比组中,ELP1缺失肿瘤中p53、p21、CC3等蛋白均下调,肿瘤突变负荷明显上升,提示p53信号压制可能是核心特征之一。如果同时敲除Elp1和Ptch1会发生什么?答案是:只有在p53缺失背景下,双敲才能诱导肿瘤发生。这说明在正常情况下,完整的p53通路可以抵御ELP1缺失带来的危险。最后,研究者在PDX模型中用MDM2抑制剂idasanutlin治疗发现,仅在ELP1突变模型中能显著诱导细胞死亡并延长小鼠生存期。TP53突变或ELP1正常的模型均不响应,体现出极高的治疗选择性。
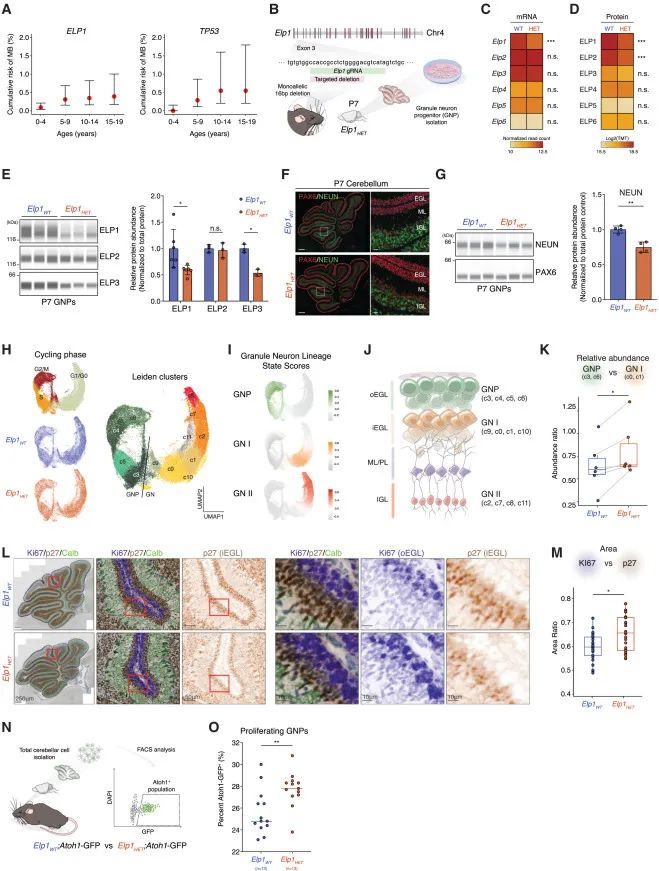
ELP1杂合缺失扰乱颗粒神经元祖细胞(GNP)分化,使其滞留在增殖状态,增加潜在的转化风险。
这项研究不仅揭示了ELP1是如何推动SHH-MB的发生,也提供了一个针对性治疗方案——MDM2抑制剂可能成为新一代精准治疗药物。未来的方向包括:进行临床前大规模验证,明确疗效与副作用;设计联合用药策略,优化治疗窗口;推动ELP1/MDM2检测进入临床实践,提升儿童脑瘤诊疗水平。
总之, ELP1就像肿瘤发生链条上的第一块多米诺骨牌,它的缺失启动了一连串“复制失控—修复失灵—免疫逃逸”的恶性循环。而MDM2抑制剂就像精准打击的钥匙,有望打破这一链条。通过每一张图的科学解码,我们正一步步靠近儿童脑瘤的精准治疗新时代。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)