首页 > 医疗资讯/ 正文
HRMM的定义
尽管多发性骨髓瘤(MM)患者的生存率取得了显著改善,但预后仍然存在异质性,相当一部分患者疗效不佳。重要的是,既往的传统预后因素是基于接受旧疗法治疗的患者数据而产生,已无法在新型三药或四药疗法的当代准确捕捉预后。因此,风险分层需要在常规实践和临床试验中,根据现有的和正在研究的治疗选择进行完善。在目前的常规实践中,高危多发性骨髓瘤(HRMM)的识别是基于修订版国际分期系统,该系统通过结合广泛可用的血清生物标志物和通过荧光原位杂交(FISH)评估的染色体异常来对患者进行分层。
近年来积累了很多关于额外临床、生物学以及分子/基因组学预后因素的证据,同时也有新的多发性骨髓瘤风险分层工具和共识报告。为了回顾新的分子/基因组学证据以及以往预后标志物在基于三药或四药疗法的MM治疗中的作用,国际骨髓瘤学会(IMS)与国际骨髓瘤工作组(IMWG)召集了一个专家小组,审阅了一系列关于特定风险因素预后影响的相关数据的报告(发表或未发表),其主要目的是重新审视HRMM的定义,并基于分子/基因组学检测的新证据、更新的临床数据以及当代风险分层概念,制定一个实用且以数据为基础的共识定义。
专家小组的方法基于这样的理解:修订后的HRMM定义不仅应纳入高危特征的数据,包括染色体异常(CAs)和基因组/遗传改变,还应为标志物定义特定检测方法的截断值。此外,确定一个高危亚组(约占MM患者20%且预后最差)是HRMM的合理基准。
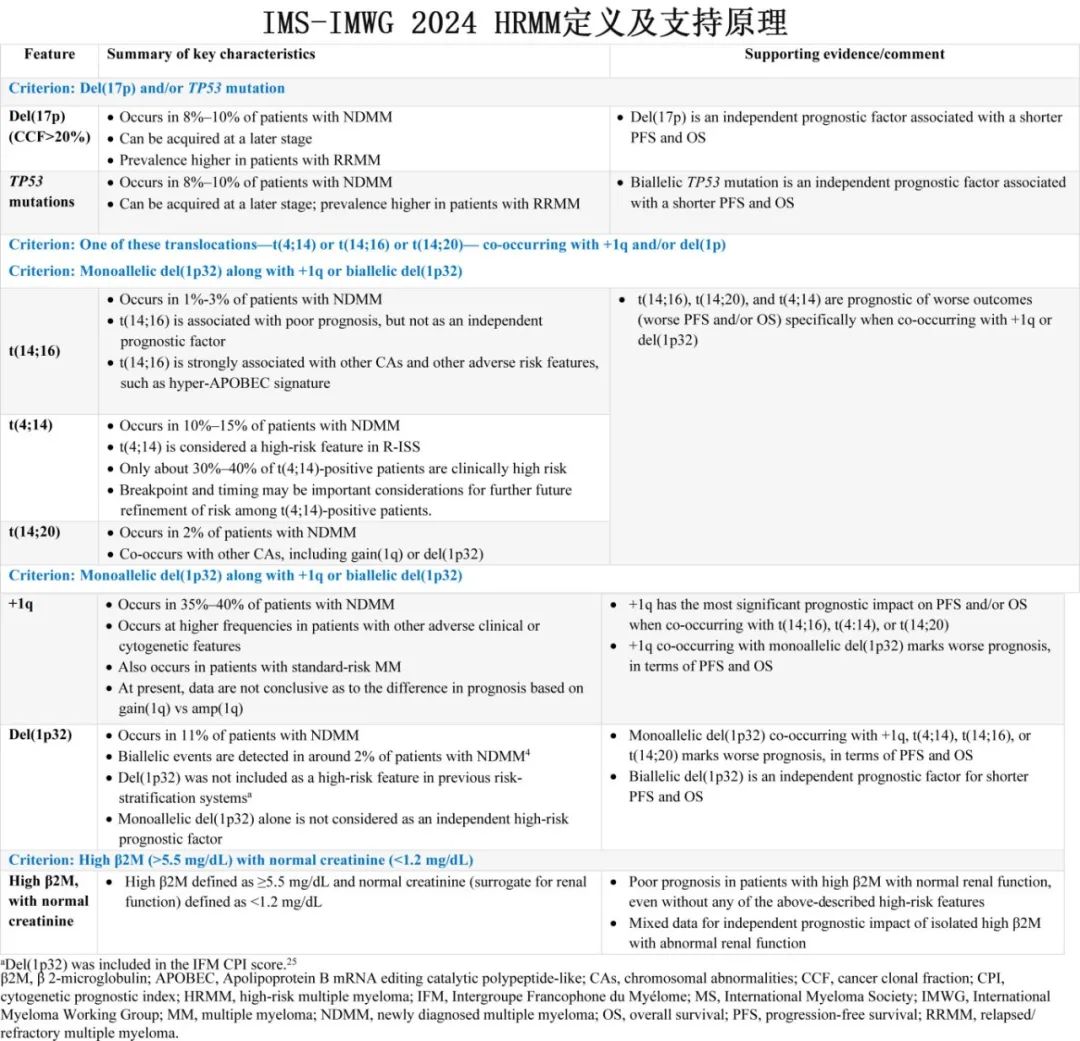
最终,该专家小组提出了以下的HRMM共识基因分期(Consensus Genomic Staging,CGS),其依据是存在以下至少一种异常情况:(1)del(17p),克隆比例阈值为>20%,和/或TP53突变;(2)IgH易位,包括t(4;14)、t(14;16)或t(14;20),合并1q+和/或del(1p32);(3)单等位基因del(1p32)合并1q+或双等位基因del(1p32);(4)β2微球蛋白≥5.5 mg/L且肌酐水平正常(<1.2 mg/dL)。相关数据近日发表于《Journal of Clinical Oncology》,文末作者还总结了当前和潜在的高危因素,或许值得大家关注。

支持HRMM修订的基因分期共识的基本原理和证据
IMS/IMWG基因组学研讨会的全面讨论结果按会议主题整理如下。在当代背景下,与预后不良相关的染色体异常(CAs)包括:17号染色体短臂缺失(del[17p]);易位t(4;14)、t(14;16)和t(14;20);以及1号染色体异常,如1q获得(1q 3个拷贝)或扩增(1q >3个拷贝),统称为1q+,以及1号染色体短臂缺失(del[1p32])。
del(17p)、del(17p)克隆比例和TP53突变
del(17p)在诊断时存在于高达10%的患者中,并在复发/难治性多发性骨髓瘤(RRMM)患者中富集(报告比例为10%-60%),是当前多发性骨髓瘤分期标准(包括R-ISS)中公认的一个高危特征。诊断时存在del(17p)的患者通常表现为晚期疾病和具有侵袭性的临床特征,其中位总生存期(OS)为3年。复发时的del(17p)也与预后不良相关;例如,在del(17p) MM患者中,报告的中位无进展生存期(PFS)为5.4个月,中位OS为18.1个月。
除了del(17p)本身之外,携带del(17p)的骨髓瘤细胞相对比例也会影响预后。定义del(17p)阳性的截断值存在异质性,范围从>60%阳性细胞(治疗克隆比例[cancer clonal fraction ,CCF]>0.6)到某些III期研究中的低至1%,此外在数据集内和数据集之间使用的治疗方案也存在差异,导致了对del(17p)阳性患者报告的预后的不一致。此外,抑癌基因TP53编码在17p的最小缺失区域,TP53失调涉及许多治疗(包括MM)的发病机制。尽管del(17p)也会导致TP53丢失,但只有三分之一的单等位基因del(17p)病例在剩余的TP53等位基因中携带突变,并且有证据表明,双等位基因TP53改变——主要是通过del(17p)导致的丢失以及剩余等位基因的伴随突变——会导致更差的预后。
专家组回顾了del(17p)和TP53突变的预后作用数据,这些数据既作为独立因素,也作为共存特征,并考虑了del(17p)作为高危特征的iFISH阈值的实用性,以及克隆性对基于del(17p)和/或TP53失调的风险预后建立标准化方法的影响。
尽管存在del(17p)且伴有共存的高危染色体异常(HRCAs)的患者预后最差,但越来越多的证据证实了孤立性del(17p)对OS和PFS的独立预后影响。专家小组回顾了FORTE试验(通过FISH检测del(17p)状态)和CoMMpass数据集(通过测序检测del(17p)状态和TP53突变)的亚组分析数据,以及GEM(下文讨论)进行的分析,这些分析均证实孤立性del(17p)的预后影响。同样,在IFM/DFCI2009队列(通过FISH和测序检测del(17p)状态,通过测序检测TP53突变)中,del(17p)对PFS和OS也具有预后价值。基于del(17p)作为不良预后独立预测因子的大量证据,共识建议将del(17p)纳入HRMM的特征。
在GEM进行的分析中,对于del(17p) CCF阈值≥20%的患者,OS和PFS存在显著差异(图1A、1B)。对HARMONY数据的分析也显示,当比较del(17p) CCF>50%和20%-50%的患者时,OS和PFS存在显著差异,但与CCF<20%的患者相比则无差异。在不同研究中,del(17p) CCF≥40%至>60%显示出最强的预测结局的区分能力。然而,对于CCF≥20%的患者,del(17p)的预后影响仍然很高。CCF阈值为10%时的中位PFS和中位OS长于CCF阈值≥20%的患者;CCF≥10%的患者的中位OS为54.2个月,而CCF为20%-59%的患者为37.0-38.1个月。因此,共识建议将del(17p)的阈值定为CCF≥20%(通过分析CD138阳性/纯化细胞),并纳入修订后的HRMM定义。
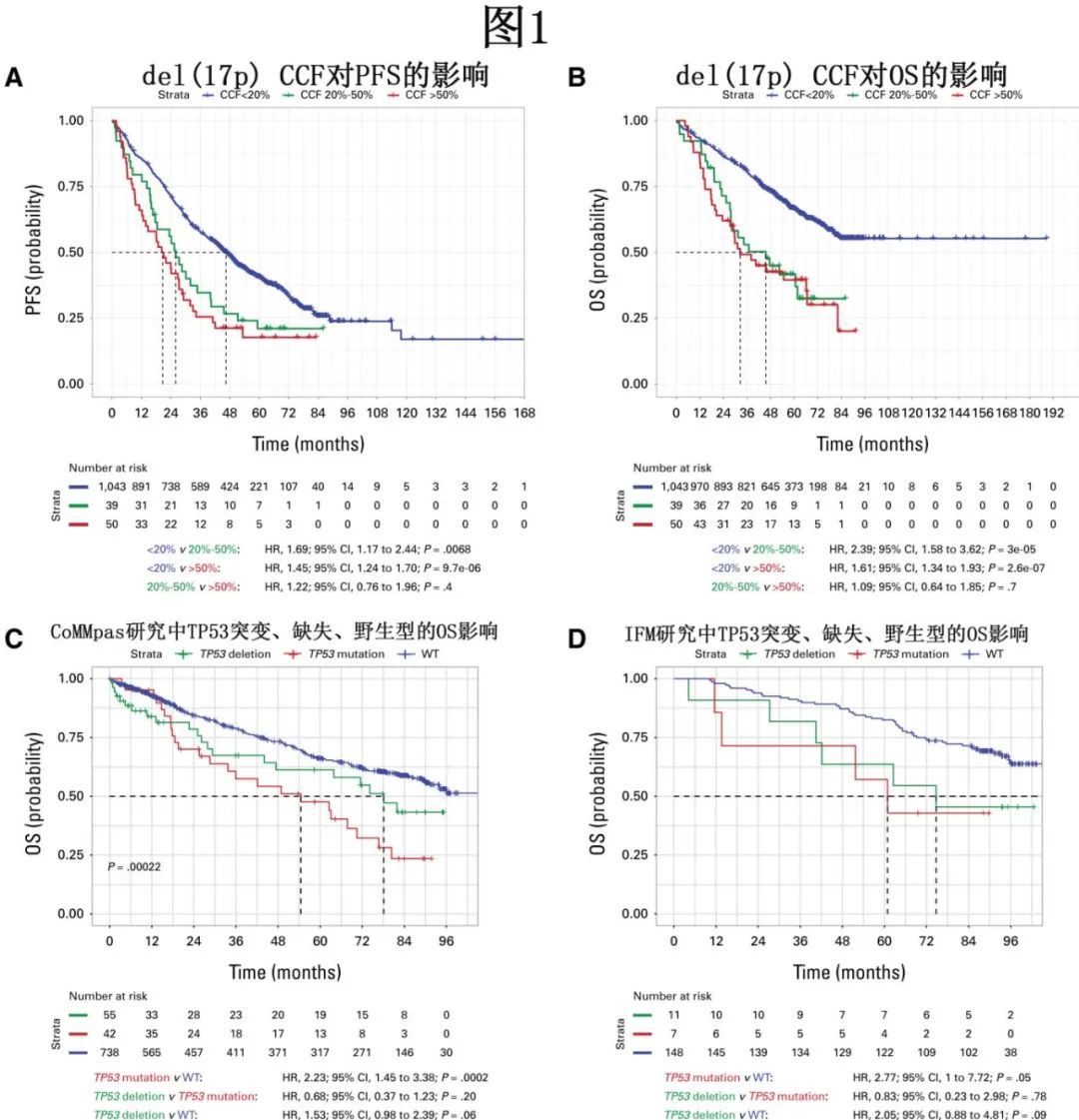
存在del(17p)且剩余等位基因通过丢失或突变发生TP53失调的患者预后最差。例如,在Myeloma XI研究中,TP53两个等位基因的失活均独立地与PFS(风险比[HR],3.1;P=0.00047)和OS(HR,5.01;P=3.9-6)较差相关。TP53失活(通过突变和/或缺失)的预后影响也在CoMMpass队列和IFM数据集的数据中得到证实(图1C、1D)。虽然TP53突变的患者预后较差,但存在缺失(例如del(17p))的患者在OS(图1C、1D)和PFS方面也预后较差,与其他报告一致。
鉴于TP53突变对PFS和OS的预后影响,专家小组建议,通过基于NGS的方法在CD138阳性/纯化细胞上检测到的TP53突变,应纳入HRMM定义。
易位t(14;16)、t(14;20)和t(4;14)
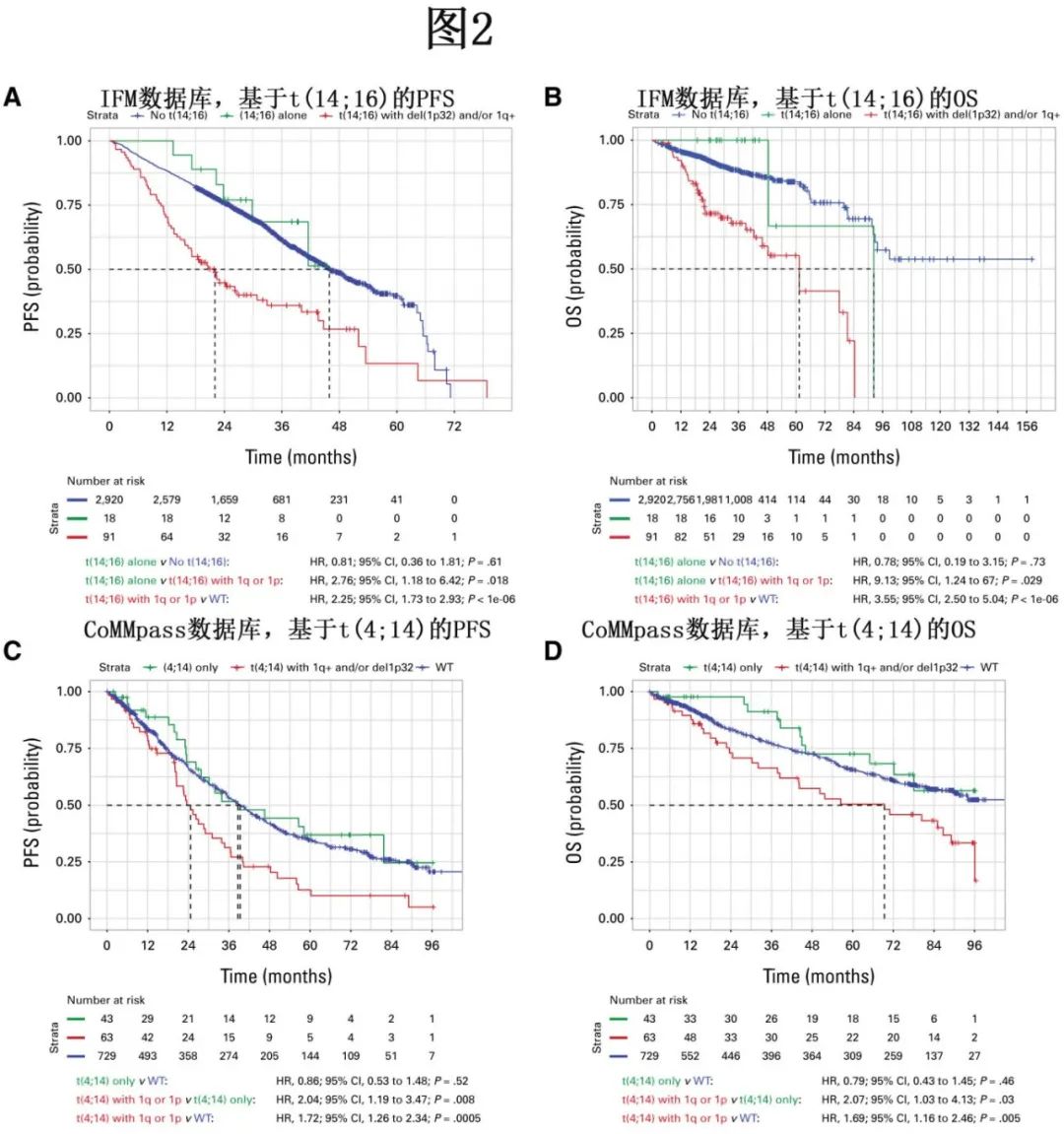
t(14;16)在NDMM患者中的发生率为2.1%±0.6%,并且与t(14;20)一起构成了MAF易位组。尽管t(14;16)与预后不良相关,但最近的数据表明它可能并非独立的预后因素。在一个IFM的真实世界队列中,携带t(14;16)的患者的PFS和OS分别为24.3个月和63.1个月,而缺乏t(14;16)的患者分别为39.2个月和99.4个月(图2A和2B)。孤立性t(14;16)与缺乏高危特征的患者之间的PFS和OS没有差异。t(14;16)与其他CAs密切相关——69.2%、22.5%和20.7%的t(14;16)患者同时携带1q+、del(17p)和del(1p32) ,并且还具有高载脂蛋白B mRNA编辑酶和催化多肽型(APOBEC)突变特征。没有共存1q+的t(14;16)患者往往存在其他HRCAs,例如del(17p)或TP53突变,也证实了孤立性t(14;16)在NDMM中极为罕见。此外,没有1q+的t(14;16)患者的生存结局与没有t(14;16)的患者相当(图2A和2B)。
在NDMM患者中,4号染色体(NSD2)和14号染色体(IgH位点)之间的t(4;14)易位事件发生率为10%±1.2%,根据R-ISS认为是高危特征。然而,只有30%-40%的t(4;14)阳性患者在临床上属于高危,其余患者的治疗结局与标危或中危患者相当。因此,对于t(4;14)阳性患者的分层可能需要根据共存的CAs进一步细化,其中1q+和del(1p32)与t(4;14)共存时会显著加重预后。CoMMpass研究表明,t(4;14)事件与1q+共存的比例为55.6%,而与del(1p32)共存的病例较少(11.3%)。
在最近对t(4;14)阳性NDMM患者的研究中,特定的易位断裂点(与NSD2融合转录本相关)以及del(17p)/1q扩增,与高危患者的OS独立相关(OS<24个月)。尽管目前NSD2断裂点介导的预后尚未被归类为高危特征,未来可能会在风险分层方法中加以考虑,但数据支持在t(4;14)与1q+或del(1p32)共存时将其视为高危特征。在CoMMpass数据集中,孤立性t(4;14)在与1q+和/或del(1p32)共存时(而非孤立存在时)对预后的影响也体现在NDMM患者中(图2C和2D)。在Myeloma XI研究中,仅存在孤立性t(4;14)、孤立性del(1p)或1q+的患者,比存在两种风险标志物的患者预后显著更好。与之相符的是,在GEM研究中,携带≥1个额外打击的t(4;14)阳性患者显示出显著更差的预后。
同样,t(14;20)(发生率2%)只有在与1q+或del(1p32)共存时才具有最高的预后影响。在CoMMpassSM队列的NDMM患者相似性网络分析中,当NSD2/MMSET(t(4;14))、MAF(t(14;16))或MAF-C(t(14;20))易位与1q改变共存时,患者的预后更差。在Myeloma XI研究中,携带MMSET-/MAF相关易位的患者在复发时会积累其他风险标志物——del(17p)、1q+和/或del(1p)。对来自三项III期试验的2596例NDMM患者的汇总数据分析也证实,当这些MMSET-/MAF相关易位与1q+共存时,患者的预后较差。IMS-IMWG的共识建议是,只有在与1q+或del(1p32)共存的情况下,才将t(14;16)、t(14;20)和t(4;14)视为高危特征。
1号染色体异常的作用:1q改变和del(1p32)
在NDMM患者中,1q+和del(1p32)较为常见,分别为约35%±2.7%和13.4%±1.1%。尽管以往的风险分层系统未将del(1p32)列为高危因素,但最新数据显示del(1p32)具有不良预后影响,仅次于del(17p)。
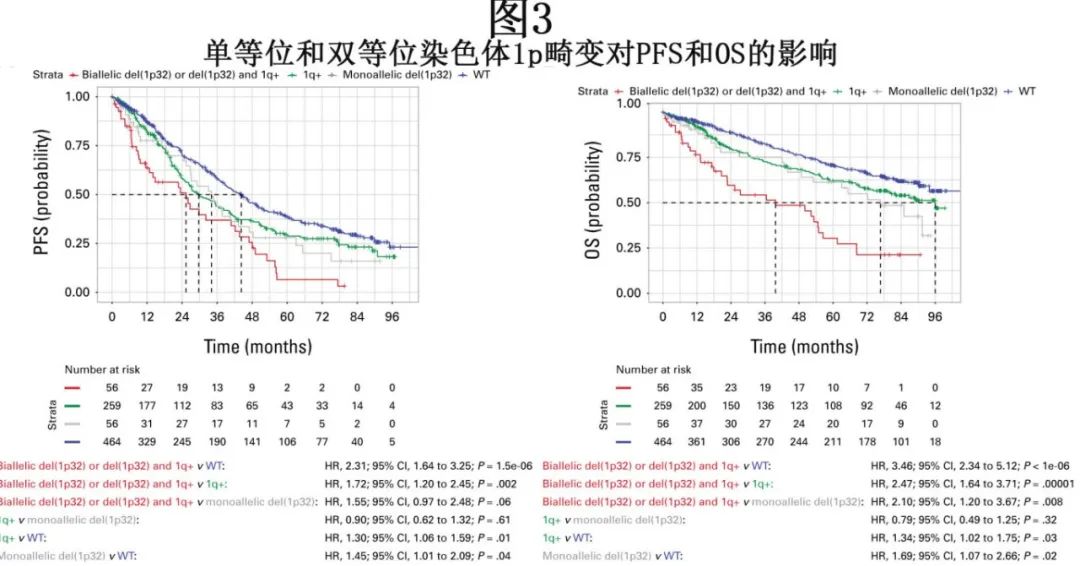
在早期的IFM队列中(1635例NDMM患者,治疗时间为2000-2012年),孤立性del(1p32)或1q+与中等预后相关,而共存del(1p32)和1q+则导致预后显著更差。专家小组回顾了一个更新的IFM队列数据,该队列包含2551例近期诊断的患者(2010-2021年)。在这个队列中,与没有del(1p32)的患者相比,del(1p32)患者的1q+发生频率更高(55% vs 33.8%);del(1p32)患者的中位PFS和OS分别为17个月和49个月,而没有del(1p32)的患者分别为30个月和124个月。在较正年龄和治疗因素后,del(1p32)阳性患者的疾病进展风险和死亡风险分别高出1.3倍和1.9倍。在del(1p32)患者中,存在双等位基因缺失的患者(占比20%)与单等位基因del(1p32)患者相比预后显著更差(PFS为9个月 vs 19个月;OS为24个月 vs 60个月)。在MMRF/CoMMpass数据集中,与仅存在单等位基因del(1p32)、仅存在1q+或无细胞遗传学异常的患者相比,双等位基因del(1p32)事件或单等位基因del(1p32)合并1q+的患者的生存更差(图3)。在HD6的全基因组测序数据分析中,双等位基因del(1p32)同样与更差的PFS和OS相关。总体而言,证据表明双等位基因del(1p32)和1q+合并单等位基因del(1p32)是高危特征。
尽管1q+通常被认为是预后不良的标志物,但由于其高发生率(高达40%的NDMM患者中存在),很难将其用于定义高危。1q+在具有其他不良临床或细胞遗传学特征的患者中发生频率更高,但在标危患者中也很常见。因此,对1q+ NDMM的风险重新分层很必要。在GEM队列中,研究发现仅存在1q+作为孤立性细胞遗传学异常的患者对生存无负面影响,表明其他细胞遗传学异常的共存对于决定1q+的预后影响至关重要。此外,携带1q获得(gain(1q))与1q扩增(amp(1q))的患者之间的预后并无差异,该发现在IFM队列中也得到了一致的结果,尽管在某些研究中1q扩增显示出比1q获得更差的预后影响。
总体而言,证据支持在1q+合并其他风险因素(如t(4;14)、t(14;16)和t(14;20)易位或单等位基因del(1p32))时,将1q+视为高危特征。目前,尚未有详细分析del(1p32)或1q CCF对预后的影响,因此在当前IMS-IMWG HRMM定义中未考虑del(1p32)或1q的克隆性。共识建议是,将1q+合并双等位基因del(1p32)(通过FAF1或CDKN2C缺失检测)或单等位基因del(1p32)(通过FAF1或CDKN2C缺失检测)视为HRMM特征。
ISS和其他临床特征的作用
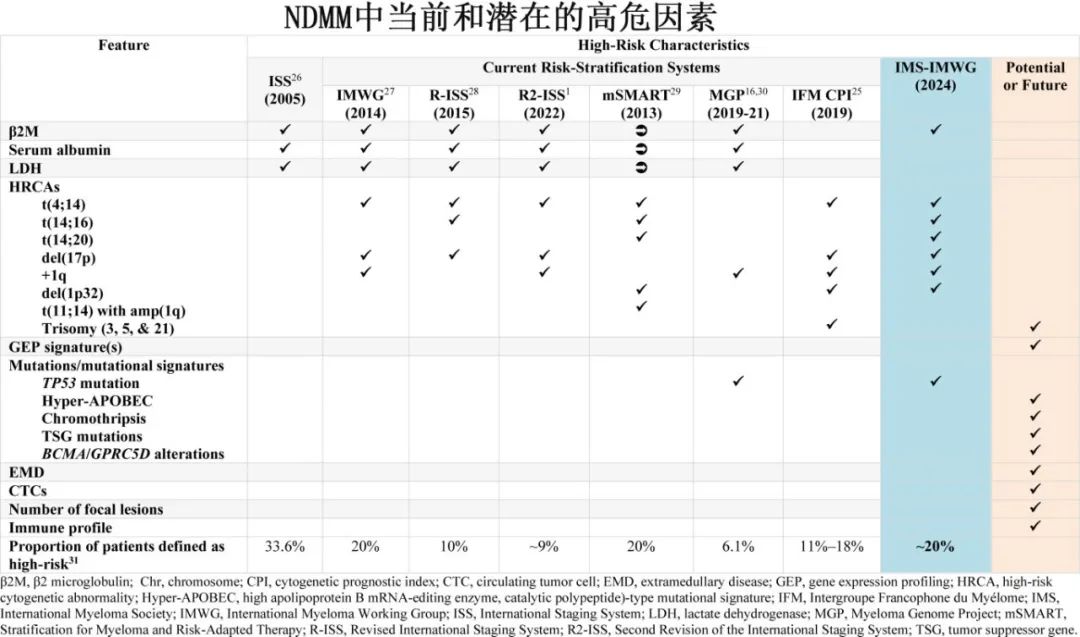
与上述可能通过促进疾病生物学的侵袭性而影响预后的基因组标志物不同,以往的分期和风险分层系统还包含了其他因宿主特征(低白蛋白、肾功能不全)和肿瘤负荷(β2微球蛋白[b2M]、单克隆蛋白水平)而导致不良预后的变量。尽管ISS开发于近20年前,且作为常规临床使用中实用、易于使用且方便的工具,已经使用了数十年,但它无法捕捉MM的潜在生物学特征,如今已不再重要。尽管细胞遗传学风险特征加入ISS中以开发了修订版国际分期系统(R-ISS),但其分期/风险类别在不同试验中报告并不一致。此外,ISS和R-ISS均未探讨del(17p)或t(4;14)的独立预后作用。通常来说,即使在R-ISS建立后的临床研究中,ISS分期和CAs也分别报告;在现代的MM试验中,ISS Ⅲ期仍然是预示不良预后的指标,并被纳入到新的NDMM风险分层系统中。
R2-ISS试图改进ISS和R-ISS,并在定义HRMM时考虑了del(17p)、t(4;14)和1q+。然而,R2-ISS使用的是HARMONY数据集,该数据集包括学术临床研究但不包括行业主导的试验,并且未包括基于单克隆抗体(mAb)方案的研究。因此,需要重新考虑以往风险分层模型中各个参数的预后相关性,并结合其他相关标志物的当代证据,根据驱动侵袭性临床过程的生物学特征重新定义HRMM。
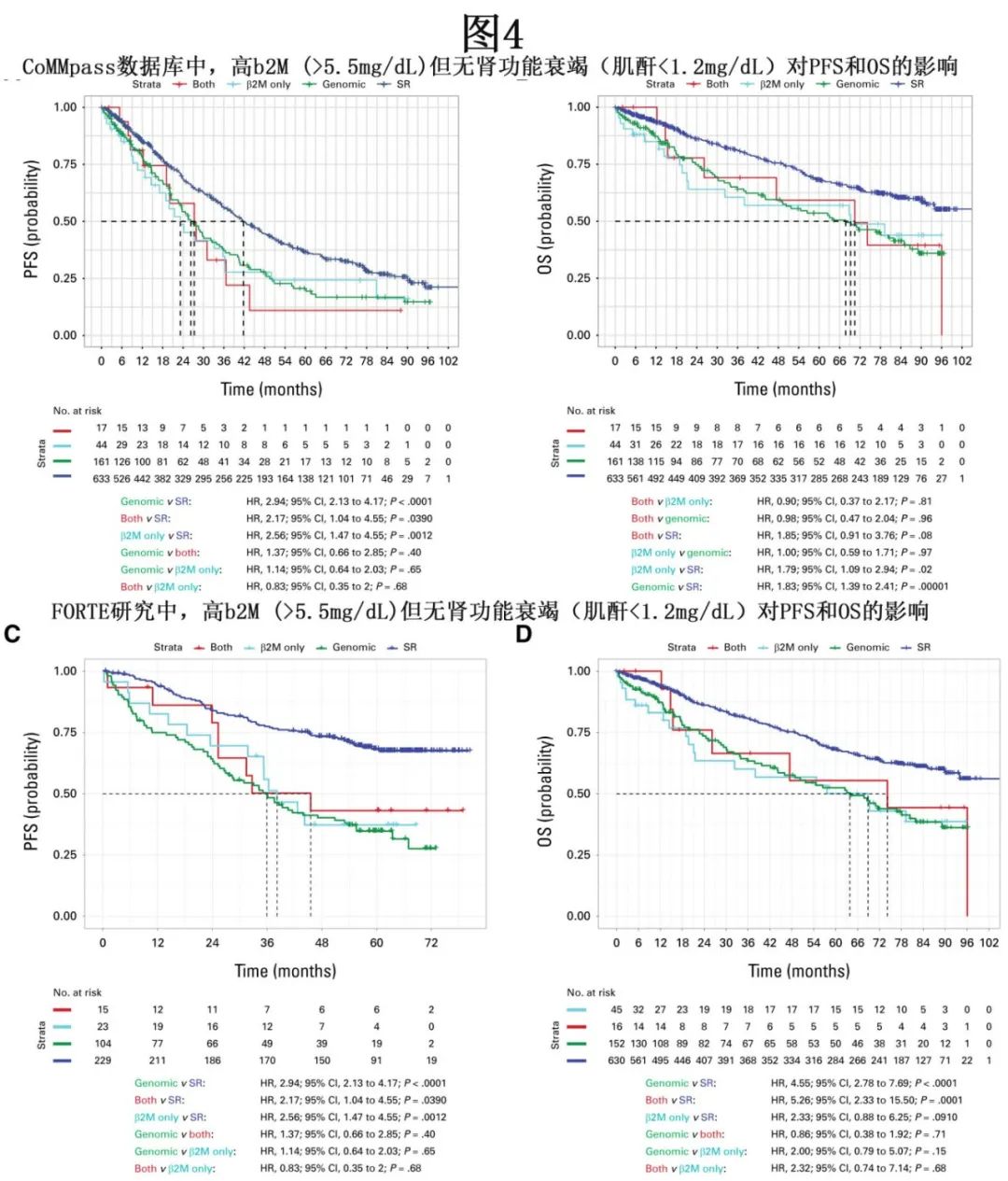
b2M作为独立高危特征的作用和价值存在争议,因其在不同数据集中的独立预后价值存在差异。骨髓瘤患者的b2M水平可能因肾功能不全和/或高肿瘤负荷而升高。由于从治疗角度来看,克服因宿主特征(年龄、肾衰竭)导致的不良预后需要的策略与克服因生物学侵袭性或高肿瘤负荷导致的高危疾病所需的策略完全不同,因此在没有肾衰竭的情况下确定b2M的预后效应至关重要。在CoMMpass和FORTE数据集中,与标危患者相比,孤立性高b2M(≥5.5 mg/dL)且无肾衰竭(肌酐<1.2 mg/dL)的患者预后更差,其结局与基因组学定义的高危患者相当(图4A-4D)。两个数据集均有血清肌酐水平(而非肌酐清除率)可供使用;因此在本分析中,肌酐>1.2 mg/dL被认为提示肾衰竭。因此,专家小组将高b2M(≥5.5 mg/dL)且无肾衰竭(肌酐<1.2 mg/dL)纳入HRMM的定义中。重要的是,b2M和肾功能评估在任何情况下都不应视为所有MM患者详细基因组学分析的替代品。IMS-IMWG共识HRMM定义见表1,适用于IMS-IMWG共识HRMM定义的一般考虑因素见表2中。


讨论
本文概述了2024年IMS和IMWG关于HRMM的CGS,该分期基于现有的关于潜在生物学和基因组/分子特征的数据。在我们努力改善高危患者的预后的过程中,使用一致的HRMM定义是一个重要前提,它使临床医生能够为患者提供更现实的预后信息。在临床试验中统一使用该定义,也将有助于更好地比较高危患者在接受特定治疗时的结局,因为高危患者通常是所有患者试验中的亚组之一。希望这一基于数据的共识定义能够促进针对HRMM患者的临床试验的设计和开展。最后,鉴于MM的异质性结局,未来的骨髓瘤治疗很可能是根据风险进行调整,而该共识定义是我们朝着在临床实践中使用风险分层治疗策略迈出的重要一步。强烈建议在未来的临床试验中普遍使用IMS-IMWG的HRMM CGS,以确保试验中高危患者人群的一致性。
这一基因组/分子HRMM定义的第一版需要基于测序的分析。基于下一代测序(NGS)的技术已经在血液系统恶性肿瘤(包括骨髓增生异常综合征和急性髓系白血病)中被实施为标准治疗。专家小组认识到,基于测序的工具可能不会立即在世界各地的所有地区或实践环境中普遍可用;在这种情况下,由于突变数据在这个系统中只涉及非常小一部分患者,因此仍可以使用现有的要素来暂时应用所提出的HRMM定义。
专家小组指出,与其在临床试验中统一报告通过FISH评估的各个细胞遗传学异常的详细信息,不如报告综合风险类别,后者结合了特征,增加了数据收集和分析中异质性的挑战。此外,用于定义高危的CCF截断值并不总是报告。专家小组建议,关于个体 CAs 的数据和定义高危的阈值应高于所用测定方法的假阳性率,此后 MM 研究必须报告 CAs 的分析方法、频率和阈值。
目前的分类并未整合特定的分子驱动因素,而是整合了一系列异常,所有这些异常均定义了一个临床表型,其特征包括缓解持续时间短、早期出现多药耐药以及相对较短的生存期。重要的是要区分风险分层和分子分类,因为这些概念指导着不同的治疗策略;虽然HRMM需要积极的管理,但分子分类将指导为特定患者使用基于分子/基因组的治疗方法。例如,识别t(11;14)这一分子分类器可以指导RRMM患者选择维奈克拉。
罕见的异常,如t(14;16),即使在较大的数据集中也可能被低估,导致目前难以估计它们对预后的单独贡献。因此,专家小组认为,目前更谨慎的做法是在共存的细胞遗传学异常(如1q1或del(1p32))的背景下评估它们的预后贡献。展望未来,需要重新评估新型疗法克服单一HRCA的不良预后影响的能力,以及≥2个HRCA的影响。
IMS专家小组回顾了其他可能有助于在未来完善HRMM定义的预后因素,当有更多数据可用或技术在常规实践中更容易获得/应用时。这些包括基因表达谱(GEP)特征——尽管GEP特征(例如,SKY92或UAMS70)仍然是重要的独立预后因素,并且可以帮助识别不能通过目前可用的任何基于DNA的诊断工具充分分类的高危患者,但目前在常规实践中使用GEP仍存在局限性。专家小组支持在可行的情况下继续探索具有预后影响的经过验证的GEP特征,并重新审视它们在未来分类工作中的作用。同样,有必要进一步探索循环肿瘤(CTC)/浆细胞,以确定CTC的预后意义是否独立于细胞遗传学异常/其他基因组特征。据报道,当与其他风险因素结合时,存在≥0.01%的CTC可能是一个新的风险因素。髓外疾病(EMD),无论是原发性还是继发性,在初次诊断和复发时都预示着不良预后。局灶性病变的大小、数量和代谢特征也可能影响预后。尽管EMD没有被纳入这一版的HRMM,但患有EMD的患者值得进一步研究,如果进行了活检并且/或者可行,可以对EMD来源的组织进行高危特征的评估。专家小组还审查了其他潜在的高危特征,包括血清铁蛋白、影响特定基因(BRAF、MYC)的改变、使用靶向测序panel和易位分析查询多个基因/位点的改变、乳酸脱氢酶、血小板计数和血清白蛋白,其中部分因素已经被考虑/包含在以往的风险分层方案中。专家小组确定了需要在未来进一步探索和验证的潜在高危预后标志物,包括t(11;14)与1q扩增、t(8;14)、高APOBEC特征、肿瘤抑制基因(除了TP53)的双等位基因失活以及染色体碎裂,作为需要进一步未来探索和验证的特征。
对于患有肾脏疾病的患者,共识使用所有其他提出的遗传风险特征来确定风险。在标危细胞遗传学合并肾脏功能不全的患者亚组中,极少数的患者可能b2M本身就较高,并进一步被肾脏功能不全所恶化。然而,目前还无法识别那些因肾脏功能不全而真正高b2M的罕见病例(不受肾脏功能不全的影响),这些罕见病例中的风险确定将需要在未来有更多的数据可用时进一步考虑。此外,由于目前没有关于高肿瘤负荷或M蛋白水平的详细数据,因此在当前分析中没有将这些参数与高b2M一起考虑。
在整个疾病/治疗过程中进行风险分层很重要,因为高危特征可能在复发时累积;因此,基于该基因组定义的风险再评估不应局限于NDMM人群,应在首次复发或临床试验入组时也进行评估。目前的建议主要由OS驱动。专家小组认为患者的复发/再评估时的风险应作为其风险状态,除非在诊断时便为高危(在这种情况下,高危占主导地位)。
专家小组认识到,随着新治疗和新技术的出现,HRMM的CGS可能需要在未来重新修订。
总之,IMS-IMWG的HRMM CGS是第一个基于当代MM治疗背景下基因组高危特征的共识定义。该定义捕捉了一小部分患者(约20%),尽管接受了目前确立的MM治疗(包括三药和四药联合方案以及移植后维持治疗),但预后仍然较差。专家小组建议在所有临床试验和常规实践中从此以后使用这一HRMM定义。
参考文献
Hervé Avet-Loiseau et al. International Myeloma Society/International Myeloma Working Group Consensus Recommendations on the Definition of High-Risk Multiple Myeloma. JCO 0, JCO-24-01893 DOI:10.1200/JCO-24-01893
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)