首页 > 医疗资讯/ 正文
摘 要
肺癌是全球发病率最高的恶性肿瘤。对于肺内多发转移或肺功能不全的肺癌患者,完整切除肿瘤的难度大,预后不佳。肺移植在肿瘤的完全切除、改善患者肺功能及提高生活质量方面展现出潜在的治疗价值。全身正电子发射断层显像-计算机断层扫描、循环肿瘤DNA等肿瘤检测技术以及肺癌综合治疗手段的发展,为肺移植术后肿瘤复发和治疗预后的精准预测提供了有力工具。肺移植治疗肺癌的可行性正受到越来越多的关注。本文将对肺癌肺移植的历史及其临床管理进行综述。
正 文
肺移植是终末期慢性肺病导致呼吸衰竭的最终治疗手段[1-2]。目前,肺移植适应证主要为良性肺病,包括间质性肺病(interstitial lung disease,ILD)、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)和支气管扩张等[2-5]。然而,在恶性肿瘤治疗领域,肺移植的应用仍处于探索阶段。
肺癌是我国发病率和死亡率最高的癌症类型,2022年新发病例数高达106.06万,并呈逐年增长趋势[6]。免疫治疗和靶向治疗是晚期肺癌伴转移或合并肺功能障碍患者的主要治疗手段[7-8]。但部分患者因驱动基因阴性或对治疗反应性差,长期预后仍不理想[9]。如何为此类患者提供更有效的治疗策略,成为亟待解决的问题。既往研究[10-12]表明,对于早期肺癌或局限性肺内转移患者,肺移植后生存率与良性肺病肺移植受者相当。然而,移植后肿瘤复发风险和免疫抑制治疗的潜在影响仍是限制其广泛应用的关键问题。
1 肺癌肺移植的发展
肺移植治疗肺癌历史悠久。1963年,Hardy等[13]为1例左侧中央型肺癌并伴严重慢性肺病的患者实施单肺移植,尽管患者因术后早期肾功能衰竭死亡,但此举开启了肺移植治疗肺癌的先河。
早期研究主要集中于支气管肺泡癌(bronchoalveolar carcinoma,BAC),这是一种起源于细支气管或肺泡上皮的恶性肿瘤。BAC患者传统治疗效果有限,其晚期患者接受手术治疗的5年生存率仅为34%,表皮生长因子受体(epidermal growth factor receptor,EGFR)靶向药物Gefitinib治疗的3年生存率仅为20%~30% [14-17]。在此背景下,肺移植逐渐成为BAC患者的重要治疗选择之一。1999年,Garver等[18]报道7例晚期BAC患者的2年无病生存率(disease-free survival,DFS)为71.4%,中位复发时间为39个月。2003年,Zorn等[19]报道了9例BAC患者的3年总体生存率(overall survival,OS)和DFS分别为66.7%和55.6%,中位复发时间为19.5个月。2004年,de Perrot等[10]的研究纳入了26例因BAC接受肺移植治疗的患者,5年无复发生存率为35%,5年OS为39%,中位复发时间为12个月。2012年,Ahmad等[11]基于美国器官共享联合网络(United Network for Organ Sharing,UNOS)数据库的分析表明,1987—2010年间因BAC接受肺移植的患者,其5年生存率与总体肺移植受者人群相当(57% vs. 50%,P=0.66)。总体来看,尽管肺移植治疗BAC术后存在复发风险,但生存率与总体肺移植人群相近,表明肺移植可成为BAC患者的潜在治疗选择。
近年来,肺移植治疗的研究方向逐渐扩展至其他类型的肺癌。2024年,美国西北大学Chae等[20]报道了1例ⅣA期侵袭性黏液性腺癌(invasive mucinous adenocarcinoma,IMA)患者,该患者常规化疗及免疫治疗均无效,最终行体外循环双肺移植。术后随访显示,患者的CT影像及循环肿瘤DNA(circulating tumor DNA,ctDNA)均未提示肿瘤复发。这一病例首次表明,体外循环下双肺移植可能为晚期肺内转移肿瘤患者提供一种潜在的治疗选择。基于此,美国西北大学肺移植中心启动了一项前瞻性临床队列研究(double lung transplant registry aimed for lung-limited malignancies,DREAM,NCT05671887),旨在评估肺移植对综合治疗无效的原发性或转移性肺部肿瘤患者的疗效[21]。DREAM研究特别设计了合并良性肺病的肿瘤患者行肺移植治疗的分组。因为既往研究[22-26]表明,这些患者接受常规治疗可能导致肺功能进一步恶化,甚至引发呼吸衰竭。DREAM研究的初步结果显示,在6例ⅣA期肺癌肺移植患者中,5例术后无复发并存活,1例在术后18个月时肺部出现1 cm实性结节[27]。结果提示,对于局限于双肺的晚期肿瘤患者,尤其是常规治疗无效或无法耐受者,肺移植可能成为一种重要的治疗手段[28]。
目前国际心脏和肺移植学会(International Society for Heart and Lung Transplantation,ISHLT)专家共识将肺移植治疗肺癌的适应证严格限定为原位腺癌、微浸润肺腺癌以及贴壁生长型腺癌等肺内局限恶性肿瘤。目前接受肺移植治疗肺癌患者较少,仅占肺移植病例的0.1%[29]。随着DREAM研究的开展和肺移植技术的不断完善,未来肺移植适应证有望从肺内局限恶性肿瘤扩展到更多类型的晚期肺癌患者。
2 肺癌肺移植受者管理
器官移植在恶性肿瘤治疗中具有重要意义,通过移除受累器官可实现病灶清除和器官功能恢复。然而,移植术后长期免疫抑制治疗显著增加了新发或复发肿瘤的风险[30-32]。以肝癌肝移植为例,尽管术前通过严格的适应证评估(如Milan标准)并实施规范化的术后管理,术后5年复发率仍达10%~20%[33]。肝癌肝移植与肺癌肺移植同属于器官移植治疗恶性肿瘤的范畴,但目前肺癌肺移植相关研究仍较为有限,尚未形成统一的管理策略。在肝癌肝移植领域,术前适应证评估、围手术期治疗及术后随访管理等方面已积累了较为成熟的经验。这些经验对肺癌肺移植的临床管理具有重要的借鉴意义,尤其是在制定适应证、优化围手术期治疗及长期随访策略方面,可为未来的研究和实践提供重要参考。
2.1 肺癌肺移植术前评估
晚期肺癌移植受者的预后显著差于早期肺癌患者[12]。多项研究[12,34-35]表明,肺移植术后自体肺诊断肺癌患者可能伴随胸腔内淋巴结或远处器官转移。在此背景下,术前肿瘤评估对于预测复发风险、指导围手术期治疗及选择合适的治疗策略具有重要意义。胸部计算机断层扫描(computer tomography,CT)、全身正电子发射断层显像-计算机断层扫描(positron emission tomography-computer tomography,PET-CT)、ctDNA等检查可明确肿瘤的大小、性质以及是否存在局部或远处转移,从而综合评估肿瘤的分期,选择合适的治疗方案(图1)。
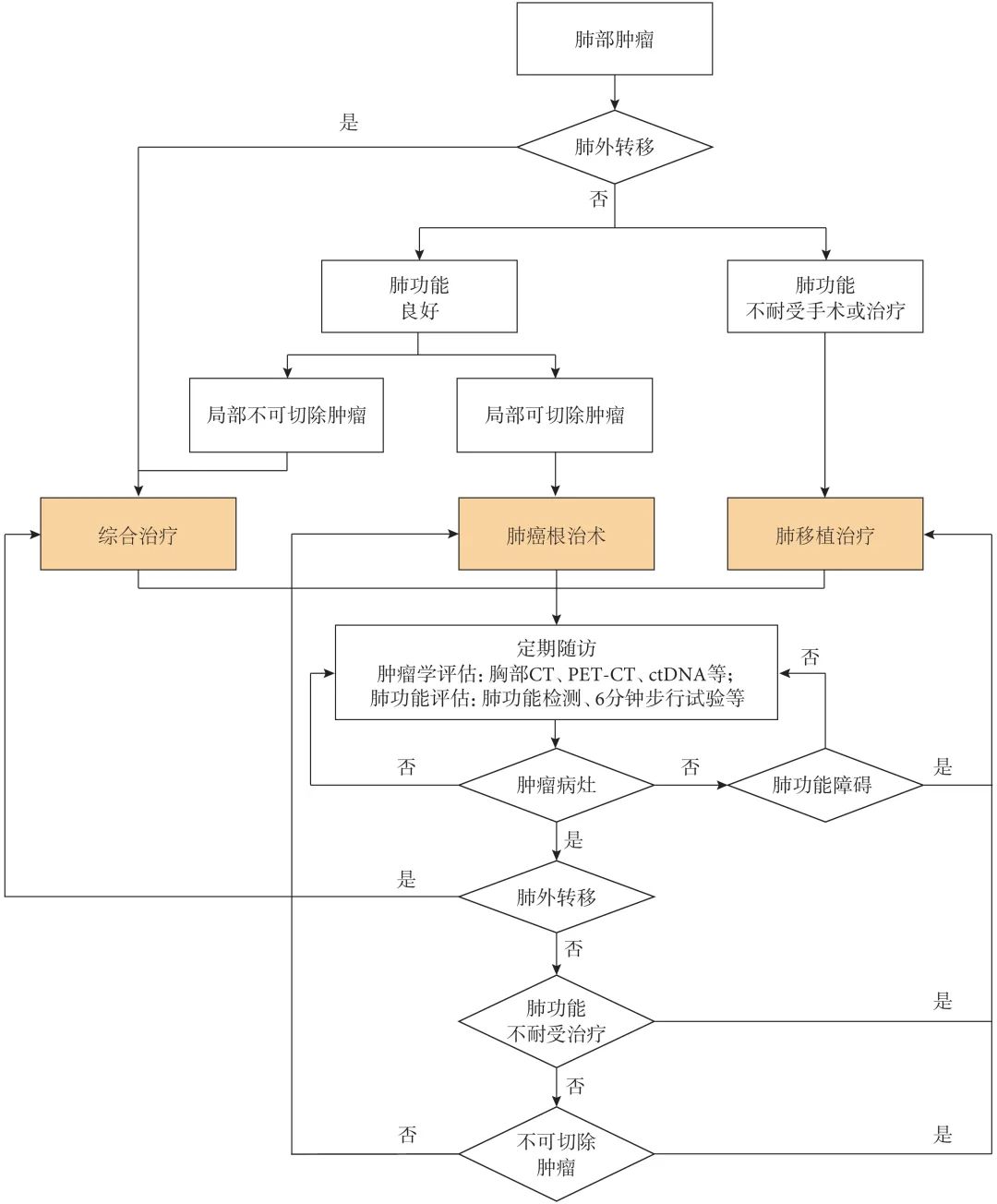
图1 肺癌肺移植受者管理流程
PET-CT通过检测放射性示踪剂在体内的代谢活动,识别高代谢的肿瘤及其转移灶,从而帮助识别、定位和监测肿瘤,是评估肿瘤性质和分期的重要辅助工具。肝癌肝移植的研究[36]发现,联合术前PET-CT与肿瘤标志物检测对预测移植后肿瘤复发具有重要价值。术前胸部CT存在漏诊肺癌的风险,PET-CT可及时检出淋巴结甚至远处器官转移[12,34-35]。在器官移植治疗恶性肿瘤术前评估中,若PET-CT提示远处器官或淋巴结转移,则术后复发风险较高[37]。此类患者可先接受抗肿瘤综合治疗,待肿瘤降级且复发风险降低后,再考虑行移植手术[38]。
ctDNA是指从肿瘤细胞释放到血液中的DNA片段,可用于无创监测肿瘤负荷和检测微小残留病灶,对肿瘤诊断具有较高的敏感性。Huang等[39]的前瞻性队列研究发现,术前ctDNA检测阳性的肝癌患者在接受肝脏移植后,其无复发生存时间显著短于术前ctDNA检测阴性的患者,移植前低ctDNA水平与较低的移植后肿瘤复发风险相关。尽管该研究以肝癌肝移植为研究对象,其结果提示ctDNA作为术前评估指标的潜力,亦可为肺癌肺移植的术前评估提供重要参考。在肺癌患者中,ctDNA不仅是肺癌早期转移的重要生物标志物,还在抗肿瘤治疗疗效监测和复发风险预测中具有重要价值[40-43]。基于此,未来应进一步开展研究,探索ctDNA在肺癌肺移植术后复发预测中的具体作用,以优化术后管理策略并提高患者的长期生存率。
2.2 肺癌肺移植围手术期治疗
免疫治疗和靶向治疗等抗肿瘤疗法在降低恶性肿瘤器官移植受者术后复发风险、提高患者生存率中发挥重要作用[38]。
免疫治疗利用免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)阻断T细胞抑制信号通路,促进T细胞激活,诱导调节T细胞(Treg)凋亡,增强免疫系统对肿瘤抗原的反应强度[44-46]。对于肿瘤晚期或存在多灶转移的患者,移植前免疫治疗可控制肿瘤进展,有望实现肿瘤降级,降低肿瘤转移风险[47-48]。但与此同时,ICIs也会促进免疫细胞对移植物的杀伤。尽管器官移植术后应用免疫抑制药物抑制T细胞免疫活性,移植前接受免疫治疗的患者仍可能因供体人类白细胞抗原(HLA)免疫反应增强而面临更高的早期排斥风险[48]。因此,在器官移植治疗恶性肿瘤中,平衡免疫治疗的抗肿瘤效应与其促排斥的潜在风险至关重要。研究[48-49]表明,在肝癌肝移植术前免疫治疗中,延长免疫治疗与移植之间的间隔时间,可有效降低术后急性排斥反应风险。目前,针对肺癌肺移植受者的免疫治疗研究仍较为有限,其适应证、药物选择及与移植的最佳时间间隔等关键问题有待进一步探索。
EGFR、鼠肉瘤病毒癌基因同源物(Kirsten rat sarcoma viral oncogene homolog,KRAS)、间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)、ROS原癌基因1(ros oncogene 1,ROS1)等是主要的肺癌驱动基因突变,均有对应的靶向治疗药物[50]。移植前靶向治疗可缩小受者肿瘤病灶,降低远处转移风险[38,51]。移植后辅助靶向治疗可能降低恶性肿瘤复发风险,并延长复发患者的生存时间[52-54]。然而靶向治疗对移植器官排斥的影响尚不明确[55-56]。尽管目前尚无针对肺癌肺移植受者的靶向治疗研究,但对于驱动基因阳性肺癌患者,靶向治疗或可作为移植前后抗肿瘤治疗的重要组成部分。未来研究应进一步探讨靶向治疗药物对肺癌肺移植预后的影响,为驱动基因阳性肺癌患者的移植治疗策略提供重要依据,并有望改善患者的长期生存预后。
肺癌肺移植需严格遵循无瘤原则,以最大限度降低术中及术后肿瘤播散和复发风险。移植前预先建立体外循环阻断病肺循环,术中依据术前肿瘤分期指导清扫引流淋巴结[20]。术中操作应依据术前肿瘤分期,严格按照无瘤原则进行,包括彻底清扫引流淋巴结等[57]。术后需对切除的肿瘤组织及引流淋巴结进行病理检查和驱动基因检测,明确术后病理分期,并为后续综合治疗提供精准指导。
2.3 肺癌肺移植术后随访
术后密切随访和监测复发性恶性肿瘤的发生情况,并及时采取有效治疗措施,是提高肺移植患者远期生存率的关键。
Ahmad等[35]和Spies等[12]对自体肺病理诊断为肺癌的肺移植受者进行了随访,其术后中位肿瘤复发时间分别为14个月和13个月。非局限性肺癌(Ⅱ~Ⅳ期)肺移植受者的总体生存预后显著差于局限性肺癌患者[12,34]。除了复发肿瘤,肺移植术后原发肿瘤也是肺移植术后肿瘤的主要因素,肺移植受者的肺癌年发病率和死亡率分别为626.4/10万和 470.3/10万[58-59]。单肺移植受者术后新发肺癌多见于自体肺,其肺癌发生率是普通人群的13倍,而COPD和ILD等原发病是重要危险因素[60-61]。
针对肺移植术后肺癌的治疗,当前主要包括肺癌根治术、二次肺移植及综合治疗等。对于单肺移植受者,若自体肺局限性肿瘤明确,肺癌根治术或自体肺侧单肺移植可能是可行的治疗选择。然而,关于这两种治疗方案的优劣及其临床获益,目前尚无明确共识。对于原发病为支气管扩张或矽肺的患者,由于自体肺感染和肿瘤风险较高,治疗策略需根据患者具体情况权衡[62-64]。对于双肺移植受者,应依据肿瘤的分级和分期选择适合的治疗方案,如肺癌根治术或综合治疗。若移植肺功能严重受损,二次双肺移植可能是可行的选择[65]。对于失去手术机会的患者,则需结合具体情况采用免疫治疗、放化疗及其他综合治疗方案。然而,目前针对肺移植术后肺癌复发的治疗尚无明确的指导方案,亟需进一步研究与探索,以优化治疗策略并改善患者预后。
3 小结
肺移植作为一种潜在治疗方式,或可为局限于肺内转移及严重肺功能损害的患者提供新选择。借鉴肝移植在肝癌治疗中的成功经验,肺癌肺移植展现出广阔应用前景。未来研究应聚焦术前评估技术(如PET-CT和ctDNA)的精准化,优化围手术期免疫治疗与靶向治疗策略,并完善术后复发监测体系,以提升长期疗效并改善患者预后。
利益冲突:无。
作者贡献:谭景洪负责文章初稿撰写;程超、陈静瑜负责文章审阅。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)