首页 > 医疗资讯/ 正文
【核心亮点】
- 革命性CRISPR基因编辑技术为降低血液低密度脂蛋白胆固醇(LDL-C)提供持久疗效,仅需单次治疗即可实现终生改善。
- 探讨AAV介导的基因补充及基因编辑在遗传性脂蛋白代谢紊乱疾病(如家族性高胆固醇血症、家族性乳糜微粒血症、Lp(a)升高)的应用现状与挑战。
- 结合机器学习和多基因风险评分提升心血管疾病风险预测及个体化治疗精准度,为基因治疗临床推广奠定基础。
近期,发表在European Heart Journal的一项前沿综述,系统汇总了基因治疗和基因编辑在脂蛋白紊乱疾病中的最新进展,聚焦于单基因和多基因驱动的脂蛋白代谢异常。随着多种胰岛素抵抗和动脉粥样硬化相关疾病的发病机理得到进一步阐明,基因组编辑技术尤其是基于CRISPR的碱基编辑,展现出通过靶向肝细胞特异性基因(PCSK9、ANGPTL3等)实现终生LDL-C和血脂降低的潜力,突破了传统长期药物治疗依赖和依从性差的瓶颈。此外,结合机器学习辅助的多基因风险评估(PRS)为精准预防和治疗心血管疾病提供了新策略。

【研究背景与现状】
动脉粥样硬化性心血管疾病(ASCVD)是全球主要的死亡原因之一,而血液中LDL-C的终生累计暴露量被公认为其核心致病因素。尽管目前已有多种降低LDL-C的药物,包括他汀类、PCSK9抑制剂及RNAi药物,但临床上存在患者依从性差、药物负担重和疗效达不到目标的问题。尤其是家族性高胆固醇血症(HoFH和HeFH)患者,目标LDL-C的达标率极低,带来巨大的临床管理难题。与此同时,Lp(a)的遗传变异亦被证实是ASCVD的重要独立风险因素,但尚无有效长期治疗方案。
传统基因补充疗法,如用AAV载体向肝细胞输送功能基因拷贝,曾因免疫反应、病毒载体安全性及疗效局限等瓶颈遭受挑战,但技术进步使其在部分罕见疾病中获批并取得成效。近年来,以精确碱基编辑为代表的基因编辑技术,特别是CRISPR技术的兴起,为一劳永逸的基因修饰提供了可能,能够精准、高效地使致病基因失活,从根本上降低LDL-C水平。
此外,单个基因影响之外,多个遗传位点共同作用、多基因风险评分已经成为风险评估的重要实验工具,与机器学习算法结合,为临床心血管风险精准评估和治疗提供新风向。
遗传性脂蛋白紊乱的基因治疗现状
-
家族性高胆固醇血症(FH)
HoFH患者LDL-C水平极高,由于部分患者LDL受体功能丧失,常规药物疗效有限,低达3%患者达标。HeFH较常见,但仅约三分之一患者接受他汀类治疗,30%-50%患者LDL-C目标未达标。 -
基因补充策略的演进及局限
20世纪90年代起,尝试用携带LDLR基因的逆转录病毒和腺病毒传递系统治疗HoFH,但临床疗效有限且存在严重安全隐患,例如引起免疫反应。非整合型AAV向肝细胞传递疗法成为未来方向,其中AAV8载体的LDLR基因替代临床试验正处于关键节点,但产业开发面临挑战。 -
目前获批的基因补充药物
“Glybera”即alipogene tiparvovec在欧洲获批治疗脂蛋白脂肪酶缺乏症,能显著降低甘油三酯和胰腺炎风险,但高成本和工艺复杂导致市场撤出。
基因编辑技术新突破
-
CRISPR碱基编辑
基于CRISPR-Adenine Base Editor (ABE)系统的基因编辑技术能实现单碱基对的精准转换(A→G),无需双链断裂,降低安全风险。VERVE Therapeutics开发的核心药物VERVE-101(pdx码ABE+gRNA载入LNP)能高效特异性破坏PCSK9基因,显著降低LDL-C,在非人灵长类动物中疗效持久达476天。人体一初步临床试验(Heart-1)显示最高可使LDL-C下降73%,但LNP载体偶有毒副反应,促使研发重点转向改良的VERVE-102,采用含GalNAc的新型LNP靶向肝细胞ASGPR受体,安全性更好,初步数据显示53% LDL-C降低。 -
其他靶点的基因编辑
针对ANGPTL3基因的VERVE-201碱基编辑表现出降低LDL-C和甘油三酯的潜力,对于患有HoFH且LDLR功能缺陷的患者同样适用,非临床数据安全性良好。CRISPR Therapeutics也开发针对ANGPTL3和Lp(a)的Cas9核酸酶系基因敲除疗法,正处于临床一阶段中,显示出对血脂大幅度和持久改善。
多基因风险评分与机器学习辅助风险预测
- 多基因风险评分(PRS)能有效识别心血管疾病高风险个体,且与传统风险评估工具(如SCORE2)组合后,能准确重新分类中间风险人群,提升预防效果。
- 机器学习结合遗传学、临床及影像学大数据,使个体化风险评估和药物反应预测更为精准,有望引导基因治疗的个体化应用。
RNA及核酸药物的补充作用
- 已上市的inclisiran通过siRNA机制抑制PCSK9,半年两针给药为患者带来便捷而显著的LDL-C降低。
- 针对ANGPTL3、ANGPTL4、APOC3、Lp(a)等基因的ASO和siRNA疗法多项处于临床三期,预见未来多靶点联合干预的趋势。
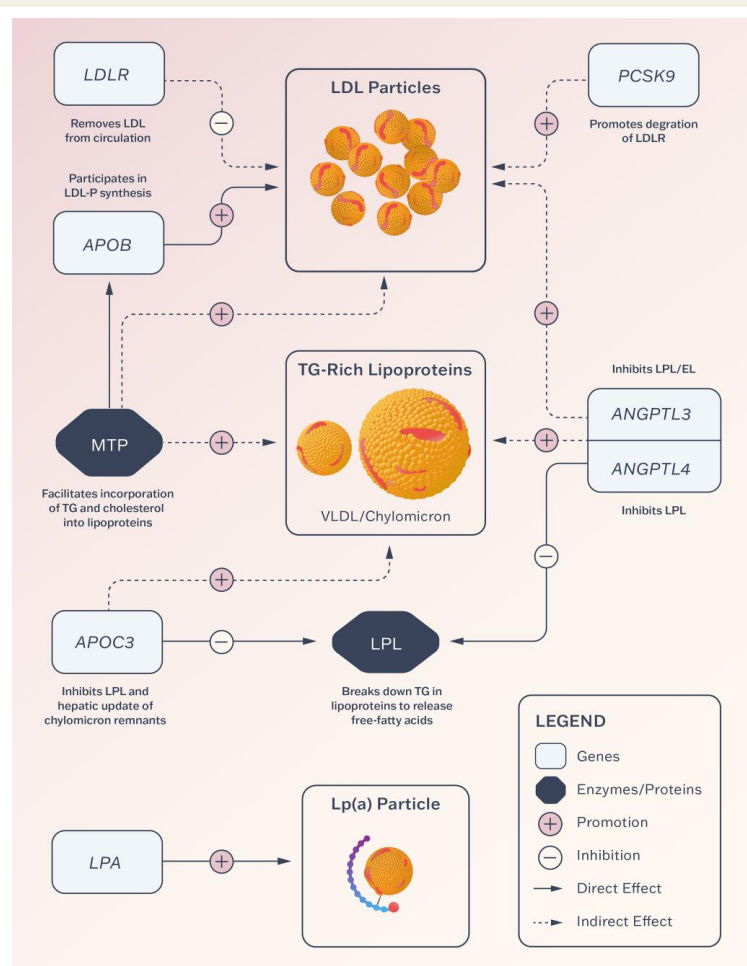
图:靶向脂蛋白紊乱的关键基因及其代谢途径示意图
清晰展示APOB、LDLR、PCSK9、ANGPTL3、ANGPTL4、APOC3和LPA等关键基因如何参与脂蛋白代谢及其治疗方式
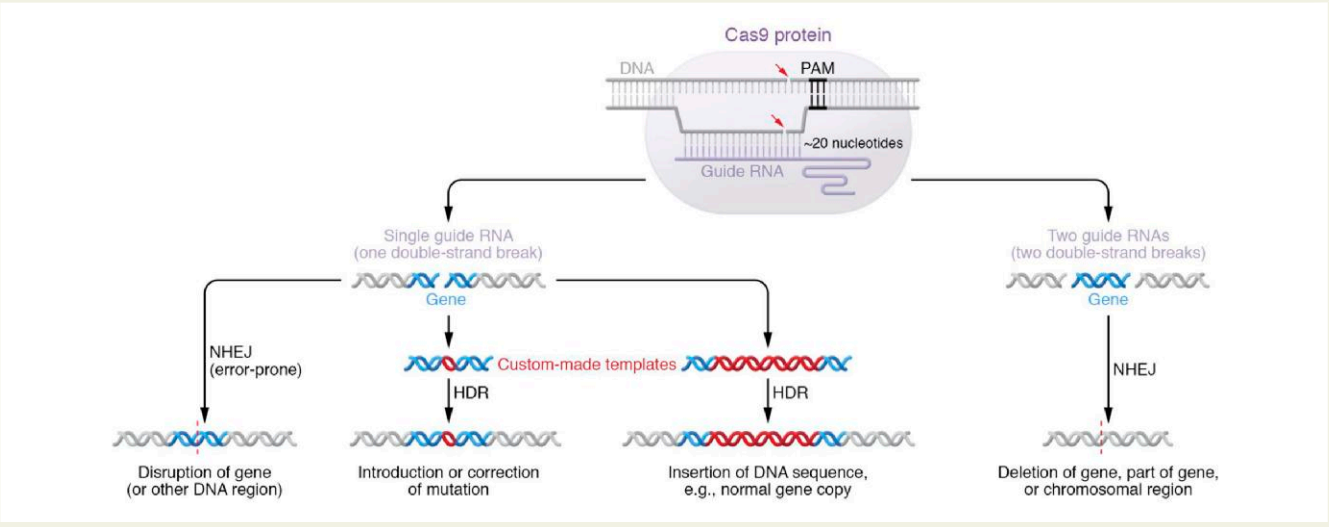
图:CRISPR/Cas9核酸酶编辑机制图
描述Cas9酶在导向RNA引导下、生成DNA双链断裂并诱导非同源末端连接修复以实现基因敲除的过程
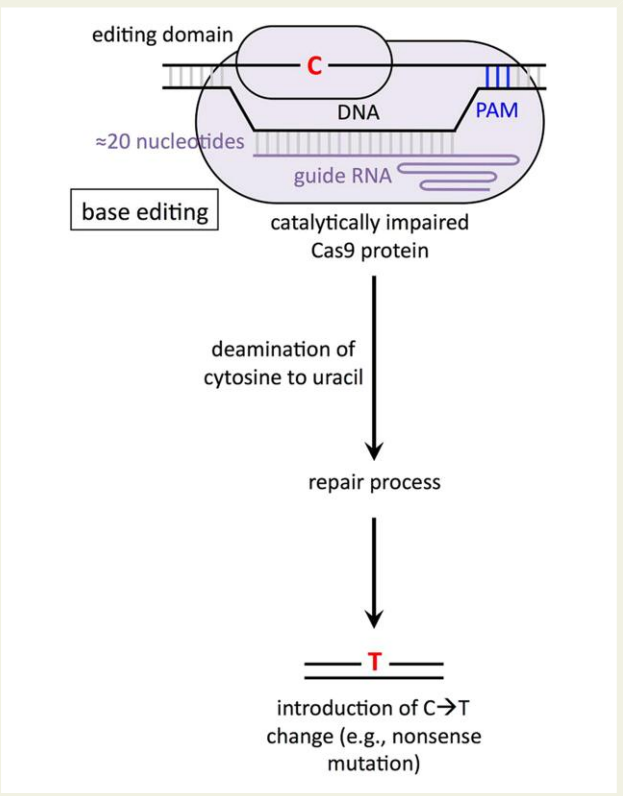
图3 碱基编辑工作流程图
展示碱基编辑仅通过化学改造单个碱基(不切断DNA双链)实现精准基因修饰的原理
-
表1 靶向脂蛋白紊乱的基因相关疗法汇总
【研究价值与意义】
本综述基于2025年《European Heart Journal》权威论文系统梳理了基因治疗和基因编辑在脂蛋白相关心血管病中的最新进展和未来方向。当前标准脂质降脂疗法无法充分解决患者长期依从性差和疗效不足问题,基因编辑技术尤其是碱基编辑的出现,有望实现单次静脉输注后终生控脂,开启心血管疾病预防的新纪元。通过肝细胞特异性递送系统如GalNAc修饰的LNPs,治疗的有效性与安全性均得到大幅提升,这对于高风险患者,尤其是遗传性严重高胆固醇血症患者,提供了革命性治疗选择。
此外,结合机器学习和多基因风险评分的精准风险预测,可精准识别潜在高危人群,指导基因治疗的适应症选择和时机判断。尽管基因治疗在安全性、成本及伦理等方面仍面临挑战,但其突破性临床疗效预示着未来将成为主流心血管疾病治疗策略的重要组成。
原始出处
Gene therapy and genome editing for lipoprotein disorders.European Heart Journal (2025) 00, 1–14. DOI: 10.1093/eurheartj/ehaf411.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)