首页 > 医疗资讯/ 正文

传统观念认为癌症与免疫系统无关,但现代研究表明免疫系统在肿瘤发生发展中至关重要。根据广泛接受的“三E”模型,免疫系统对恶性细胞前体和微观肿瘤的命运起着决定性作用。该模型包含三个阶段:在清除(Elimination)阶段,免疫系统有效识别并清除新转化的恶性细胞,如NK细胞和CD8细胞毒性T淋巴细胞(CTLs);平衡(Equilibrium)阶段时期,微观肿瘤与免疫系统处于动态平衡,免疫系统持续遏制其生长;在逃逸(Escape)阶段,肿瘤细胞在免疫选择压力下获得遗传或表观遗传改变,逃避免疫识别和清除,导致肿瘤生长和转移。肿瘤的免疫逃逸是一个主动的、动态适应的过程,类似“病原体-宿主共同进化”。 肿瘤细胞不断发展新的逃逸通路,导致单一靶向疗法可能面临耐药性。理解并逆转免疫逃逸机制,不仅能增强免疫治疗效果,也可能提高传统治疗的敏感性。2024年9月《Cancer Cell》杂志上发表的一篇名为《The hallmarks of cancer immune evasion》的综述中,作者提出一个新颖的“三C”概念框架——伪装(Camouflage)、胁迫(Coercion)和细胞保护(Cytoprotection),来分类肿瘤细胞逃避免疫监视的各种机制,并探讨靶向这些机制的治疗策略。“三C”框架旨在更清晰地解释肿瘤细胞如何逃避免疫系统,即:伪装指肿瘤细胞逃避免疫识别,胁迫指其直接或间接干扰免疫效应细胞,细胞保护指其抵抗免疫细胞毒性。图1概述了这三种核心机制的定义及其关键示例。
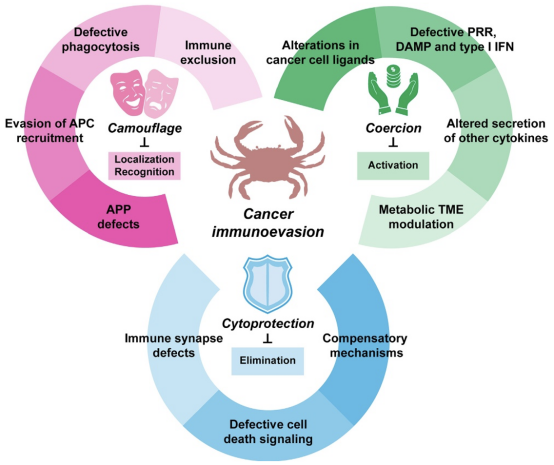
图1.癌症免疫逃避的“三个C”。
伪装
伪装是肿瘤细胞逃避免疫监视的主要策略之一,目的是通过多种机制,使癌细胞在免疫系统的监视下“隐藏”自己,从而避免被免疫效应细胞(如T细胞、NK细胞等)识别并清除。这一策略的核心在于通过改变肿瘤细胞的表面特征或通过分泌抑制性分子,使它们看起来不像恶性细胞,或者减少免疫细胞的识别能力。伪装的机制可以涉及多个方面,包括抗原处理与呈递的缺陷、趋化因子的表达降低以及基质屏障的形成等。图2总结了肿瘤细胞伪装的机制。
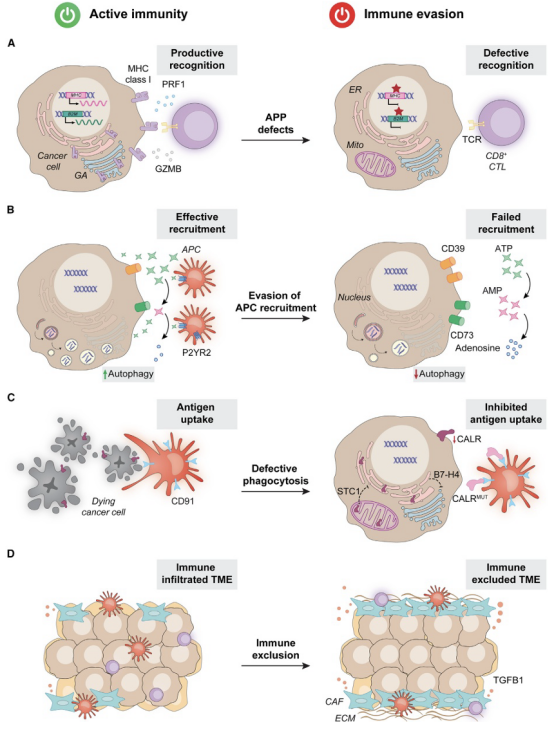
图2.癌症免疫逃避中的伪装。
抗原加工与呈递缺陷
肿瘤细胞通过多种机制破坏其抗原加工与呈递(APP)分子机制,逃避免疫识别 。具体可分为以下几类:
(1)遗传机制:MHC分子或β2-微球蛋白(B2M)基因突变、6p染色体杂合性缺失(LOH)等导致APP缺陷;
(2)表观遗传机制:抑制性组蛋白乙酰化、p三甲基化(EZp, SETDB1)、DNA甲基化减少、MITF/DUX4下调等,均可抑制APP相关基因表达,尤其在癌症干细胞(CSCs)中 。表观遗传修饰是可逆的,为药物干预提供了潜力;
(3)翻译后机制:NBR1自噬受体导致MHC I类分子降解,PCSK9促进MHC I类溶酶体降解,AML细胞通过泛素-蛋白酶体系统降解MHC I类分子;
(4)临床相关性:MHC I类分子下调是免疫治疗获得性耐药的常见机制 。APP缺陷的伪装机制可能具有“双刃剑”效应,MHC I类下调逃避CTLs,但可能激活NK细胞,促使肿瘤发展出新的“胁迫”机制 。
逃避APC的招募
恶性细胞通过多种机制逃避APC的招募,从而在肿瘤微环境(TME)中创造出有利于其生存和扩展的免疫逃逸环境。这一过程通常涉及多种细胞因子、免疫抑制性分子以及肿瘤细胞与免疫细胞之间的复杂相互作用,以下是几种常见的逃逸策略。
趋化因子释放缺陷
癌细胞抑制免疫原性细胞死亡(ICD)相关的ATP和ANXA1释放,例如通过上调CD39/CD73将ATP转化为免疫抑制性腺苷。自噬失活也会损害ATP分泌 。此外,I型IFN信号传导失败导致CXCL10/CXCL9释放缺陷,影响APC招募。自噬对ICD期间ATP分泌至关重要。ISR激活可增强肿瘤靶向免疫反应,但有时也与MHC I类分子抗原呈递抑制等有害表型相关 。
ICD驱动的吞噬功能缺陷
肿瘤细胞通过干扰钙网蛋白(CALR)在细胞表面的暴露,阻止APC对其进行吞噬,从而实现伪装。逃避策略包括下调CALR表达、CALR线粒体滞留(STC1过表达)、B7-p上调抑制eIF2α磷酸化、分泌截短CALR竞争性抑制CD91结合。CALR暴露缺陷与免疫逃逸相关,而改善CALR外化则增强免疫原性。
免疫排斥
免疫排斥通过在TME中形成物理屏障,阻止免疫效应细胞浸润。主要参与细胞包括:癌症相关成纤维细胞(CAFs)通过TGFB1限制CTLs浸润,肿瘤相关巨噬细胞(TAMs)和肿瘤相关中性粒细胞(TANs)也促进排斥 。除了胶原蛋白丰度的改变,胶原蛋白的空间排列(如DDR1促进平行排列)也影响免疫细胞的可及性 。另外,CTNNB1/WNT信号、CDK4/6信号、PIK3CB、RIPK2和PIN1等也参与排斥;缺氧微环境可促进CAF富集和胶原沉积;免疫排斥与免疫抑制细胞分泌物紧密关联。因此,克服排斥需同时靶向物理屏障和免疫抑制性细胞 。
胁迫
胁迫是指肿瘤细胞在被免疫系统定位和识别为恶性后,通过直接或间接干扰免疫效应细胞的活性,从而阻止免疫细胞激活。图3总结了癌症免疫逃避中胁迫的机制。
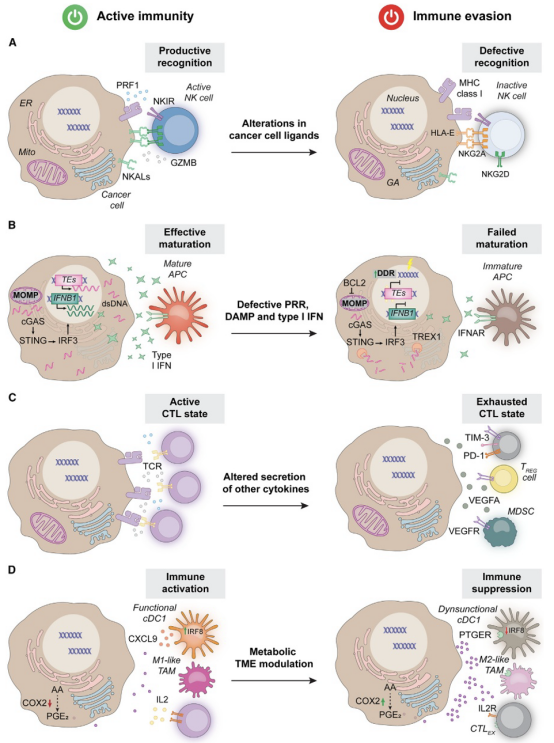
图3.癌症免疫逃避中的胁迫。
免疫调节配体的改变
大多数肿瘤细胞的表面表型发生改变,这包括MHC水平降低以支持伪装,以及免疫细胞受体配体表达的变化,这些配体具有免疫刺激或免疫抑制作用。
PD-L1
CD274(即PD-L1)是肿瘤细胞最主要的直接胁迫配体,通过与共抑制受体PD-1相互作用,抑制CD8 CTLs、NK细胞和髓系细胞的功能。PD-L1的表达受IFNG诱导,是生理性免疫反应消退的一部分。PD-L1表达受遗传(基因扩增、UTR变异)、表观遗传(启动子去抑制)、翻译(EIF4E激活)和翻译后(JAK1、CMTM6、PIN1)等多层次调控。PD-L1调控的复杂性揭示了多维度干预的潜力。
NK细胞相互作用配体
肿瘤细胞下调NK细胞激活配体(NKALs),如MHC I类多肽相关序列A(MICA)、MHC I类多肽相关序列B(MICB)和UL16结合蛋白(ULBPs),来逃避NK细胞的清除。HLA-E与NKG2A(KLRC1)的相互作用已成为单克隆抗体monalizumab的开发靶点。
其他免疫调节配体
CD155(抑制TIGIT)、LILRB4、B7-p、LGALS9(抑制TIM-3)、CD47(抑制吞噬)、CD24等表面蛋白也被恶性细胞用于胁迫免疫细胞。免疫检查点抑制剂(ICI)耐药性源于免疫逃逸机制的冗余性,需同时或序贯靶向这些新兴免疫检查点。
PRR、DAMP和I型IFN信号传导缺陷
许多恶性细胞中DAMP和细胞因子(无论是否与ICD相关)功能失调,导致建立不允许抗肿瘤免疫的微环境。
CGAS-STING1信号缺陷
环状GMP-AMP合酶(CGAS)是胞质双链DNA(dsDNA)的传感器,激活STING1信号引发促炎转录。癌细胞通过癌基因事件(KEAP1缺失、突变p53)、表观遗传机制(STK11缺失、STING1超甲基化、组蛋白甲基化酶)和翻译后修饰(DAPK3缺失、CGAS乙酰化、cGAMP降解)抑制CGAS-STING信号。因此,修复或激活此通路是克服免疫抑制的有效途径。
病毒拟态受损
恶性细胞阻止或补偿胞质中内源性dsDNA积累,限制I型IFN反应。包括:DNA损伤反应(DDR)组分(PARP1、ATR、ATM)阻止CGAS-STING信号;通过DNA和组蛋白甲基转移酶沉默内源性逆转录病毒(ERVs)和转座元件(TEs);维护线粒体完整性(BCL2、线粒体自噬);胞质核酸酶(TREX1)主动降解核酸。
DAMP信号缺陷
DAMPs是细胞损伤或死亡时释放的分子,它们能激活免疫反应,尤其是通过PRRs(模式识别受体)激活的免疫反应。然而,肿瘤细胞常常通过降低或改变DAMPs的表达,来避免被免疫系统识别。例如,肿瘤细胞可能下调高迁移率族蛋白B1(HMGB1)等典型的DAMPs分子,这些分子在免疫反应中起到重要的作用。缺乏这些DAMPs的提示信号使得免疫细胞无法及时识别和反应,进一步促进肿瘤微环境的免疫逃逸。
凋亡信号传导
肿瘤细胞利用凋亡(caspase调节的细胞死亡)阻止抗癌免疫启动。凋亡后caspases(CASP3、CASP9)抑制MOMP驱动的I型IFN分泌,并促进巨噬细胞快速清除垂死细胞(免疫沉默过程)。
慢性I型干扰素信号传导
与急性炎症(促免疫监视)不同,恶性细胞利用I型干扰素信号支持局部免疫抑制和加速疾病进展。慢性I型IFN信号促进CSCs干性、疾病进展和免疫逃逸。因此,治疗目标应是诱导急性、有效的抗肿瘤炎症,同时避免或逆转慢性、低度的免疫抑制性炎症。
其他细胞因子分泌的改变
在多种肿瘤中,免疫逃逸机制不仅包括癌细胞通过改变抗原呈递的方式来避免被免疫系统识别,还涉及癌细胞通过调控细胞因子的分泌来塑造免疫微环境,进一步增强其免疫逃逸能力。癌细胞通过改变其分泌,能够影响免疫反应的性质,进而逃避免疫监视。具体来说,这些细胞因子的变化主要体现在以下两方面。
抗炎细胞因子的分泌
前列腺癌分泌CCL2招募免疫抑制性M2样TAMs和TREG细胞,促进肿瘤播散。PDAC分泌大量CCL5招募TREG细胞,从而在TREG细胞募集时建立局部免疫抑制。TGFB1在多种肿瘤中广泛存在,具有强大的免疫抑制作用。肿瘤来源的CXCL8与M-MDSCs和PMN-MDSCs对TME的募集有关,导致T细胞反应受抑制。IL33的免疫抑制作用在肺癌、乳腺癌和黑色素瘤模型中被证实。VEGFA不仅促血管生成,也介导显著免疫抑制功能,促进TREG细胞扩增和T细胞耗竭。
除I型IFN外的促炎细胞因子释放缺陷
乳腺癌、结直肠癌和肺癌细胞释放有限白细胞介素1B(IL1B),抑制肿瘤浸润性ILC3s的激活。IL10分泌型巨噬细胞与抗癌免疫受损相关,但强效IL10信号可增强CD8 CTLs抗肿瘤功能。细胞因子网络复杂,因此,治疗需精确调控。
肿瘤微环境的代谢调节
在肿瘤微环境(TME)中,癌细胞的代谢重编程不仅支持其增殖、存活和转移,还通过多种机制积极促进免疫抑制。这种代谢的改变使得癌细胞能够有效地逃避宿主的免疫监视,从而为肿瘤的生长和扩展提供支持。以下是癌细胞代谢重编程如何通过多种途径调节免疫环境的几个关键方面。
ATP和腺苷
细胞外ATP水解和腺苷积累主要通过胁迫介导免疫抑制。多数肿瘤表达增加的CD39和CD73,导致腺苷能信号传导,强效限制TCR信号和IFNG产生。
犬尿氨酸
色氨酸降解为犬尿氨酸是TME中免疫抑制突出机制,由吲哚胺2,3-双加氧酶1(IDO1)或色氨酸2,3-双加氧酶(TDO2)催化。犬尿氨酸通过AHR信号促进M2样TAMs和TREG细胞招募,并诱导肿瘤细胞休眠。尽管多项II期临床试验结果令人鼓舞,但IDO1抑制剂临床试验结果不佳。
葡萄糖和谷氨酰胺
TME中营养底物(特别是葡萄糖和谷氨酰胺)代谢竞争影响抗肿瘤免疫。例如,卵巢癌细胞消耗葡萄糖限制CD8 CTLs利用。因此,拮抗谷氨酰胺代谢可促进效应T细胞激活。
乳酸
多数恶性细胞产生大量乳酸,促进TME酸化,抑制免疫效应细胞增殖和功能。乳酸还促进M2样TAMs极化和TREG细胞功能。
其他TCA循环中间产物
肿瘤细胞TCA循环重编程,导致免疫抑制性代谢物积累,如富马酸抑制CTLs细胞毒性。乙酸积累可支持CTLs增殖。D-2HG为一种癌代谢物,能够抑制表观遗传调节因子。
酮体
人类CRC常表现生酮作用降低,导致CXCL12释放,招募免疫抑制细胞。有研究表明,生酮饮食可恢复免疫监视。
蛋氨酸和丝氨酸
癌细胞过度消耗蛋氨酸,限制免疫细胞利用,导致效应基因表观遗传抑制。S-腺苷蛋氨酸(SAM)和其他蛋氨酸代谢副产物(如5-甲基硫代腺苷(MTA))的积累也被报道通过促进T细胞衰竭介导免疫抑制作用。
脂质
肿瘤细胞脂质代谢重编程促进免疫逃逸。卵巢癌细胞中脂肪酸合酶(FASN)上调损害肿瘤浸润性DC交叉呈递活性。CD36促进TREG细胞免疫抑制功能。
生物活性脂质
癌细胞可通过向TME释放PGE2和溶血甘油磷脂(LPC、LPA),从而介导多方面的免疫抑制。
维生素和视黄酸
维生素及其衍生物可通过影响各种免疫效应细胞来调节抗癌免疫。例如,胰腺癌细胞限制NK细胞对维生素B6的利用,肉瘤细胞过量产生视黄酸(RA),促进免疫抑制性TAMs积累。
钾离子
离子通道,尤其是钾通道,调节着T细胞功能。死亡黑色素瘤细胞释放的胞外高浓度钾离子损害CTLs功能,抑制mTORC1信号。此外,环境钾离子水平升高会抑制效应T细胞的营养摄取,导致自噬反应激活,同时组蛋白乙酰化供体(如乙酰辅酶A)可用性降低,并随之效应分子下调。
细胞保护
细胞保护是指恶性细胞抵抗免疫效应分子(如穿孔素1、颗粒酶B、肿瘤坏死因子或干扰素γ)杀伤的能力。图4总结了癌症免疫逃避中细胞保护的机制。
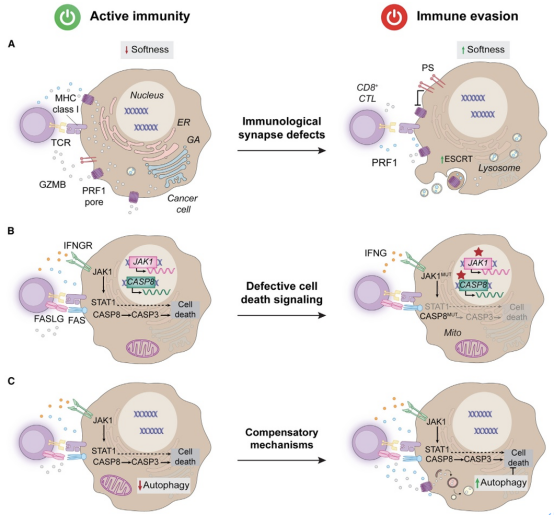
图4.癌症免疫逃避中的细胞保护。
免疫突触的改变
癌细胞通过改变机械特性或主动修复损伤,逃避PRF1和GZMB的细胞毒性 。例如,肿瘤复发细胞(TRCs)的细胞柔软度使其逃避免疫攻击。乳腺癌细胞在免疫突触处肌动蛋白重塑,减少GZMB进入。黑色素瘤细胞增加囊泡运输和分泌降解PRF1。黑色素瘤和CRC细胞利用ESCRT因子修复PRF1孔洞。此外,辐射后癌细胞通过表面暴露PS抑制PRF1。
细胞死亡信号缺陷
对实体瘤患者活检样本的基因组研究显示,CASP8(编码由FAS激活的凋亡caspase)突变频繁。恶性细胞也常通过表观遗传机制下调FAS,增加对NK细胞细胞毒性的抵抗。例如,黑色素瘤和CRC细胞对免疫效应细胞敏感性依赖完整TNF信号。黑色素瘤细胞常表现IFNG信号转导缺陷,导致对IFNG介导杀伤的细胞保护;难治/复发B细胞非霍奇金淋巴瘤患者对CAR T细胞抵抗与BCL2扩增相关。IFNG通过双重机制促进恶性细胞铁死亡。GZMB也被证明可促进GSDME依赖的焦亡。
补偿机制
恶性细胞激活多种细胞范围内的通路,保护自身免受免疫效应细胞的细胞毒性。例如,多种肿瘤类型通过过表达SERPINB9响应CTLs激活;癌细胞,尤其在缺氧条件下,可通过自噬激活增加对IFNG、TNF和GZMB等免疫效应分子的抵抗。自噬在肿瘤免疫中的复杂双重作用值得关注。
其他机制
TGFB1通过SOX4限制恶性细胞对CTLs敏感性,从而促进细胞保护。SRY-box转录因子17(SOX17)为CRC细胞提供细胞保护,部分原因是对IFNG敏感性降低。
针对临床免疫逃逸的新型药理学策略
过去二十年,多种靶向伪装、胁迫和细胞保护的药理学策略已进入临床实践。包括免疫检查点抑制剂(ICI)、CAR T细胞和双特异性抗体、重组细胞因子和TLR激动剂。此外,一些传统抗癌治疗方法也被发现能抑制免疫逃逸。表1总结了与肿瘤免疫逃逸相关的临床研究。
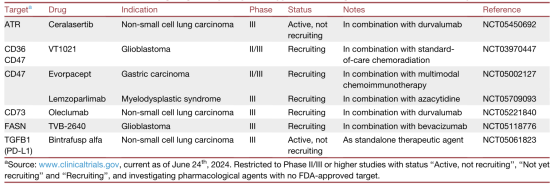
表1.高级临床试验研究概念上的新方法,以靶向癌症患者的癌症免疫逃逸。
抑制共抑制配体的胁迫作用
这一策略主要集中于阻断除PD-1、CTLA4和LAG3之外的共抑制受体,特别是TIM-3、TIGIT、VISTA和NKG2A抑制剂,通常与FDA批准的PD-1或PD-L1阻断剂联合使用。CD47阻断剂,如magrolimab和lemzoparlimab正在临床试验中进行研究。另外,一些SIRPA-Fc融合蛋白,如TTI-622、evorpacept和IMM001正在进行临床评估。
抑制代谢胁迫和抑制细胞因子信号传导
这一临床研究领域侧重于靶向癌细胞代谢重编程驱动的胁迫,并旨在增强免疫刺激性细胞因子信号。例如,谷氨酰胺拮抗剂DRP-104、MCT1抑制剂AZD396、蛋氨酸代谢调节剂(通过SAM给药)、FASN抑制剂TVB-2640、腺苷受体拮抗剂ADORA2A、DDR抑制剂和PRR激动剂(特别是STING激动剂),如ATR抑制剂ceralaser-tib和药理学STING激活剂IMSA101。
同时靶向多个“C”机制
一些正在临床评估中的新型药理学方案旨在同时抑制不同的免疫逃逸机制,这可能在高度异质性肿瘤中提供临床优势。如FDA批准的表观遗传修饰剂,如阿扎胞苷、地西他滨和HDAC抑制剂,同时靶向伪装和胁迫;PRMT5抑制剂和KDM1A抑制剂;CD36和CD47双重抑制剂,如VT1021;CD73拮抗剂,如quemliclustat和oleclumab;BCL2和BCL2L1(BCL-XL)双重抑制剂:如navitoclax;转化生长因子B受体1 (TGFBR1)抑制剂,如vactosertib和双重TGFB1和PD-L1阻断剂bintrafusp alfa。
总结
本综述提出了一个新颖的“三C”概念框架,以分类肿瘤免疫逃逸机制。但其也存在一定的局限性,例如,EZp可同时促进伪装和胁迫;也存在难以纳入框架的机制,如HCC浸润性NK细胞表面缺陷和Y染色体缺失(LOY)。由于肿瘤内部和不同病灶间存在高度异质性,不同区域肿瘤细胞可能通过不同机制逃避免疫,因此,与仅靶向一个“C”相比,同时抑制多种免疫逃逸机制可能效果更优。重要的是,“三C”框架的一些表现已成功用于指导各种肿瘤适应症的临床决策。例如,肿瘤突变负荷(TMB)和PD-L1表达水平常用于指导ICI治疗。但PD-L1阳性肿瘤仍有无反应者,提示需识别互补预测性生物标志物,如IFNG信号传导效能。尽管存在未知因素,本综述提出的“三C”框架有望促进对免疫逃逸这一复杂现象的理解,并指导新型临床相关策略的发现。
述评
这篇文章深入探讨了癌细胞免疫逃逸的机制,提出了“三个C”(Camouflage、Coercion、Cytoprotection)的概念框架,为理解癌症免疫逃逸提供了新的视角,并为未来的癌症治疗策略提供了理论基础。文章首先回顾了“三个E”模型,强调了免疫系统在肿瘤发展过程中的作用,即通过消除、平衡和逃逸三个阶段来处理恶性细胞。作者指出,癌细胞通过免疫逃逸机制来避免被免疫系统识别和清除,这是肿瘤进展的关键环节。文章提出的“三个C”框架,将免疫逃逸机制分为伪装(Camouflage)、胁迫(Coercion)和细胞保护(Cytoprotection)三大类,涵盖了从抗原呈递缺陷到代谢调控等多个方面,系统地总结了癌细胞逃避免疫监视的多种策略。
文章详细讨论了伪装机制,包括抗原处理和呈递缺陷、趋化因子分泌减少以及基质屏障的形成,这些机制使得癌细胞能够避免被免疫细胞识别和攻击。在胁迫机制方面,文章探讨了癌细胞如何通过表达免疫抑制配体(如PD-L1)或分泌免疫抑制代谢物(如腺苷)来抑制免疫细胞的激活和功能。细胞保护机制则涉及癌细胞如何通过增强细胞膜的修复能力或激活抗凋亡途径来抵抗免疫攻击。文章还强调了针对这些免疫逃逸机制的潜在治疗策略,包括免疫检查点抑制剂、代谢调控药物、免疫细胞治疗以及联合治疗策略等。这些策略旨在恢复或增强免疫系统对癌细胞的识别和攻击能力,从而提高癌症治疗的效果。总体而言,这篇文章不仅为癌症免疫逃逸的研究提供了新的理论框架,也为开发新的癌症治疗策略提供了重要的参考。通过深入理解癌细胞的免疫逃逸机制,我们可以更好地设计针对性的治疗方案,提高癌症患者的治疗效果和生存率。
参考文献
Galassi C, Chan TA, Vitale I, Galluzzi L. The hallmarks of cancer immune evasion. Cancer Cell. 2024 Nov 11;42(11):1825-1863. doi: 10.1016/j.ccell.2024.09.010. Epub 2024 Oct 10. PMID: 39393356.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)