首页 > 医疗资讯/ 正文
摘要
偏头痛的三级诊断复发性胃肠道功能紊乱是以反复发作性腹部疼痛和(或)不适、恶心和(或)呕吐且可能与偏头痛有关的一类疾病,与功能性复发性腹痛,一组以腹痛为核心症状的临床综合征,存在临床和神经生物学关联。本综述从二者流行病学特征、性别分布倾向、临床过程、辅助检查及治疗反应等多方面的高度相似性,以及病理生理方面的3种潜在机制进行了总结分析。功能性复发性腹痛与偏头痛的这种密切联系提示,尽管无确切证据,成人功能性复发性腹痛,或至少其某特定亚群,可能属于偏头痛谱系疾病。即功能性反复发作性腹痛即使不伴头痛,其本身就可能是一种“偏头痛现象”。将来有必要对两者的关系进行更加严谨设计的观察研究,以明确这种可能性,为功能性复发性腹痛和偏头痛患者的诊断、治疗提供强有力的支持证据,早日解除患者病痛。
关键词:功能性复发性腹痛;偏头痛;中枢敏化;肠-脑轴
Key words:Functional recurrent abdominal pain;Migraine;Central sensitization;Gut-brain axis
偏头痛(migraine)是一种临床常见的原发性头痛,典型表现为伴恶心和(或)呕吐、畏光和畏声的反复发作的中重度单侧搏动性头痛[1],部分患者可伴有腹痛、腹泻、呕吐、厌食等胃肠道症状。早在1922年,Brams就首次提出“腹型偏头痛(abdominal migraine, AM)”[2],此后有关腹痛与偏头痛相关性的研究报道不断增加。第三版国际头痛分类(The International Classification of Headache Disorders-3, ICHD-3)[3]将AM归于可能与偏头痛有关的周期性综合征(1.6 Episodic syndromes that may be associated with migraine)之复发性胃肠道功能紊乱(1.6.1 Recurrent gastrointestinal disturbance),用以描述反复发作性腹部疼痛和(或)不适、恶心和(或)呕吐且可能与偏头痛有关的一类疾病。
临床上,以腹痛为核心症状的一组临床综合征多于急诊、消化科就诊,被称为功能性复发性腹痛疾病(functional recurrent abdominal pain disorders, FRAP),典型表现为反复发作、性质多样的腹痛,常伴随一系列令人困扰的消化道和全身症状,如恶心、呕吐、腹胀、排便习惯紊乱、食欲减退、早饱感、疲劳以及显著的情绪低落[4]。根据最新的功能性胃肠病(functional gastrointestinal disorders,FGID)罗马Ⅳ诊断标准[5],成人FRAP包括上腹痛综合征(B1b)、肠易激综合征(便秘/腹泻/混合型,C1)、非特异性功能性肠病(C5)以及具有重要神经调控意义的中枢介导的腹痛综合征(CAPS,D1)。而在儿童分类中,则直接命名为功能性腹痛病(FAPD),涵盖功能性消化不良(H2a)、肠易激综合征(H2b)、腹型偏头痛(H2c)和非其他特指型功能性腹痛(H2d)(见表1)。与偏头痛类似,FRAP的发病机制尚不清楚,但复杂的肠-脑轴(gut-brain axis)功能紊乱似乎发挥核心作用[6]。

本文以“功能性复发性腹痛”“偏头痛”“成人”作为中文关键词,以“Functional Recurrent Abdominal Pain”“Migraine”“Adults”作为英文关键词,在中国知网、万方数据知识服务平台、PubMed、Web of Science数据库中检索与功能性复发性腹痛和偏头痛相关的中英文文献,检索时限为建库至2025年6月。综述了功能性复发性腹痛和偏头痛之间的关系,并对可能存在的潜在病理生理机制进行假设。
1 功能性复发性腹痛疾病与偏头痛:临床特点的重叠与关联
1.1 流行病学与人群特征
FRAP与偏头痛均为临床常见疾病。最近的全球儿童FRAP的流行病学荟萃分析显示[7],其总患病率为11.7%,而偏头痛在全球人群中的患病率约为14%[8],两者的总体患病率相近。同时FRAP患者偏头痛发生率约为31%,显著高于普通人群的13.8%[9]。我国2005年的一项针对肠易激综合征患儿的研究也得到相似结果,即肠易激综合征患儿合并头痛的比例明显高于正常儿童(32.68% vs 14.32%)[10]。偏头痛患者群体中,FRAP发生率也远高于健康对照人群(32% vs 18%)[11]。除上述横断面研究外,针对FRAP患儿的纵向随访研究发现,约1/3的患者成年后腹痛症状逐渐缓解,另有约1/3会发展为典型的偏头痛[9,12],但仍有部分患者(约21%)持续存在复发性腹痛[12]。Kurth等[13]对成人偏头痛的研究发现,80.9%的偏头痛患者在过去1年曾患特发性上腹痛,而25.5%者为功能性周期性腹痛,明显高于正常对照人群。Hajj等[14]对143例18岁以上偏头痛患者的观察显示,34.3%的患者同时伴有肠易激综合征;亦有研究提示FRAP患者群体普遍存在显著的偏头痛家族史[15]。
青春期前,偏头痛患病率男女基本一致;而青春期后女性患病率逐渐增高,女性与男性的患病比例约2∶1[16]。而FRAP亦存在明显的女性易感倾向,Meta分析显示,儿童肠易激综合征女性患病率为男性的1.08~2.11倍,而成人功能性胃肠道疾病(包括肠易激综合征)女性与男性比例在1.17∶1~3.26∶1之间[7,17,18]。有学者认为这可能与女性和男性之间的激素谱差异有关[19],与偏头痛女性发病优势类似。这种内脏高敏感(visceral hypersensitivity)状态可能是以腹痛为主的功能性胃肠病的核心发病机制之一[20,21]。
1.2 临床表现
尽管FRAP以腹痛为核心症状,而偏头痛以头痛为主要表现,均可伴有明显的恶心、呕吐等胃肠道症状,但二者均为典型的发作-缓解模式,症状并非持续存在,而是以界限相对清晰的“发作期”和“缓解期/间歇期”交替为特征。在发作期和(或)发作后,普遍经历疲劳,易怒、情绪低落等情绪改变。在无症状的间歇期,患者通常感觉良好,功能状态基本恢复。FRAP常见的诱因有焦虑、抑郁、压力、睡眠质量差、消极生活事件等[7,18],亦常为偏头痛发作的诱因[22]。FRAP与偏头痛高度相似的临床过程可能说明反复发作的腹痛在发病机制上与典型偏头痛密切相关。
1.3 辅助检查
FRAP作为一种功能性疾病,需严格排除器质性病变。而偏头痛作为一种原发性头痛,一般不推荐进行常规脑电图、头部影像学等筛查[23]。Hoffman等[24]发现约50%功能性消化不良患者存在胃电图异常,47%存在胃排空延迟,腹型偏头痛患儿同样可表现胃排空减慢和胃窦运动减弱[25,26]。可能与这部分患者促进肠道平滑肌收缩的肠神经系统神经元功能障碍或丧失,进而导致胃肠运动障碍有关[27];偏头痛患者在急性发作期和间歇期均可能存在显著的胃排空延迟和幽门张力增高[28,29],其潜在机制可能与偏头痛发作时交感神经系统兴奋,抑制胃肠蠕动有关。胃肠动力障碍不仅是两病共有改变,还可能通过改变内脏敏感性、增加肠道通透性及扰乱肠道菌群-宿主互作等途径,反向加剧中枢神经系统敏化和疼痛感知[30],形成“肠-脑轴”恶性循环。FRAP中部分IBS患者存在脑电图功能异常,多表现为慢波活动异常增多,与健康对照相比差异有统计学意义,类似脑电图异常在儿童[31]和成人[32]AM患者中同样存在。偏头痛患者亦存在异于健康人群的EEG改变,尽管其意义不明[33]。FRAP与偏头痛患者胃肠动力与神经电活动异常的相似性提示二者可能有类似的病理生理过程。
1.4 治疗策略
偏头痛的治疗包括急性发作期与预防性治疗。急性期用药核心目标为快速终止头痛发作,同时控制伴随症状(如恶心、呕吐、畏光、畏声),预防性治疗目的是降低头痛发作频率、强度及持续时间,减少急性药物使用,提高生活质量。需与患者充分沟通,根据个体情况、药物疗效、患者经济状况等综合考虑[1]。FRAP治疗的一般原则是基于良好的医患沟通,医生根据患者临床表现、严重程度以及生物社会心理学等综合考虑[34]。
曲坦类作为偏头痛急性期特异性治疗药物,在AM急性腹痛发作中同样展现止痛效果[35],更具临床意义的是,学者提出成年FRAP患者若出现腹部症状对曲普坦类药物的快速阳性反应,可作为支持AM诊断的重要参考依据[36]。
氟桂利嗪广泛用于成人和儿童偏头痛的预防[23],亦可显著降低腹型偏头痛患者腹痛发作频率并缩短持续时间[37]。赛庚啶是一种抗组胺药,传统应用于儿童偏头痛治疗,Sadeghian等[38]通过双盲安慰剂对照试验证实其可显著改善FRAP患儿的腹痛发作频率及强度。后续的研究亦支持此结果,其作用机制可能与调控肠道5-羟色胺信号通路有关,通过拮抗肠道5-HT受体改善胃肠动力障碍与内脏高敏感性[39]。雷尼替丁传统上用于抑制胃酸分泌治疗胃肠疾病,研究发现其对偏头痛患者同样具有疗效,这一现象提示胃肠道黏膜炎症可能不仅是FRAP发病的关键机制,亦参与偏头痛的病理进程[40]。益生菌疗法通过调节肠道微生态平衡、增强肠黏膜屏障功能、抑制病原体定植及调控肠道免疫反应等多途径改善肠道稳态[41]。临床研究证实,益生菌干预可显著提升偏头痛患者生活质量并降低发作频率[42]。其潜在作用机制可能在于:针对偏头痛发病中存在的肠道通透性增加及低度全身炎症状态,益生菌通过增强肠黏膜屏障、调节免疫细胞活性及降低循环促炎因子水平,从而减轻神经血管炎症反应,最终减少头痛发作的频率与强度[43]。上述证据共同指向肠道微环境调控在偏头痛治疗中的潜在价值。
2 功能性复发性腹痛与偏头痛:潜在的共享病理生理学机制
2.1 中枢敏化和内脏高敏感性
在FRAP的发病机制中,内脏高敏感是一个核心环节。它主要表现为内脏传入通路敏感性异常增高,导致患者对肠道生理性刺激(如正常蠕动、轻微扩张)产生过度疼痛感知[20]。研究明确显示,与健康人群相比,存在内脏高敏感的FRAP患者,其对肠道疼痛刺激的感觉阈值显著降低[21]。这意味着,在相同强度的刺激下,患者更易感受到疼痛。这种异常敏感状态不仅局限于肠道局部,更反映中枢神经系统的功能失调,即中枢敏化(central sensitization)[44]。功能性头部磁共振成像研究为这一观点提供了有力支持。数据显示,成年FRAP患者在与疼痛处理相关的皮质区域(如前扣带回皮质、岛叶、体感皮质)中,其代谢活动呈现显著增强[45]。另一方面,偏头痛是一种原发性脑功能障碍,是对感觉刺激(如光、声、气味)存在发作间歇期持续性高敏状态(即中枢敏化),这种状态为疼痛通路的异常激活奠定了基础[46],偏头痛发作的关键事件是三叉神经-血管疼痛通路的激活和敏化。中枢敏化在此过程中扮演了“放大器”角色,它通过增强大脑和脊髓感觉处理通路的活性,导致感觉知觉被放大或扭曲,最终表现为疼痛阈值系统性降低和剧烈头痛[47]。也可能同时或选择性地降低内脏感觉通路的阈值。换言之,即便在没有明显胃肠道器质性病变的情况下,患者也可能因内脏传入信号在中枢被异常放大而感受到剧烈的腹痛。这解释了为何两者在临床表型、诱发因素和治疗反应上存在高度重叠。
2.2 肠-脑轴
肠-脑轴(gut-brain axis)是指胃肠道系统和中枢神经系统之间的复杂的双向信息交换网络。其核心在于“双向调控”。大脑通常调节胃肠道的运动、感觉和分泌功能。激素因子通过下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenalaxis,HPA)介导应激反应而影响肠道功能。另一方面,胃肠道并非被动接受指令,其本身是一个强大的信号发生器。肠道菌群及其代谢产物、肠源性激素、肠道感觉神经元信号以及免疫细胞释放的细胞因子等,均可作为重要信号上行影响中枢神经系统的功能与状态[30]。这种双向沟通并非直接进行,而是通过多重生物介质实现,主要包括如炎症介质、肠道微生物群、神经肽、激素和营养物质[30]。肠-脑轴双向作用流程图见图1。偏头痛发作通过HPA轴、自主神经系统(autonomic nervous system,ANS)影响胃肠动力、胃肠黏膜分泌及通透性。相反,胃肠道的改变包括菌群失调、通透性增加也可以通过ANS传入、免疫信号反馈影响中枢神经系统,从而参与偏头痛发生[30,48]。肠道菌群还可通过多种途径影响5-羟色胺、降钙素基因相关肽(calcitonin gene-related peptide,CGRP)等神经肽从而间接参与偏头痛的病理生理机制[49]。在FRAP中,中枢神经系统的应激、情绪障碍(焦虑、抑郁)通过ANS和HPA轴影响肠道菌群/屏障功能[6];反之,异常的胃肠信号传入中枢神经系统,影响情绪和感觉处理。例如肠道微生物能够产生人脑中发现的大多数神经递质。虽然这些神经递质主要在肠道局部起作用,调节肠道神经系统,但也有不可否认的证据表明肠道微生物可以通过多种机制影响中枢神经系统[50]。综上,偏头痛相关的中枢神经系统功能紊乱(如HPA轴失调、ANS失衡)可直接干扰肠-脑轴稳态,导致胃肠运动紊乱、内脏高敏感,最终表现为功能性腹痛。反之,FRAP相关的慢性腹痛和应激也可通过持续激活“肠-脑”伤害性传入和神经免疫信号,诱发或加重偏头痛发作。
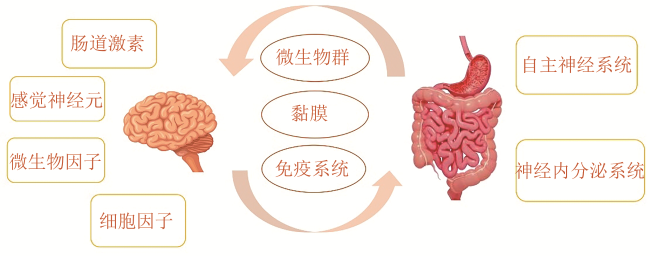
图1 肠-脑轴双向作用流程图
2.3 神经肽的共同参与
CGRP已被确认为偏头痛发病机制中的关键介质。其在偏头痛发作中参与多个核心病理生理环节,可触发三叉神经血管系统的神经源性炎症和脑血管扩张,靶向CGRP或其受体的治疗已经显示出在急性或预防治疗偏头痛的疗效[50]。值得注意的是,CGRP及其受体同样广泛分布于整个胃肠道系统,参与内脏感觉传导、炎症和动力调节。动物研究的证据表明CGRP在维持胃肠道黏膜完整性中的作用。在一项针对小鼠研究中,已证实当小鼠肠道被沙门氏菌感染时,CGRP和其他神经肽会影响宿主肠道防御[51]。CGRP还参与调节大鼠胃排空和胃肠道功能[52]。CGRP在肠-脑轴双向通信中的作用已得到广泛认可[33]。
3 总结与展望
偏头痛和FRAP患者均可因反复发作性症状,常成为急诊科、神经内科或消化内科的高频就诊人群。基于现有研究,二者在流行病学特征、性别分布倾向、临床过程、辅助检查及治疗反应等多方面呈现高度相似性;从病理生理机制层面解析,这种关联性可通过中枢敏化机制异常、肠-脑轴双向调控紊乱以及神经肽失调等共性通路得到合理解释。尽管无确切证据,但FRAP与偏头痛的这种密切联系提示,成人FRAP,或至少其某种特定亚群,可能属于偏头痛谱系疾病。即功能性反复发作性腹痛即使不伴头痛,其本身就可能是一种“偏头痛现象”。将来有必要对两者的关系进行更加严谨设计的观察研究,以明确这种可能性,为功能性复发性腹痛和偏头痛患者的诊断、治疗提供强有力的支持证据,早日解除患者病痛。
参考文献
[1] 中国医师协会神经内科医师分会,中国研究型医院学会头痛与感觉障碍专业委员会.中国偏头痛诊治指南(2022版)[J]. 中国疼痛医学杂志,2022,28(12):881-898.
[2] Brams WA. Abdominal migraine[J]. JAMA, 1922,78(1):26-27.
[3] Headache classification committee of the international headache society (IHS) the international classification of headache disorders, 3rd edition[J]. Cephalalgia, 2018, 38(1): 1-211.
[4] Brusaferro A, Farinelli E, Zenzeri L, et al. The management of paediatric functional abdominal pain disorders: latest evidence[J]. Paediatr Drugs, 2018, 20(3): 235-247.
[5] Drossman DA, Hasler WL. Rome IV-functional GI disorders: disorders of gut-brain interaction[J]. Gastroenterology, 2016, 150(6): 1257-1261.
[6] Cryan JF, Dinan TG. Mind-altering microorganisms: the impact of the gut microbiota on brain and behaviour[J]. Nat Rev Neurosci, 2012, 13(10): 701-712.
[7] Vermeijden NK, de Silva L, Manathunga S, et al. Epidemiology of pediatric functional abdominal pain disorders: a meta-analysis[J]. Pediatrics, 2025, 155(2): e2024067677.
[8] Ashina M, Katsarava Z, Do TP, et al. Migraine: epidemiology and systems of care[J]. Lancet, 2021, 397(10283): 1485-1495.
[9] Marugán JM, Fernández-Castaño MT, del Carmen Torres M, et al. The functional recurrent abdominal pain (RAP) in children may be the precursor of adult migraine[J]. Cephalalgia, 2008, 28(5): 571-572; authorreply572.
[10] Zhou H, Li D, Cheng G, et al. An epidemiologic study of irritable bowel syndrome in adolescents and children in South China: a school-based study[J]. Child Care Health Dev, 2010, 36(6): 781-786.
[11] Gal JL, Michel JF, Rinaldi VE, et al. Association between functional gastrointestinal disorders and migraine in children and adolescents: a case-control study[J]. Lancet Gastroenterol Hepatol, 2016, 1(2): 114-121.
[12] Dignan F, Abu-Arafeh I, Russell G. The prognosis of childhood abdominal migraine[J]. Arch Dis Child, 2001, 84(5): 415-418.
[13] Kurth T, Holtmann G, Neufang-Hüber J, et al. Prevalence of unexplained upper abdominal symptoms in patients with migraine[J]. Cephalalgia, 2006, 26(5): 506-510.
[14] Hajj A, Mourad D, Ghossoub M, et al. Uncovering demographic, clinical, triggering factors similarities between migraine and irritable bowel syndrome: a prospective study[J]. J Nerv Ment Dis, 2019, 207 (10): 847-853.
[15] Symon DN, Russell G. Abdominal migraine: a childhood syndrome defined[J]. Cephalalgia, 1986, 6(4): 223-228.
[16] GBD 2016 Headache Collaborators. Global, regional, and national burden of migraine and tension-type headache, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016[J]. Lancet Neurol, 2018, 17(11): 954-976.
[17] Devanarayana NM, Mettananda S, Liyanarachchi C, et al. Abdominal pain-predominant functional gastrointestinal diseases in children and adolescents: prevalence, symptomatology, and association with emotional stress[J]. J Pediatr Gastroenterol Nutr, 2011, 53(6): 659-665.
[18] Zia JK, Lenhart A, Yang PL, et al. Risk factors for abdominal pain-related disorders of gut-brain interaction in adults and children: a systematic review. Gastroenterology, 2022, 163 (4): 995-1023.e3.
[19] Heitkemper MM, Jarrett ME. Update on irritable bowel syndrome and gender differences[J]. Nutr Clin Pract, 2008, 23(3): 275-283.
[20] Di Lorenzo C, Youssef NN, Sigurdsson L, et al. Visceral hyperalgesia in children with functional abdominal pain[J]. J Pediatr, 2001, 139(6): 838-843.
[21] Koloski NA, Jones M, Talley NJ. Evidence that independent gut-to-brain and brain-to-gut pathways operate in the irritable bowel syndrome and functional dyspepsia: a 1-year population-based prospective study[J]. Aliment Pharmacol Ther, 2016, 44(6): 592-600.
[22] Abu-Arafeh I, Russell G. Prevalence and clinical features of abdominal migraine compared with those of migraine headache[J]. Arch Dis Child, 1995, 72(5): 413-417.
[23] 孙莹茹,王皓缘,周婉茹,等.中国偏头痛诊治指南(2022版)解读[J].中华疼痛学杂志, 2023, 19(06):913-920.
[24] Hoffman I, Vos R, Tack J. Assessment of gastric sensorimotor function in paediatric patients with unexplained dyspeptic symptoms and poor weight gain[J]. Neurogastroenterol Motil, 2007, 19(3): 173-179.
[25] Devanarayana NM, Rajindrajith S, Benninga MA. Abdominal migraine in children: association between gastric motility parameters and clinical characteristics[J]. BMC Gastroenterol, 2016, 16: 26.
[26] Tan V, Sahami AR, Peebles R, et al. Abdominal migraine and treatment with intravenous valproic Acid[J]. Psychosomatics, 2006, 47(4): 353-355.
[27] Mertz HR. Overview of functional gastrointestinal disorders: dysfunction of the brain-gut axis[J]. Gastroenterol Clin North Am, 2003, 32(2): 463-476, v.
[28] Aurora SK, Kori SH, Barrodale P, et al. Gastric stasis in migraine: more than just a paroxysmal abnormality during a migraine attack[J]. Headache, 2006, 46(1): 57-63.
[29] Aurora SK, Papapetropoulos S, Kori SH, et al. Gastric stasis in migraineurs: etiology, characteristics, and clinical and therapeutic implications[J]. Cephalalgia, 2013, 33(6): 408-415.
[30] LenglarT L, Caula C, Moulding T, et al. Brain to belly: abdominal variants of migraine and functional abdominal pain disorders associated with migraine[J]. J Neurogastroenterol Motil, 2021, 27(4): 482-494.
[31] Nomura T, Fukudo S, Matsuoka H, et al. Abnormal electroencephalogram in irritable bowel syndrome[J]. Scand J Gastroenterol, 1999, 34(5): 478-484.
[32] Yang PL, Kamp KJ, Tu Q, et al. Relationship between high frequency component of heart rate variability and delta EEG power during sleep in women with irritable bowel syndrome compared to healthy women[J]. Biol Res Nurs, 2025, 27(1): 60-70.
[33] Ouyang CS, Chiang CT, Yang RC, et al. Quantitative electroencephalogram analysis of frontal cortex functional changes in patients with migraine[J]. Kaohsiung J Med Sci, 2020, 36(7): 543-551.
[34] Black CJ, Drossman DA, Talley NJ, et al. Functional gastrointestinal disorders: advances in understanding and management[J]. Lancet, 2020, 396(10263): 1664-1674.
[35] 赵万年, 焦倩, 焦胜先, 等. 成人腹型偏头痛病例报告及文献综述[J]. 中国疼痛医学杂志, 2023, 29(5): 381-386.
[36] Roberts JE, DeShazo RD. Abdominal migraine, another cause of abdominal pain in adults[J]. Am J Med, 2012, 125(11): 1135-1139.
[37] Boccia G, Del Giudice E, Crisanti AF, et al. Functional gastrointestinal disorders in migrainous children: efficacy of flunarizine[J]. Cephalalgia, 2006, 26(10): 1214-1219.
[38] Sadeghian M, Farahmand F, Fallahi GH, et al. Cyproheptadine for the treatment of functional abdominal pain in childhood: a double-blinded randomized placebo-controlled trial[J]. Minerva Pediatr, 2008, 60(6): 1367-1374.
[39] Krasaelap A, Madani S. Cyproheptadine: a potentially effective treatment for functional gastrointestinal disorders in children[J]. Pediatr Ann, 2017, 46(3): e120-e125.
[40] Mavromichalis I. A causal link between recurrent abdominal pain and migraine[J]. J Pediatr Gastroenterol Nutr, 1997, 24(3): 365-366.
[41] Korterink J, Devanarayana NM, Rajindrajith S, et al. Childhood functional abdominal pain: mechanisms and management[J]. Nat Rev Gastroenterol Hepatol, 2015, 12(3): 159-171.
[42] Sensenig J, Johnson M, Staverosky T. Treatment of migraine with targeted nutrition focused on improved assimilation and elimination[J]. Altern Med Rev, 2001, 6(5): 488-494.
[43] de Roos NM, Giezenaar CT, Rovers JP, et al. The effects of the multispecies probiotic mixture Ecologic®Barrier on migraine: results of an open-label pilot study[J]. Benef Microbes, 2015, 6(5): 641-646.
[44] Keszthelyi D, Troost FJ, Masclee AA. Irritable bowel syndrome: methods, mechanisms, and pathophysiology. Methods to assess visceral hypersensitivity in irritable bowel syndrome[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 303(2): G141-G154.
[45] Kakotrichi A, Borrelli O, Thapar N. The evaluation and management of recurrent abdominal pain in childhood[J]. Paediatr Child Health, 2016, 26(10): 433-440.
[46] Vecchia D, Pietrobon D. Migraine: a disorder of brain excitatory-inhibitory balance?[J]. Trends Neurosci, 2012, 35(8): 507-520.
[47] Charles A. The evolution of a migraine attack - a review of recent evidence[J]. Headache, 2013, 53(2): 413-419.
[48] Karakan T, Ozkul C, Akkol EK, et al. Gut-brain-microbiota axis: antibiotics and functional gastrointestinal disorders[J]. Nutrients, 2021, 13(2): 389.
[49] Tanaka M, Szabó Á, Körtési T, et al. From CGRP to PACAP, VIP, and beyond: unraveling the next chapters in migraine treatment[J]. Cells, 2023, 12(22): 2649.
[50] De Matteis E, Guglielmetti M, Ornello R, et al. Targeting CGRP for migraine treatment: mechanisms, antibodies, small molecules, perspectives[J]. Expert Rev Neurother, 2020, 20(6): 627-641.
[51] Ailani J, Kaiser EA, Mathew PG, et al. Role of calcitonin gene-related peptide on the gastrointestinal symptoms of migraine-clinical considerations: a narrative review[J]. Neurology, 2022, 99(19): 841-853.
[52] Haanes KA, Edvinsson L, Sams A. Understanding side-effects of anti-CGRP and anti-CGRP receptor antibodies[J]. J Headache Pain, 2020, 21(1): 26.
引证本文
丁珂 , 徐国栋 综述 , 王贺波 审校. 成人功能性复发性腹痛:被忽视的偏头痛表现?[J]. 中风与神经疾病杂志, 2025, 42(7): 600-604.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)