首页 > 医疗资讯/ 正文
EB病毒阳性淋巴结T细胞和NK细胞淋巴瘤(EBV+ NT/NKCL)是世界卫生组织《造血与淋巴组织肿瘤分类》第 5 版中新近确认的实体。值得注意的是,EBV+ NT/NKCL中常见CD30阳性,这为将其与ALK阴性间变大细胞淋巴瘤(ALCL)区分带来诊断挑战。此外,EBV阳性ALCL病例已在文献中记载,其早于将EBV阳性结内细胞毒性T细胞淋巴瘤归为外周T细胞淋巴瘤的一个亚型。本文报告 1 例 47 岁男性患者,表现为多发淋巴结肿大。该淋巴结的组织形态学和免疫表型特征与ALK阴性ALCL高度相似,其特征为一致的CD30表达和淋巴瘤细胞的被膜下分布。然而,淋巴瘤细胞表现为弥漫性EBV阳性,符合EBV+ NT/NKCL。1 例免疫表型与该EBV阳性病例相同的ALK阴性ALCL被纳入以作比较。鉴于EBV+ NT/NKCL是一种与ALK阴性ALCL相比需要独特临床管理的侵袭性肿瘤,准确区分EBV+ NT/NKCL与具有细胞毒性T细胞免疫表型的ALK阴性ALCL至关重要。

▲摘自《第5版WHO造血与淋巴组织肿瘤分类T/NK细胞增生性疾病和淋巴瘤解读》
背 景
EB病毒(EBV)阳性淋巴结T细胞和NK细胞淋巴瘤(EBV+ NT/NKCL)是世界卫生组织(WHO)《造血与淋巴组织肿瘤分类》第 5 版(WHO-HAEM5)中被确认为的一个独特实体,也是 2022 年国际共识分类(ICC)中的暂定实体。EBV+ NT/NKCL主要影响东亚人群,尤其是中老年个体,男性发病率较高。患者通常表现为淋巴结肿大和晚期疾病,伴或不伴骨髓或其他结外部位受累。可能存在也可能不存在与免疫抑制的关联。其预后通常较差,且比外周T细胞淋巴瘤非特指型(PTCL-NOS)更差。EBV+ NT/NKCL因其独特的免疫表型特征和遗传学谱而不同于结外NK/T细胞淋巴瘤(ENKTL)。鉴于在相当比例的EBV+ NT/NKCL病例中观察到CD30阳性,这使其与ALK阴性间变大细胞淋巴瘤(ALCL)的鉴别具有挑战性。文献中已报道过被诊断为系统性ALK阴性ALCL的EBV阳性成熟T细胞淋巴瘤病例,这进一步增加了鉴别诊断的复杂性。系统性ALK阴性ALCL是一种异质性实体,主要根据形态学和免疫表型特征进行诊断。
其特征性形态学特征包括肿瘤细胞的黏附性窦状生长模式和间变性细胞形态,伴有所谓的标志性细胞,这些细胞显示马蹄形或叶状大细胞核。决定性的免疫表型特征是CD30强且均匀阳性,并表达部分而非全部成熟T细胞标志物。在部分ALK阴性ALCL病例中已发现一些特征性遗传学改变,有助于诊断。这些包括 20%-30% 病例中涉及DUSP22的染色体重排(与总体良好预后相关),以及 5%-8% 病例中TP63的重排(与不良临床结局相关)。最近,在PTCL中已记录到具有强弥漫性CD30表达和类似霍奇金样细胞的间变性形态并表达CD15的病例。这些病例特征性地携带JAK2重排。在缺乏特征性基因重排的病例中,很难将其与表达CD30的PTCL-NOS区分开来。WHO-HAEM5建议在存在疑问时,将这些病例保守地归类为PTCL-NOS。值得注意的是,黏附性窦状浸润;CD30均匀强阳性染色;CD56、EMA、簇集蛋白以及细胞毒性标志物(包括TIA1、颗粒酶B和穿孔素)的表达;以及CD43和CD45表达的缺失支持ALCL的诊断。
随着对EBV阳性成熟T细胞淋巴瘤和ALK阴性ALCL病理生物学理解的深入,这两种实体的分类已得到更好的明确。本报告呈现 1 例表现出类似ALK阴性ALCL形态学和免疫表型特征的EBV+ NT/NKCL病例。此外,本文还纳入 1 例具有相同免疫表型的ALK阴性ALCL病例以作比较。将讨论鉴别诊断的方法,并简要回顾先前报道的EBV阳性ALCL病例。通过探讨EBV+ NT/NKCL和ALK阴性ALCL的病理特征及诊断挑战,本病例报告旨在增进对这些淋巴瘤的当前理解,并促进准确诊断,以避免诊断陷阱和不恰当的临床管理。
病例展示
病例1(EBV+ NT/NKCL)
患者男,47 岁,因发热及左手手指皮肤颜色改变持续 2 个月就诊。随后出现腿部肿胀和行走困难。患者入院后,计算机断层扫描(CT)显示多区域淋巴结肿大,包括腋窝、胸肌下、锁骨上及颈二腹肌链淋巴结,最大者大小为 1.1×2.1 cm,同时伴有双肺多发、以胸膜下为主的结节,最大者大小为 0.7×1.1 cm。全血细胞计数显示:白细胞计数 20.9×10³/μL(参考范围:4.2–9.1),红细胞计数 3.51×10⁶/μL(参考范围:4.63–6.08),血细胞比容 33.3%(参考范围:37.7–46.5%),血小板计数 549×10³/μL(参考范围:150–400)。
对左腋窝淋巴结进行穿刺活检,光镜下显示淋巴组织无明显结构扭曲(图1A,上半部分)。尽管形态学检查不明显,但免疫组织化学染色显示小灶性非典型大细胞CD3弱表达,CD5不表达。通过EB病毒编码小RNA(EBER)原位杂交进行的EBV染色显示小簇EBV阳性大细胞(图1A,下半部分)。非典型细胞灶区在后续组织切片中丢失,无法进一步鉴定。流式细胞术未检测到单克隆B细胞群;由于样本细胞数量少,无法评估T细胞群。随后对左腋窝淋巴结进行了切除。苏木精-伊红(H&E)染色切片显示被膜下区域灶性存在大的非典型细胞(图1B、C)。免疫组织化学染色(图1D–G)显示这些细胞表达CD2、CD3、CD8、CD30、TCRβ、GATA-3,部分CD15阳性(小亚群),TIA-1阳性(少数细胞),且Ki-67增殖指数高,接近 100%(图1H)。大的非典型细胞EBER弥漫强阳性(图1I)。这些细胞不表达CD4、CD5、CD7、CD56、TCRγ、PD1及ALK1。流式细胞免疫表型分析显示一个高前向散射的独特细胞群,表达CD2(强)、CD3(弱)、CD8、CD15、CD45,CD5和CD7弱表达至不表达。该细胞群不表达CD4、CD26或CD56(代表性散点图见图1J)。通过血涂片形态学检查或流式细胞术在外周血中未检测到肿瘤性淋巴细胞。通过定量聚合酶链反应(PCR)检测EBV DNA,结果为 91500 IU/mL(参考范围:0–299)。
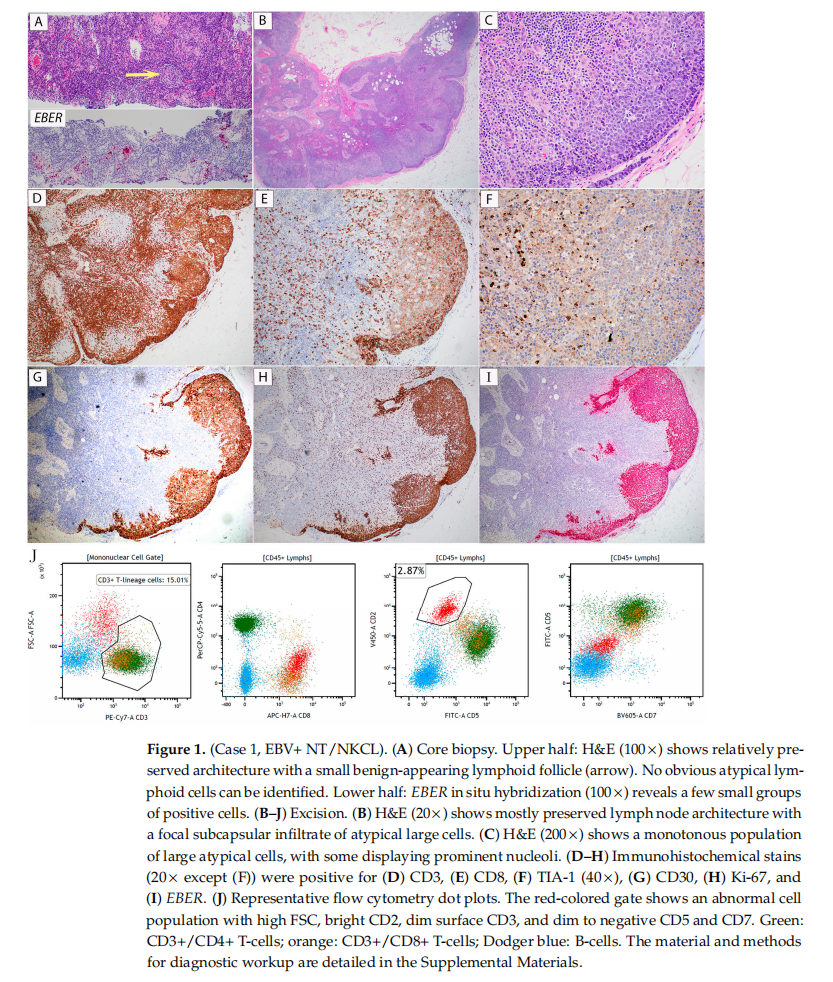
▲图1 病例1,EBV+ NT/NKCL
诊断为EB病毒阳性外周T细胞淋巴瘤,伴部分淋巴结受累。进一步检查显示脑脊液(CSF)样本中也存在非典型细胞,其免疫表型与通过流式细胞术在腋窝淋巴结中鉴定的淋巴瘤细胞相似。分期骨髓活检显示骨髓形态学大致正常,三系造血正常,无淋巴聚集,无肉芽肿。尽管在骨髓活检中发现少量散在的EBER阳性细胞,但CD3免疫组织化学染色未显示大的CD3阳性T细胞或异常T细胞簇。此外,流式细胞术未在骨髓中检测到与淋巴结中所见相似的异常CD8阳性细胞。染色体分析显示正常男性核型,46,XY。通过聚合酶链反应(PCR)检测T细胞受体γ链基因(TRG)重排,结果为多克隆模式,无单克隆重排证据。
患者接受BV-CHEP方案(本妥昔单抗、环磷酰胺、多柔比星)、依托泊苷和泼尼松化疗,随后给予CHOEP方案(环磷酰胺、多柔比星、长春新碱、依托泊苷和泼尼松)及每周利妥昔单抗治疗。治疗后正电子发射断层扫描-计算机断层扫描(PET-CT)显示无残留的结内或结外淋巴瘤病变证据。然而,治疗后脑部磁共振成像(MRI)显示脑干及其他部位存在多灶性病变,符合淋巴瘤受累,尽管当时脑脊液细胞学和流式细胞术分析未发现肿瘤细胞,骨髓活检也未显示EBV+细胞证据。患者开始接受DHAP方案(地塞米松、大剂量阿糖胞苷和顺铂)治疗,每个DHAP周期交替给予大剂量甲氨蝶呤和鞘内甲氨蝶呤。治疗后脑部MRI显示延髓背侧有点状残留强化灶,其他区域无残留强化,且无新发强化病变。PET-CT证实脑部病变显著减少(不再明显)。先前观察到的许多FDG高摄取的双侧腹股沟和左侧髂链淋巴结也已消退。然而,存在一个持续存在、FDG摄取显著且肿大的左侧髂外淋巴结。患者继续接受大剂量甲氨蝶呤治疗。治疗后PET-CT显示疾病显著进展,表现为FDG摄取逐渐增高的右侧甲状腺结节、大量新发和增大的FDG高摄取肺结节、肝脏病变以及多部位淋巴结肿大。尽管化疗期间血样中EBV定量降至 <5000 IU/mL,但随后水平升高至62800 IU/mL,符合疾病复发。针对复发性淋巴瘤启动P-Gemox方案(培门冬酶、吉西他滨、奥沙利铂)化疗。然而,患者应答不佳,最终在初始诊断后 17 个月因疾病进展死亡。
病例2(ALK- ALCL)
患者男,56 岁,因持续性腮腺及腹股沟淋巴结肿大、乏力和盗汗就诊,但否认有发热、寒战或体重减轻。CT成像显示左侧腹股沟淋巴结肿大,大小为 3.2×3.1 cm,同时腹股沟上区可见小淋巴结。PET-CT显示左侧颈部存在代谢活性,SUV值为 5.9,对应大小为1.9×1.9 cm的腮腺内淋巴结。行腹股沟淋巴结切除术。淋巴结苏木精-伊红染色切片显示,淋巴结结构几乎完全被大的、多形性淋巴样细胞的结节状增生所破坏,这些细胞具有明显的核仁和高有丝分裂活性(图2A、B)。免疫组织化学显示CD2、CD3(图2C)、CD7(弱阳性、部分细胞)、CD8(弱阳性,图2D)和CD30(强且弥漫阳性,图2E)阳性,而CD4、CD5、CD20、CD25、CD56、ALK和穿孔素阴性。Ki-67增殖指数高(90–100%,图2F)。EB病毒(EBER)原位杂交阴性。流式细胞术分析证实存在异常T细胞群,表达CD45、CD3(强度减弱)、CD2(强度增强)和TCRαβ。荧光原位杂交(FISH)未检测到ALK或P63重排,DUSP22重排结果不确定。患者被诊断为ALK阴性间变大细胞淋巴瘤,接受本妥昔单抗联合CHP化疗,症状改善,腮腺淋巴结消退。随后接受自体造血干细胞移植,移植后 5 个月仍处于完全缓解状态。
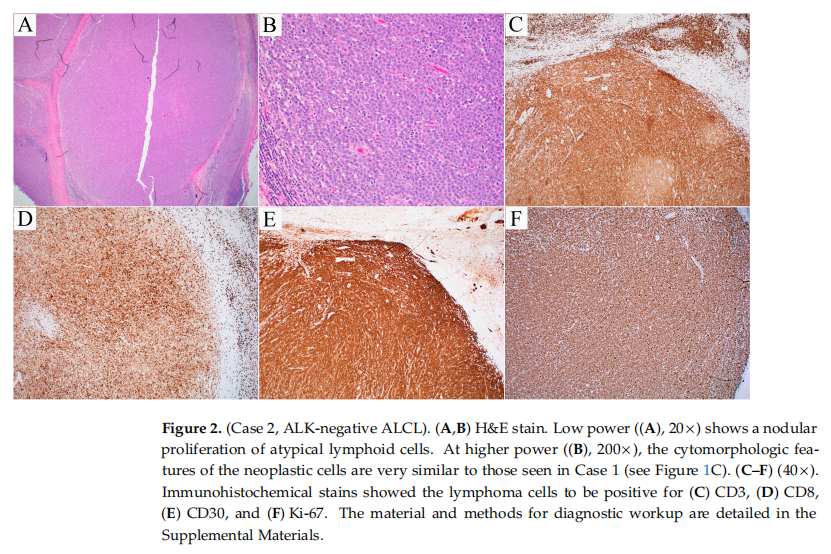
▲图2 ALK- ALCL
讨 论
本文报告两例成熟T细胞淋巴瘤病例,其细胞形态学和免疫表型特征几乎完全相同,仅其中一例EBER阳性,另一例EBER阴性。尽管病例 1 的淋巴瘤细胞具有被膜下及窦状分布模式和CD30均匀表达(这些是ALK阴性ALCL的典型特征),但淋巴瘤细胞弥漫EBER阳性表明该病例应归类为具有T细胞表型的EBV+ NT/NKCL。基于T细胞标志物CD2、CD3和CD8的弥漫表达以及完全缺乏PAX5表达,排除了经典霍奇金淋巴瘤的诊断。相反,尽管病例2的淋巴瘤细胞显示与病例1相同的免疫表型,但由于缺乏EBV,故被归类为ALK阴性ALCL。
EBV染色通常不常规纳入ALCL的检查中,尤其是在无免疫抑制或免疫功能低下证据的患者中。因此,弥漫表达CD30的EBV+ NT/NKCL可能构成诊断陷阱。通常,EBV+ NT/NKCL的肿瘤细胞至少表达一种T细胞抗原(如CD2、CD3、CD4、CD5、CD7和CD8),并表达细胞毒性分子如颗粒酶B、颗粒酶M、穿孔素和/或TIA-1,但CD56阴性,这使其与ENKTL区分开来。在2017年发布的WHO分类第4版修订版(WHO4RE)将结内EBV阳性成熟T细胞淋巴瘤列为PTCL-NOS的一个亚型之前,肿瘤细胞强且均匀表达CD30的EBV阳性成熟T细胞淋巴瘤的分类一直是一个争议话题,部分原因是 2008 年发布的WHO第4版分类指出,ALK阴性ALCL的EBV始终为阴性。在Ma等人 2010 年的病例报告中,回顾了64例先前报道的非皮肤EBV+ ALCL病例。这些病例基于CD30的均匀表达进行诊断,且主要见于免疫功能正常的患者。据研究人员所知,自 2010 年Ma等人的研究以来,文献中未再报道新的EBV+系统性ALCL病例。Gru等人于 2019 年报道了一例弥漫EBV染色的皮肤ALK阴性ALCL病例。该报道病例与免疫抑制相关,表达CD4,但不表达CD8或TIA-1,并携带BRAF V600E突变。本报告中的病例1如果未进行EBER染色,本会被诊断为ALK阴性ALCL,这强调了在疑似ALCL(表现为CD8表达的细胞毒性表型和CD30均匀表达)的诊断检查中纳入EBV染色以及血液EBV滴度检测的重要性。此外,当前WHO-HAEM5将EBV阴性列为确立ALK阴性ALCL诊断的基本标准,表明现在诊断ALK阴性ALCL需要进行EBV评估。
据报道,超过三分之一的成人T细胞白血病/淋巴瘤(ATLL)病例表达CD30,在淋巴瘤亚型中更为常见(47%),且与FOXP3表达缺失相关。ATLL病例通常表达CD4和CD25,这应提示进行人类T淋巴细胞病毒1型(HTLV-1)检测。偶尔,腔外原发性渗出性淋巴瘤(PEL,实体型)——常为EBV阳性——在大多数肿瘤细胞中表达CD3和CD30,模拟ALCL。这些病例具有浆母细胞免疫表型,表达CD38、CD138、MUM1和免疫球蛋白轻链限制性,且PEL由HHV8表达定义。罕见情况下,ALK或其他成熟T细胞淋巴瘤在继发性EBV感染时,淋巴瘤细胞中可出现EBV染色阳性。在这些情况下,与EBV+ NT/NKCL不同,EBV感染也累及非肿瘤细胞,且在淋巴瘤成分之外也观察到EBV阳性。
对EBV+ NT/NKCL的基因表达谱研究显示PD-L1和T细胞相关基因上调,同时CD56下调,这与ENKTL显著不同。在Wai等人的研究中,比较了PTCL、ENKTL和EBV+ NT/NKCL之间的拷贝数改变、同源重组缺陷和突变谱。结果显示,EBV+ NT/NKCL表现出显著较低的基因组不稳定性和同源重组缺陷评分,且许多免疫相关通路显著上调。其他上调的基因包括NFκB相关基因、BIRC3、NFKB1(P50)和CD27。此外,针对细胞毒性外周T细胞淋巴瘤(未专门聚焦于EBV+病例)的研究显示,表观遗传修饰因子(如TET2、DNMT3A)和参与JAK/STAT通路的基因频繁发生突变。尽管这些研究提供了将EBV+ NT/NKCL与ENKTL和PTCL-NOS区分开的证据,但JAK/STAT信号通路突变谱与ALK阴性ALCL重叠。三分之二的ALK阴性ALCL病例可见JAK/STAT通路激活,这由基因突变或基因重排引起。欧洲T细胞淋巴瘤研究组的一项研究鉴定出一组三个基因(TNFRSF8、BATF3和TMOD1),其共表达可能将ALK阴性ALCL与PTCL-NOS区分开,在无关患者组中的总体准确率约为 97%。需要进一步研究以确定能够区分EBV+ NT/NKCL与ALK阴性ALCL的独特遗传谱。对于病例1,鉴于在淋巴瘤细胞中观察到弥漫EBV阳性,未针对ALK阴性ALCL的诊断可能性进行进一步的分子遗传学研究。
尽管大多数系统性ALK阴性ALCL患者表现为III和IV期疾病并伴B症状,但使用常规化疗的预后优于PTCL-NOS。含蒽环类药物的多药方案已显示出高缓解率,尽管复发常见。有研究表明添加依托泊苷可改善结局,且将CD30靶向免疫偶联物本妥昔单抗纳入环磷酰胺、多柔比星、泼尼松(CHP)化疗方案,与标准CHOP(环磷酰胺、多柔比星、长春新碱、泼尼松)治疗相比,可改善无进展生存期(PFS)。相反,EBV+ NT/NKCL被认为是一种侵袭性淋巴瘤。目前,EBV+ NT/NKCL尚无标准治疗方案。接受CHOP方案治疗的患者临床结局较差。近期报道表明,基于L-天冬酰胺酶的方案,如SMILE(类固醇、甲氨蝶呤、异环磷酰胺、L-天冬酰胺酶和依托泊苷)和P-Gemox,对晚期ENKTL有效。尽管尚无关于SMILE方案用于结内EBV+ NT/NKCL的具体报道,且需要进一步研究,但推测其优于CHOP方案。不幸的是,本文病例1对复发性EBV+ NT/NKCL的P-Gemox方案未显示良好应答。此外,在EBV+ NT/NKCL中观察到PD-L1 mRNA上调,且抗PD-1免疫治疗在ENKTL患者中显示出有效性,这凸显了抗PD-1治疗在结内EBV+ NT/NKCL中的潜在治疗意义。在CD30阳性EBV+ NT/NKCL的治疗中纳入本妥昔单抗是否会改善临床结局也值得研究。基于EBV+ NT/NKCL和ALK阴性ALCL的遗传谱及其他独特病理特征,开展针对其管理的进一步临床研究,可能为改善这些患者的临床结局提供关键见解。
结 论
EBV+ NT/NKCL可表现出与ALK阴性间变大细胞淋巴瘤(ALCL)极为相似的形态学和免疫表型特征,包括CD30强且均匀表达。由于EBV+ NT/NKCL是一种侵袭性疾病,其临床管理与ALK阴性ALCL存在显著差异,因此在考虑诊断为ALK阴性ALCL的病例中,通过在诊断检查中纳入EBV检测(即组织切片的EBER染色和EBV血清学检查)对识别EBV+ NT/NKCL病例至关重要。
EBER原位杂交检测(CISH方法学)可辅助EB病毒阳性淋巴结T细胞和NK细胞淋巴瘤(EBV+ NT/NKCL)和ALK阴性间变大细胞淋巴瘤(ALCL)鉴别诊断。
参考文献:
Abro B, Allen P, Asakrah S, Bradley K, Zhang L. EBV-Positive Nodal T- and NK-Cell Lymphoma Mimicking Anaplastic Large Cell Lymphoma: A Case Report. Hematology Reports. 2024; 16(2):308-316. https://doi.org/10.3390/hematolrep16020031
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)