首页 > 医疗资讯/ 正文
肝细胞癌是全球范围内癌症相关死亡的主要原因之一,其发病率高且预后差,尤其对于晚期患者而言治疗选择有限。乐伐替尼作为一种多靶点酪氨酸激酶抑制剂,已被批准作为肝细胞癌的一线治疗药物,在临床应用中显示出优于索拉非尼的总体生存率和无进展生存率,但其具体分子机制尚未完全阐明。RRP15是一种核糖体RNA加工蛋白,在肝细胞癌中表达上调并与不良预后相关,前期研究表明抑制RRP15可通过诱导细胞衰老和凋亡来抑制肝细胞癌的进展,然而RRP15在调节肝细胞癌对乐伐替尼治疗反应中的作用仍不清楚。蛋白质降解是维持细胞稳态的核心过程,其中泛素-蛋白酶体途径在调控关键细胞过程中发挥重要作用,因此探索乐伐替尼是否通过调控蛋白质降解途径影响RRP15稳定性,对于理解其抗肿瘤机制具有重要意义。

本研究采用多种实验方法系统探讨了RRP15表达与乐伐替尼敏感性之间的关系及其潜在机制。实验使用人肝细胞癌细胞系Huh7、PLC/PRF/5和H22进行体外研究,这些细胞在含10%胎牛血清的DMEM或1640培养基中培养。通过Western blot和免疫组织化学检测RRP15和KBTBD8的表达水平,使用CCK-8法和克隆形成实验评估细胞活力和增殖能力,Transwell实验分析细胞迁移和侵袭,TUNEL和Annexin V染色通过流式细胞术检测细胞凋亡。为研究蛋白质相互作用,采用免疫共沉淀和质谱分析鉴定RRP15与KBTBD8的结合,并通过免疫荧光验证其共定位。为探究蛋白质降解机制,使用环己酰亚胺处理评估蛋白质稳定性,MG132处理验证蛋白酶体途径的参与,并通过体外泛素化实验分析RRP15的泛素化修饰。基因操作方面,利用慢病毒载体构建RRP15敲低和过表达的细胞模型,通过siRNA转染敲低KBTBD8、ATG5和ATG7表达,同时使用质粒转染实现KBTBD8和泛素结合酶UBC的过表达。体内实验部分,通过尾静脉注射H22细胞建立肺转移模型,小鼠随机分为乐伐替尼治疗组和对照组,乐伐替尼以10 mg/kg剂量每日口服给药,两周后收集肺组织进行组织学分析和蛋白质表达检测。所有实验均独立重复三次,数据以均值±标准误表示,使用GraphPad Prism 8软件进行统计学分析,p值小于0.05认为具有显著性。
研究结果首先证实了RRP15在调节肝细胞癌对乐伐替尼敏感性中的关键作用。在PLC5细胞中敲低RRP15表达后,乐伐替尼诱导的细胞死亡和凋亡显著增强,而在Huh7细胞中过表达RRP15则减弱了乐伐替尼的促凋亡效应。克隆形成实验显示RRP15抑制增强了乐伐替尼对肝细胞癌细胞增殖的抑制作用,而过表达RRP15则逆转了这一效应。在细胞迁移和侵袭方面,RRP15敲低联合乐伐替尼处理显著抑制了肝细胞癌细胞的转移能力,Western blot分析进一步证实RRP15抑制可增强乐伐替尼对迁移相关蛋白表达的下调作用。接下来研究发现乐伐替尼以剂量依赖方式降低RRP15蛋白水平而不影响其mRNA表达,表明存在转录后调控机制。环己酰亚胺追踪实验显示乐伐替尼加速了RRP15的降解,而自噬抑制剂NH4Cl处理不影响RRP15降解,蛋白酶体抑制剂MG132则显著阻断这一过程,证明乐伐替尼通过泛素-蛋白酶体途径诱导RRP15降解。体外泛素化实验进一步证实乐伐替尼处理增加了RRP15的泛素化水平。
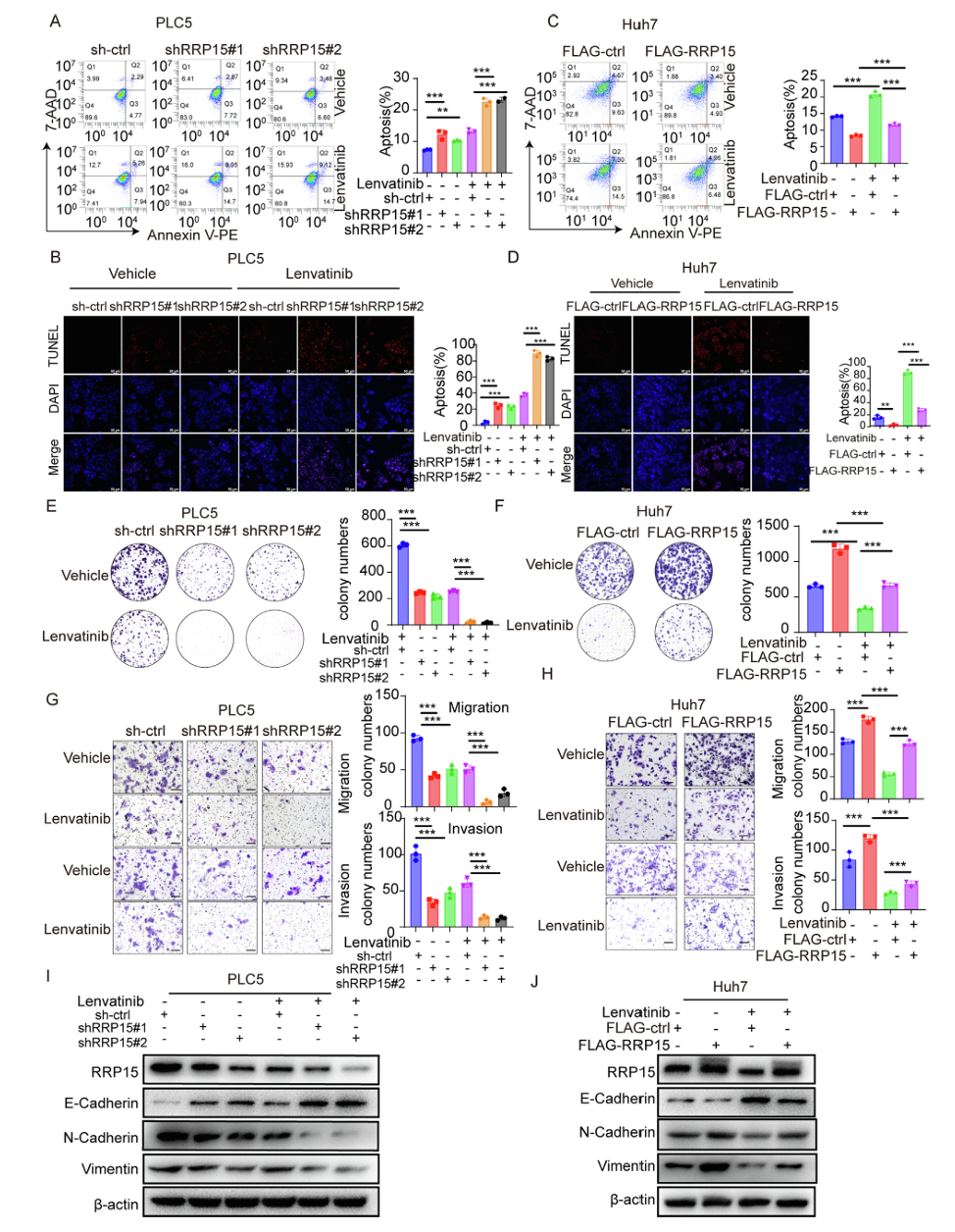
图1 RRP15对肝细胞癌乐伐替尼敏感性及细胞增殖和转移的调控
为鉴定介导RRP15降解的E3泛素连接酶,研究通过免疫共沉淀联合质谱分析发现KBTBD8与RRP15存在相互作用,免疫荧光显示两者在肝细胞癌细胞中显著共定位,免疫共沉淀实验进一步验证了这一相互作用。临床样本分析显示,与癌旁组织相比,肝细胞癌组织中KBTBD8表达下调而RRP15表达上调,两者表达呈负相关,生存分析表明KBTBD8高表达患者中位生存期显著延长。功能实验表明,KBTBD8敲低减弱了乐伐替尼对肝细胞癌细胞增殖和转移的抑制作用,而KBTBD8过表达则增强乐伐替尼的疗效。机制上,KBTBD8敲低延缓了乐伐替尼诱导的RRP15降解,而KBTBD8过表达增强了RRP15的泛素化,进一步研究发现乐伐替尼通过K11连接的多聚泛素链介导RRP15降解。回复实验显示,在过表达RRP15的肝细胞癌细胞中,同时过表达KBTBD8可逆转RRP15过表达引起的乐伐替尼耐药和增殖转移增强效应。体内实验结果表明,乐伐替尼治疗显著减少小鼠肺转移结节数量,免疫组化和Western blot分析显示乐伐替尼处理组肺组织中KBTBD8表达上调而RRP15表达下调,证实乐伐替尼在体内通过上调KBTBD8促进RRP15降解。
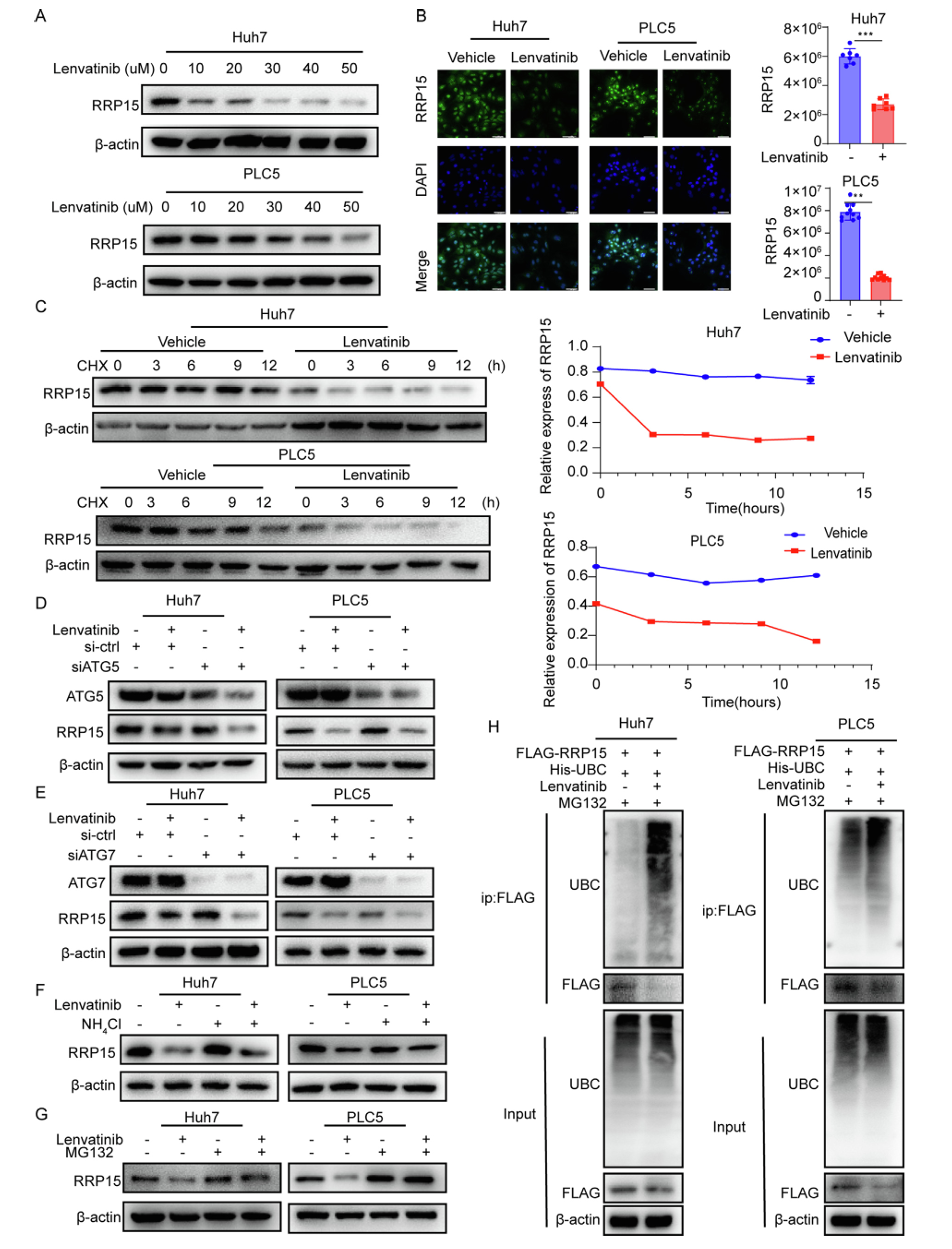
图2 乐伐替尼通过泛素-蛋白酶体途径诱导RRP15降解
总之,本研究系统阐明了乐伐替尼通过上调E3泛素连接酶KBTBD8表达,促进RRP15的K11连接泛素化修饰及蛋白酶体降解,从而抑制肝细胞癌细胞增殖和转移的分子机制。这一发现不仅揭示了乐伐替尼抗肿瘤作用的新机制,还首次将RRP15-KBTBD8轴确定为肝细胞癌治疗的潜在新靶点,为乐伐替尼的精准临床应用提供了理论依据。研究也存在一定局限性,如动物实验仅聚焦肺转移模型,未来需利用条件性基因敲除或转基因小鼠模型进一步验证RRP15和KBTBD8在肿瘤进展中的作用,并评估乐伐替尼在体内的治疗窗和安全性,以推动研究成果向临床转化。
原始出处:
Zhao, S., Wang, X., Wu, R., Wang, F., Tang, X., Chen, J., Jiang, R., Kang, W., Xu, G., Wang, L., Wang, Z., Zou, X., & Zhang, B. (2025). KBTBD8/RRP15 as a potential novel therapeutic target associates with lenvatinib-inhibited progression in hepatocellular carcinoma both in vitro and in vivo. Journal of Advanced Research, 76, 569-583. https://doi.org/10.1016/j.jare.2024.12.017
本文相关学术信息由梅斯医学提供,基于自主研发的人工智能学术机器人完成翻译后邀请临床医师进行再次校对。如有内容上的不准确请留言给我们。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)