首页 > 医疗资讯/ 正文
无论是肺纤维化、硬皮病,还是肝肾纤维化,它们都有一个相似的病理过程——成纤维细胞向肌成纤维细胞的转化(fibroblast-to-myofibroblast transition,FMT)。这种细胞表型转化会导致大量细胞外基质(ECM)沉积,使组织逐渐收缩、变硬、失去功能,最终引发器官衰竭。目前获批的抗纤维化药物(如吡非尼酮和尼达尼布)虽然能延缓病情,但无法逆转已经形成的纤维化,也无法直接清除“元凶”——肌成纤维细胞。
研究团队以天然来源的墨鱼汁纳米颗粒(melanin nanoparticles, MelNPs)为载体,通过表面偶联 CDH2 抗体构建出功能化纳米颗粒(CDH2-MelNPs),并利用其对 CDH2 的特异识别,实现了肌成纤维细胞向成纤维细胞的反向转化(myofibroblast-to-fibroblast transition,MFT)。这一策略与传统“以抑制为主”的抗纤维化治疗不同,其核心目标是通过细胞表面受体及其胞内信号通路调控实现细胞表型逆转,从而在分子与组织功能层面同时缓解纤维化病变。
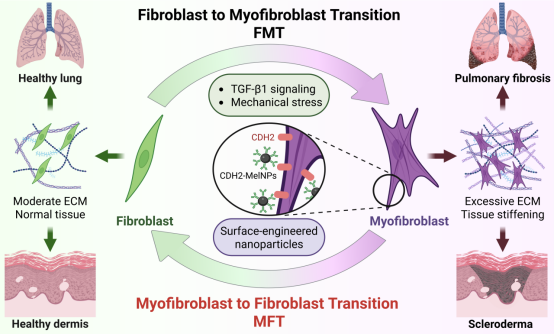
图1. 通过表面工程化墨鱼汁纳米颗粒靶向 CDH2 实现肌成纤维细胞表型逆转
天然MelNPs 具有优良的生物相容性与化学可修饰性。研究团队首先从乌贼墨汁中提取 MelNPs,并依次进行:Protein A 与 BSA 的表面偶联(提供抗体结合位点与间隔层);CDH2 抗体的定向结合,获得最终的 CDH2-MelNPs。
TEM、水合粒径、表面电势结果显示,抗体修饰后颗粒尺寸由约 133 nm 增至 143 nm,表面电位降低至 -50 mV,表明修饰成功。此外,团队利用动态光散射测得的水合粒径变化与UV–Vis 吸收光谱稳定性分析,系统评估了颗粒在不同储存条件下(纯水、PBS、无血清与含血清培养基)7天内的物理稳定性。结果显示CDH2-MelNPs 在生理环境下具备良好的胶体稳定性和可分散性。
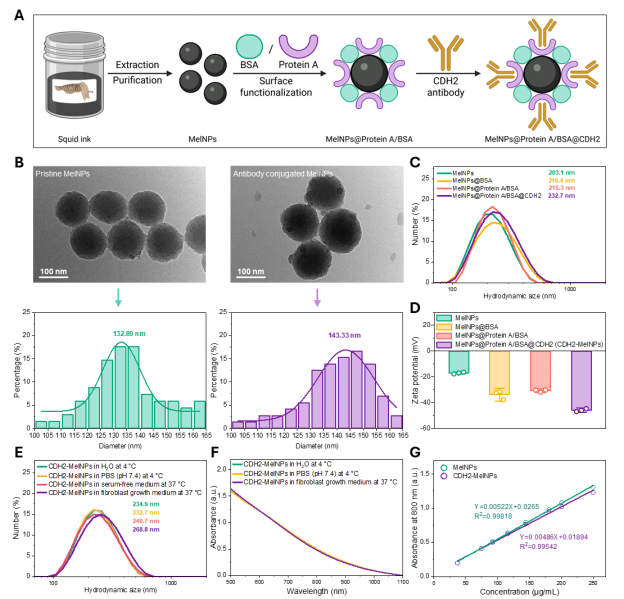
图2. CDH2-MelNPs 的制备与表征结果
通过免疫荧光与荧光示踪实验,团队验证了CDH2-MelNPs 对肌成纤维细胞的特异性靶向能力。在 TGF-β 诱导活化的肺成纤维细胞(MRC-5)和皮肤成纤维细胞(BJ)模型中,CDH2 表达显著升高。荧光成像结果表明:以上活化细胞对CDH2-MelNPs 的摄取量是非靶向 BSA-MelNPs 的2–3 倍;细胞预先用游离抗体封闭 CDH2 位点后,颗粒摄取量明显下降;纳米颗粒经胞吞后主要位于溶酶体内,表明其经CDH2介导的内吞作用被细胞吸收。
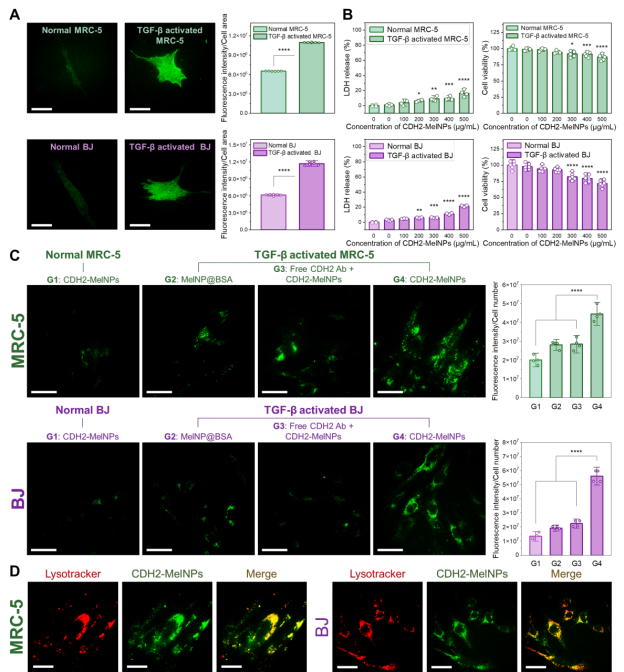
图3. CDH2-MelNPs 在活化成纤维细胞中的特异性靶向与细胞内分布
在被TGF-β 激活后,MRC-5 与 BJ 细胞均出现典型肌成纤维特征——α-SMA 阳性纤维束显著增多,细胞由纤细梭形形态转变为扁平多角形态。而这些肌成纤维细胞经CDH2-MelNPs 处理后:α-SMA 水平恢复至正常成纤维细胞水平;细胞重新呈梭形伸展;ECM 及细胞骨架蛋白(collagen I、fibronectin、vimentin)显著下调。
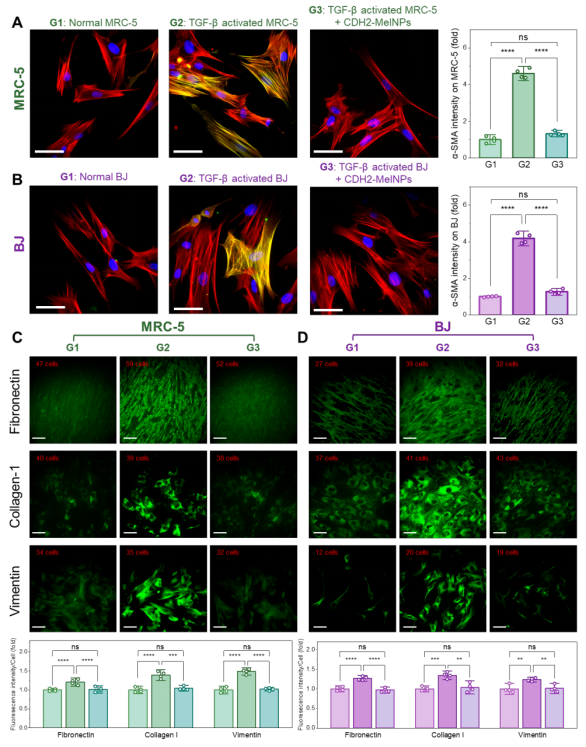
图4. 免疫荧光显示 CDH2-MelNPs 处理后的细胞 α-SMA 与 ECM 标志物显著下降
Western blot 定量验证了上述结果,证明纳米颗粒在分子水平上实现了 FMT 的逆向调控(MFT)。利用原子力显微镜(AFM)对单个细胞进行纳米力学表征,团队发现:正常成纤维细胞的平均杨氏模量为 30–60 kPa;TGF-β 激活后升至 100–500 kPa,表现出高细胞硬度和应力纤维增多;而上述活化细胞经CDH2-MelNPs 处理后,细胞硬度与形貌均恢复至接近正常水平。超分辨显微成像进一步显示,应力纤维数量在激活组增加约2.5 倍,而治疗组下降为初始水平,证明细胞张力显著缓解。

图5. AFM 与超分辨显微图揭示 CDH2-MelNPs 使细胞力学性质恢复正常
在细胞和组织功能层面上,CDH2-MelNPs 显示出多重逆转纤维化效应:
细胞增殖:TGF-β活化后的细胞增殖率约为正常的两倍,经CDH2-MelNPs处理后恢复至基线水平;
迁移与侵袭:划痕与侵袭实验显示,纳米颗粒可显著降低TGF-β激活细胞的运动与穿膜能力;
组织收缩与硬度:胶原凝胶收缩实验中,CDH2-MelNPs处理组凝胶直径显著大于TGF-β活化组,说明组织收缩度下降;AFM 纳米压痕测得的凝胶杨氏模量从 3 kPa 降至 0.5 kPa,表明组织硬度经CDH2-MelNPs处理后显著降低。
综上,CDH2-MelNPs 不仅在分子层面逆转细胞表型,更在功能层面恢复了细胞与组织的生理特征。
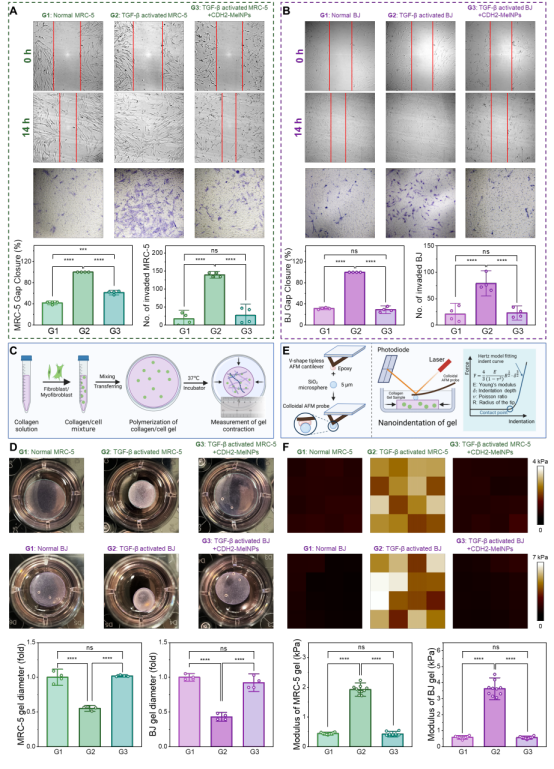
图6. 功能实验表明,CDH2-MelNPs 能减弱肌成纤维细胞的增殖、迁移,降低组织收缩和硬度
为揭示分子作用机制,研究者重点分析了CDH2 下游信号通路。结果显示:纤维化进程中,CDH2 与磷酸化 p120 结合形成复合物,可释放 Rho-GDP 并促进 Rho-GTP激活,从而上调促转录因子Slug/Snail,引发 FMT;而CDH2-MelNPs 经细胞内吞后导致膜上 CDH2 的耗竭,抑制了 上述复合物的形成及Rho-GTP 的激活;随后,Slug/Snail 表达下调,FMT 转为 MFT。由此,CDH2-MelNPs 通过阻断 CDH2–p120–Rho 信号轴实现了肌成纤维细胞的表型逆转。
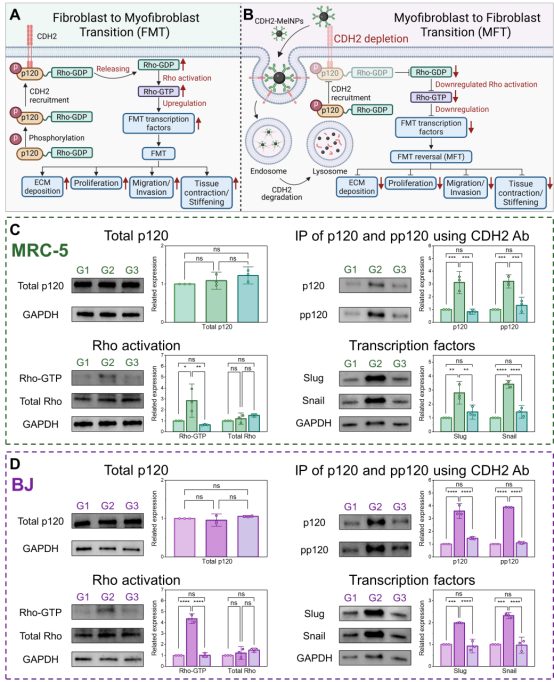
图7. CDH2-MelNPs 介导的信号通路调控机制
鉴于CDH2 在多种纤维化组织中均高度表达,该策略在治疗多种器官纤维化方面具有广泛的应用潜力。此外,该研究理念也可推广至其他CDH2 高表达疾病(如肿瘤上皮–间质转化调控),为肿瘤纳米医学与再生医学提供新的研究方向。本研究首次系统性地证明,通过表面工程化纳米颗粒靶向CDH2 可实现肌成纤维细胞向成纤维细胞的表型逆转,在细胞表型、组织功能及分子层面均表现出显著的逆转纤维化作用。
该研究论文以“Reversing fibroblast-to-myofibroblast transition using surface-engineered nanoparticles to potentially ameliorate fibrotic diseases”为题于2025年11月在《Biomaterials》上发表。南达科他矿业理工学院生物医学工程在读博士生于箫为文章的第一作者,纳米与生物工程系王从周教授为文章的通讯作者。
原文链接:
http://10.1016/j.biomaterials.2025.123829
- 上一篇:一文掌握压力支持通气(PSV)
- 下一篇: 大理州中医医院视频喉镜等设备招标公告
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)