首页 > 医疗资讯/ 正文
本研究探讨个性化肿瘤组织先验方法(tumor-informed)循环肿瘤DNA(ctDNA)检测在结直肠癌(CRC)和高级别阑尾癌(HGA)腹膜转移(PM)患者接受根治性肿瘤细胞减灭术联合腹腔热灌注化疗(CRS-HIPEC)后,对复发监测的作用。超过50%的CRC/HGA-PM患者在接受最佳CRS-HIPEC治疗后仍会复发。断层成像和诊断性生物标志物敏感性有限,是导致复发检测延迟及后续治疗启动延迟的重要原因。血浆ctDNA在监测原发癌切除后治疗反应和/或复发方面具有潜在应用价值。本研究纳入接受根治性CRS-HIPEC治疗,并在术后进行系列ctDNA评估的CRC/HGA-PM患者。将术后ctDNA水平升高的患者与ctDNA水平未检出且稳定的患者进行比较。主要结局指标为患者复发率和无病生存期(DFS);次要结局指标包括总生存期、ctDNA敏感性、提前预警时间,以及ctDNA与癌胚抗原(CEA)的检测效能比较。
在33名患者(13例CRC、20例HGA)中进行了130次术后ctDNA的连续检测[中位数 4 次,四分位距(IQR)为3-5次],这些患者均接受了彻底性细胞减灭术 0/1 级CRS,中位随访时间为 13 个月。在19例ctDNA水平升高的患者中,90%出现复发;而在ctDNA水平稳定的14例患者中,仅21%出现复发(P<0.001)。ctDNA升高组的中位DFS为11个月(IQR:6-12),ctDNA稳定组的中位DFS未达到(P=0.01)。ctDNA水平升高是与DFS相关的最显著因素(HR=3.67,95%CI:1.06-12.66,P=0.03)。ctDNA水平升高预测复发的敏感性和特异性分别为85%和84.6%,中位提前预警时间为3个月(IQR:1-4)。CEA的敏感性(50%)低于ctDNA。
本研究证实,连续ctDNA评估作为强预后生物标志物,在接受根治性切除的CRC/HGA-PM患者复发监测中具有临床有效性,同时也为未来临床试验设计和进一步研究提供了方向。
研究背景
下消化道(GI)癌症包括结直肠癌(CRC)和高级别阑尾癌(HGA),是癌症相关死亡的主要原因之一。腹膜转移(PM)的发生率在CRC患者中为8%-20%,在HGA患者中超过50%,此类患者预后显著更差。采用全身化疗联合肿瘤细胞减灭术(CRS)与腹腔热灌注化疗(HIPEC)的多模式治疗,已显著改善患者的肿瘤学结局。事实上,目前采用该方案治疗的患者中,高达16%-20%可能获得治愈。然而,即使接受最佳的CRS-HIPEC治疗,疾病复发仍很常见:约50%的患者在1年内复发,70%在3年内复发,且腹膜是最常见的复发部位。当前的监测方案(包括血清生物标志物如癌胚抗原(CEA)、腹部和盆腔增强断层成像(计算机断层扫描CT或磁共振成像MRI))在疾病和复发检测方面效能较差。这会导致诊断延迟,甚至可能使患者错失进一步治疗或参与临床试验的机会。此类患者就诊时,往往已存在大量腹腔内病变,进而引发恶性肠梗阻,导致生活质量严重下降,并在短期内进展至死亡。因此,亟需更优的诊断和预后生物标志物来识别复发,从而改善CRC和HGA来源PM患者的肿瘤学结局。
基于液体活检的检测工具具有微创特性,与现有诊断手段结合时可发挥显著优势。ctDNA检测通过识别和定量血液中循环的肿瘤来源碎片化DNA分子,正迅速成为一种具有潜力的诊断和预后生物标志物。研究表明,ctDNA在多种癌症的早期检测、化疗反应评估及复发监测中具有临床有效性。此外,在包括CRC和其他GI癌症在内的多种癌症中,根治性治疗后检测到ctDNA与复发风险升高相关。
传统ctDNA检测采用ddPCR,检测特定癌症类型中最常见的突变(如CRC中的KRAS突变)。然而,这类泛肿瘤检测仅对携带特定突变的癌症具有诊断价值,临床应用范围有限。随着NGS和多重PCR技术的普及,基于这些技术的新型ctDNA检测可通过检测个性化肿瘤来源突变,在多种癌症亚型的复发检测中实现极高的敏感性和特异性。尽管如此,这种肿瘤组织先验方法ctDNA检测在腹膜疾病患者中的应用价值尚未得到评估。
研究者推测,在接受根治性CRS-HIPEC治疗的CRC/HGA-PM患者中,个性化tumor-informed ctDNA水平升高在复发检测方面,优于现有的生物标志物(CEA、影像学检查)。
研究结果
研究队列:
2018年6月至2020年12月期间,共164例患者接受了CRS/HIPEC(图1)。排除患有其他原发癌的患者(n=66)、未接受系列ctDNA评估的患者(n=56)及符合其他排除标准的患者(n=9)后,最终33例患者被分为两组进行分析:19例ctDNA水平升高,14例ctDNA未检出。每位患者术后系列ctDNA样本的中位数量为4份[四分位距(IQR):3-5],整个研究队列共完成130次ctDNA评估。ctDNA采集方案如下:首次术后ctDNA采集于CRS后 4-6 周(此举既可避免早期假阳性结果,也能为肿瘤测序预留时间),术后第1年则每3个月采集1次。无法前来采血或参与其他竞争性研究的患者,均被排除在该检测项目之外(图 1)。ctDNA 检测采用基于NGS的个性化tumor-informed Signatera 检测技术。
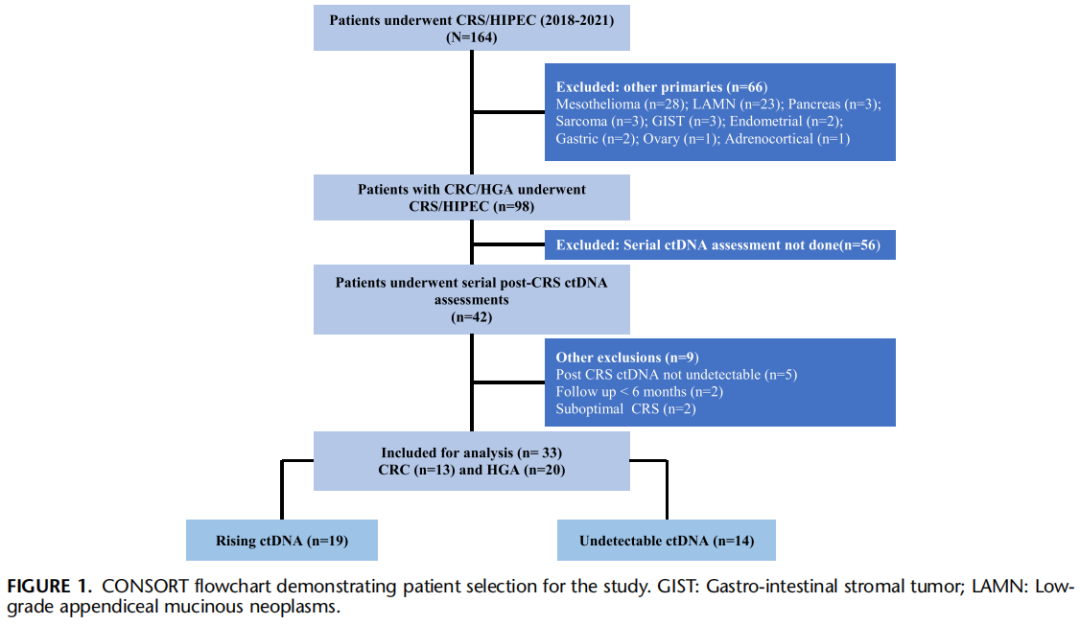
图1
患者特征:
两组患者的基线特征相似(表1),中位年龄为58岁(IQR:52-63)。其中13例患者(39.4%)为CRC,且这13例中有9例表现为同步性PM。中位腹膜癌指数(PCI)评分为14(IQR:6-25),约30%的患者存在印戒细胞组织学特征。此外,所有患者均接受了全身化疗,部分患者在CRS术前接受化疗,部分患者在CRS术前和术后均接受化疗。
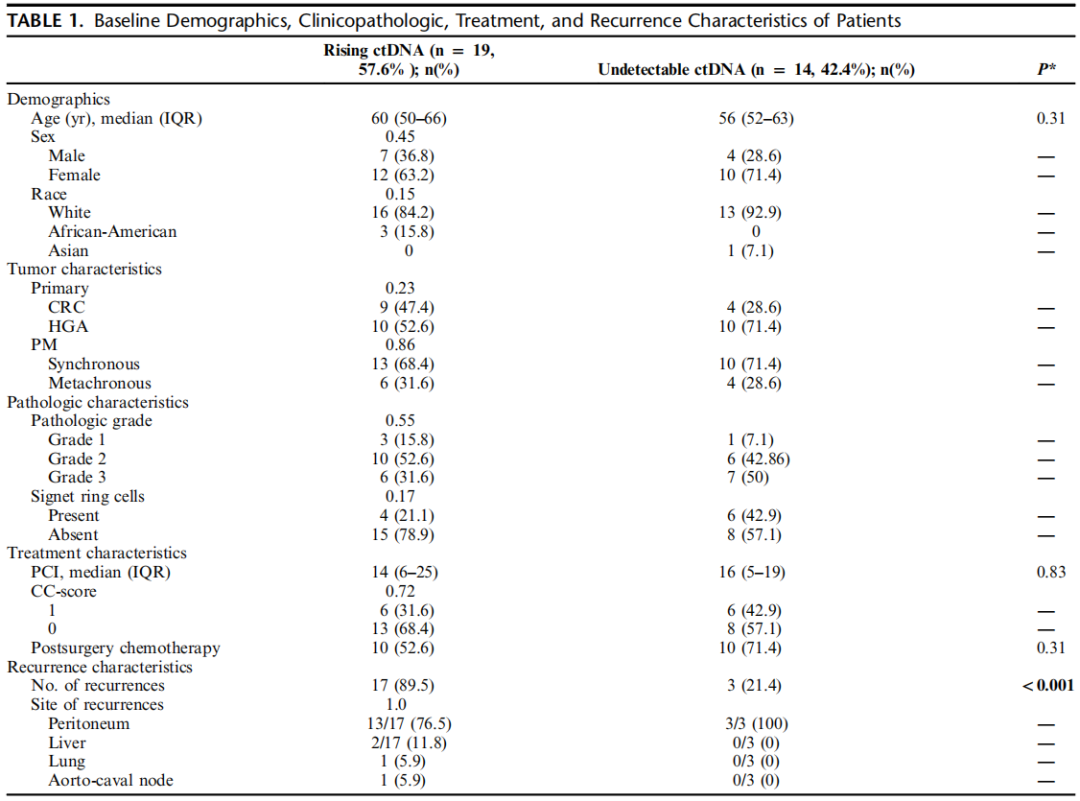
表1
循环肿瘤DNA特征:
中位随访13个月(IQR:8-19)后,接受最佳CRS-HIPEC治疗的患者中约60%(20/33例)出现复发,且腹膜是最常见的复发部位(80%)。腹膜复发患者(n=13)的中位ctDNA定量水平为0.94个平均肿瘤分子/毫升(MTM/mL)(IQR:0.18-1.79),而内脏复发(肝或肺,n=3)患者的中位ctDNA水平为199.3 MTM/mL(IQR:5.91-295.76),两组差异具有统计学意义(P=0.008)。所有患者的中位无病生存期(DFS)为12个月(IQR:9-16)。ctDNA水平升高的患者复发率显著更高(89.5% vs 21.4%,P<0.001;图2)。术后ctDNA水平升高与DFS显著缩短相关,该组患者的中位DFS为11个月(IQR:6-14个月);而ctDNA未检出组的中位DFS未达到(NR)(IQR:10-NR,log-rank检验P=0.014;图3)。与其他临床病理因素相比,ctDNA水平升高是与DFS相关的唯一最显著预后因素(HR=3.67,95%CI:1.06-12.66,P=0.03;表2)。所有患者的中位总生存期(OS)未达到(33例患者中仅3例死亡)。
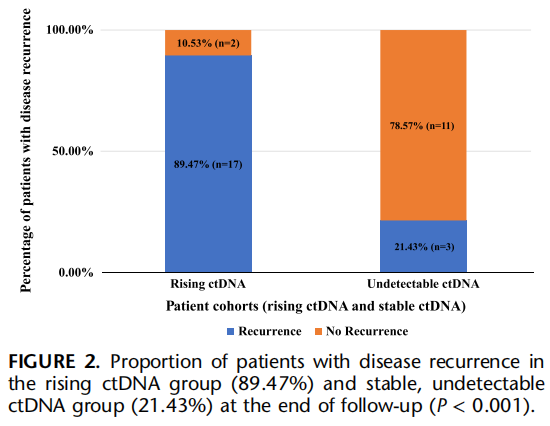
图2
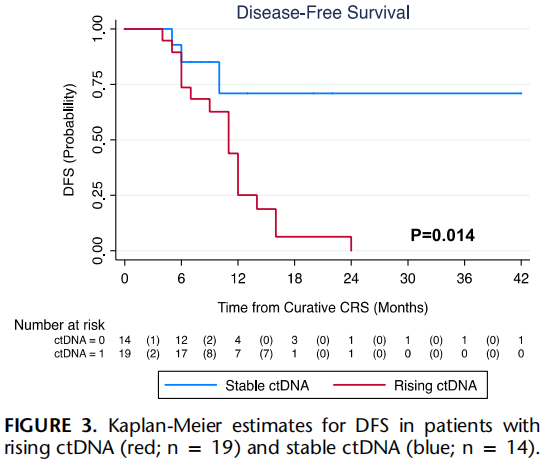
图3
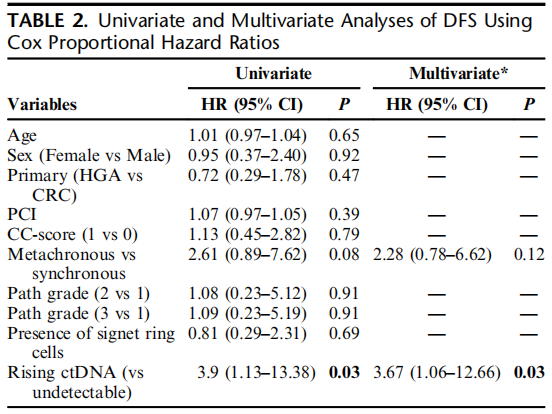
表2
敏感性、特异性及与癌胚抗原水平的比较:
ctDNA水平升高预测疾病复发的敏感性为85%(17/20例,95%CI:68.1%-96.8%),特异性为84.6%(11/13例,95%CI:54.6%-98.1%),阳性预测值为89.5%(17/19例,95%CI:70.1%-96.9%)。在复发患者中,从检测到ctDNA水平升高到影像学/临床确诊复发的中位提前预警时间为3个月(IQR:1-4;图4)。ctDNA检测效能优于CEA水平检测,后者在复发检测中的敏感性仅为50%(图5)。
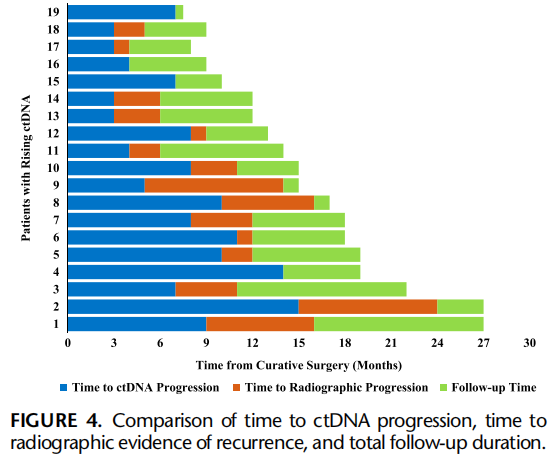
图4
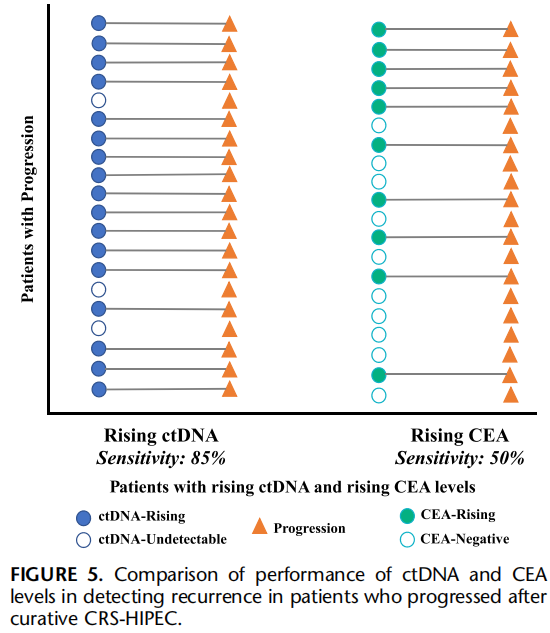
图5
讨 论
据研究者所知,本研究是首项探讨个体化tumor-informed ctDNA检测在结直肠癌或高级别阑尾癌来源的腹膜转移瘤患者接受根治性CRS-HIPEC后复发监测中作用的研究。研究结果表明,ctDNA水平升高可作为早期发现肿瘤复发的潜在诊断及预后生物标志物,其在临床监测中的意义或许优于传统影像学及生化标志物。此外,相较于当前的监测手段,ctDNA检测还能显著提前预警时间。这些发现或将对结直肠癌和高级别阑尾癌来源的腹膜转移瘤患者的临床诊疗产生重大影响,甚至改变现有诊疗模式。
临床上,对于消化道高级别原发肿瘤引发的腹膜转移瘤患者,在接受CRS-HIPEC后,通常会通过定期临床检查、腹部及盆腔断层扫描以及肿瘤标志物(CEA、CA 19-9和CA 125)检测进行随访。然而,这些临床检测手段对早期腹膜病变的可靠检出能力有限。例如,一项预测芯片相关研究显示,在原发性结直肠癌手术时存在肿瘤穿孔、微小腹膜转移或合并卵巢转移等高危因素的患者中,52%在初次手术后6个月出现了腹膜转移,而这些转移灶通过传统监测手段均未检出。断层扫描成像技术的一大公认缺陷是容易低估腹膜肿瘤负荷,在肿瘤呈浸润性生长或弥漫粟粒样播散时,这一问题尤为突出。有研究报道,传统肿瘤标志物诊断腹膜转移瘤的灵敏度较低,其中CEA单独检测的灵敏度仅为13%-54%,而CEA联合CA 19 - 9检测的灵敏度也仅为56%-70%。正因传统监测手段难以早期识别肿瘤复发,腹膜转移瘤患者历来被系统性地排除在各类临床试验之外。
近年来,液体活检技术,尤其是ctDNA检测技术取得了长足进步,并迅速逐步应用于临床肿瘤诊疗工作。这类生物标志物的临床价值已在肿瘤诊疗的多个环节得到探索,涵盖肿瘤早期筛查、精准分期、风险分层以及疗效监测等方面。近期有一项纳入130例Ⅰ - Ⅲ期结直肠癌患者的多中心前瞻性队列研究显示,患者接受根治性手术后,ctDNA检测结果呈阳性者的肿瘤复发风险是阴性者的40倍(HR为17.5,95%CI:5.4 - 56.5,P<0.001)。另有研究团队在接受根治性治疗的结直肠癌肝转移患者中也得出了类似结论。但目前,针对ctDNA检测在腹膜转移瘤患者中具体应用价值的研究尚较为匮乏。在本研究开展之前,Baumgartner等人曾针对多种病理类型的腹膜转移瘤患者,探究其接受CRS-HIPEC前后的循环DNA水平变化。该研究采用基于二代测序的肿瘤未知方法(tumor-agnostic)ctDNA检测技术,靶向检测特定肿瘤类型中常见的基因突变,结果发现术前ctDNA高水平是肿瘤进展的独立预测因素,而术后ctDNA水平则不具备预测价值。
近年来,ctDNA检测技术发展迅速。早期的ctDNA检测方法以检测预设的肿瘤相关基因为核心,包括ddPCR、等位基因特异性扩增阻滞突变系统PCR、等位基因特异性PCR以及磁珠乳化扩增磁性检测技术等。但这类技术均依赖于肿瘤样本中特定基因突变的存在,因此在检测分析方面存在固有缺陷。肿瘤具有高度复杂性,其分子层面存在显著的肿瘤间异质性和肿瘤内异质性。本研究采用超高灵敏度的个体化肿瘤靶向检测平台以规避上述缺陷,该技术先对肿瘤组织进行全外显子测序,随后针对该肿瘤样本中16个最显著的突变位点,采用靶向多重PCR进行超深度测序。Loupakis等人在转移性结直肠癌患者中对比了ddPCR与基于NGS的个体化PCR ctDNA检测技术的效能,结果表明后者在准确识别肿瘤复发患者方面灵敏度更高。此外,该技术已应用于乳腺癌、膀胱癌、结直肠癌等多种肿瘤的相关研究,且研究证实其在这些肿瘤的微小残留病灶(MRD)检测、疗效评估以及复发早期预警中具有临床有效性。同时,针对患者个体化设计PCR检测 panel 并进行超深度测序,可将检测下限降至极低水平(<0.01%),从而实现超高灵敏度检测。这一特性对于腹膜转移瘤患者而言至关重要,因为“腹膜 - 血浆屏障”会降低全身化疗药物在腹膜病变部位的生物利用度,同理,该机制也可能导致肿瘤DNA释放到血液循环中的量显著减少。本研究结果也印证了这一假设,数据显示腹膜转移患者的ctDNA中位定量水平显著低于内脏转移患者。不过,该结论仍需更大样本量的研究进一步验证。但本研究结果也提示,ctDNA水平即使出现微量升高,也可能提示腹膜转移瘤复发,临床中不应忽视这一信号。
鉴于多数患者在影像学出现明确复发征象前,就会出现ctDNA水平升高,因此ctDNA检测阳性或许意味着体内已存在影像学无法察觉的微转移灶。对于这类患者,可采用更积极的监测方案,以便及时把握治疗时机。若延误治疗,可能会导致再次CRS-HIPEC等治疗手段失去实施可行性。例如,对于接受细胞减灭术后随访的患者,若连续监测发现ctDNA水平持续升高,可考虑择期进行诊断性腹腔镜检查。但需注意,若检测结果为阳性却无法据此调整治疗方案时,需充分考量该结果对患者和医护人员造成的心理影响。因此,在通过临床试验明确早期检出肿瘤复发的治疗意义之前,临床医生需审慎评估ctDNA检测结果在诊疗决策中的作用。目前已有多项相关临床试验正在开展,其中包括本团队主导的一项研究,这些试验旨在探索通过ctDNA检测对肿瘤患者进行风险分层,进而为部分患者制定更积极的治疗方案(相关试验编号:NCT04089631、NCT03803553、NCT04264702、NCT04931420)。例如,试验NCT03803553正聚焦于Ⅲ期结直肠癌患者,研究常规辅助化疗后ctDNA检测呈阳性的患者接受追加全身化疗的疗效;此外,定制化研究(试验编号NCT04264702)也在前瞻性探究ctDNA检测在Ⅰ - Ⅳ期结直肠癌患者治疗方案制定中的作用。这些临床试验的结果有望进一步明确ctDNA检测在临床肿瘤学中的应用价值。在相关结果公布之前,本研究已证实ctDNA可作为一种预后标志物。在传统监测手段可靠性不足的情况下,该标志物可作为强有力的预后评估指标,同时也有助于将腹膜转移瘤患者纳入临床试验,特别是针对CRS-HIPEC后ctDNA水平升高的患者,探索尽早启动二线化疗或靶向治疗的疗效相关研究。
本研究存在一定局限性:其一,样本量相对较小且为回顾性研究;其二,研究纳入了两种生物学特性存在差异的原发肿瘤引发的腹膜转移瘤患者,并对其进行合并分析,这可能影响研究结果的普适性;其三,本研究未检测患者术前ctDNA水平,不过为弥补这一不足,研究对象均限定为微小残留病灶阴性的患者;其四,细胞减灭术联合或不联合腹腔热灌注化疗后,ctDNA检测的最佳时间节点尚未明确,目前也无法确定对患者的ctDNA监测应持续至术后何时。值得注意的是,有1例患者在接受CRS-HIPEC 15个月后,ctDNA检测结果转为阳性,后续该患者确诊肿瘤复发。此外,本研究设计未涉及针对ctDNA检测转阳患者调整治疗方案的相关探索。尽管存在上述不足,本研究仍凸显了新型肿瘤靶向检测技术在接受根治性手术的腹膜转移瘤患者复发监测中的应用潜力。
本回顾性研究表明,基于NGS的个体化tumor-informed ctDNA检测,在接受根治性细胞减灭术联合或不联合腹腔热灌注化疗患者的肿瘤复发检测中,具有较高的灵敏度和特异性,且相较于传统影像学监测,中位预警时间提前了3个月。未来,通过前瞻性临床试验进一步验证ctDNA作为预后及诊断生物标志物的临床有效性与应用价值,有望进一步明确该标志物在临床中的应用价值。
参考文献:
Dhiman, Ankit et al. “Role of Tumor-informed Personalized Circulating Tumor DNA Assay in Informing Recurrence in Patients With Peritoneal Metastases From Colorectal and High-grade Appendix Cancer Undergoing Curative-intent Surgery.” Annals of surgery vol. 278,6 (2023): 925-931. doi:10.1097/SLA.0000000000005856
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)