首页 > 医疗资讯/ 正文
三阴性乳腺癌(TNBC)是一种极具侵袭性的乳腺癌亚型,其特征是缺乏雌激素受体、孕激素受体以及表皮生长因子受体2(HER2)的表达。由于缺乏这些治疗靶点,TNBC的治疗选择相对有限,主要依赖化疗,导致其复发率、转移率较高,预后较差。与其他乳腺癌亚型相比,TNBC具有更高的肿瘤突变负荷(TMB)、更多的肿瘤浸润淋巴细胞(TILs)以及更高的程序性死亡配体1(PD-L1)表达水平,这表明其具有更强的免疫原性,可能对免疫检查点抑制剂(ICI)更为敏感。在晚期TNBC患者中,IMpassion130试验显示,将PD-L1抑制剂阿替利珠单抗与白蛋白结合型紫杉醇联合使用,可显著改善PD-L1阳性患者的无进展生存期(PFS)。KEYNOTE - 355试验则表明,帕博利珠单抗联合化疗相较于单独化疗,能延长PD-L1综合阳性评分(CPS)≥10的晚期TNBC患者的PFS和总生存期(OS)。在早期TNBC患者中,KEYNOTE - 522和IMpassion - 031试验均证明,新辅助ICI治疗可提高病理完全缓解(pCR)率,并延长无事件生存期(EFS)。然而,这些试验也显示,在新辅助临床试验中,无论PD - L1状态如何,添加ICI在不同亚组人群中的获益并无显著差异,这凸显了TNBC在临床特征和治疗反应上的高度异质性,为治疗靶点的确定和精准治疗的开发带来了挑战。
为了识别可能从免疫治疗中获益的特定人群,进一步开展试验以明确免疫治疗反应的生物学特征和新型生物标志物显得尤为重要。新辅助免疫治疗利用TNBC患者相对较高的肿瘤抗原负荷,促进效应T细胞的激活,从而增强对亚临床转移病灶的监测和清除能力,在早期临床试验中已显示出良好的应用前景。然而,NeoTRIP试验中,阿替利珠单抗联合卡铂和白蛋白结合型紫杉醇的新辅助化疗8个周期,并未在统计学上显著提高pCR率和无事件生存期(EFS)。尽管以蒽环类和紫杉类为基础的化疗一直是TNBC新辅助化疗的首选方案,但基于铂类的化疗因其较高的毒性,仍常被用作新辅助免疫治疗的骨干药物。因此,免疫治疗联合的最佳化疗骨干方案目前仍存在争议。
替雷利珠单抗是一种人源化IgG4变异型单克隆抗体,靶向程序性死亡蛋白1(PD - 1),与帕博利珠单抗相比,其对PD - 1具有更高的亲和力和更慢的解离速率,理论上可提高疗效。已有研究表明,替雷利珠单抗联合化疗作为一线治疗可提高食管鳞状细胞癌(ESCC)和转移性鼻咽癌患者的生存率。然而,关于其在TNBC新辅助治疗中的应用研究较少。基于此,本研究开展了一项前瞻性、单臂临床研究,旨在评估替雷利珠单抗联合白蛋白结合型紫杉醇和蒽环类为基础的化疗在TNBC新辅助治疗中的疗效和安全性。

方法
TREND是一项前瞻性、单臂、单中心的II期临床试验,在中国辽宁肿瘤医院进行。研究纳入未经治疗的TNBC患者,这些患者至少满足以下条件之一:肿瘤最大径≥2.0 cm(无论淋巴结状态如何);淋巴结阳性(无论肿瘤大小如何);无远处转移;且既往未接受过治疗。患者需为女性,年龄≥18岁,东部肿瘤协作组(ECOG)体能状态评分为0或1。排除标准包括存在远处转移、既往接受过针对免疫检查点通路的靶向治疗、自身免疫性疾病、免疫缺陷或使用免疫抑制剂、活动性病毒或细菌感染等。所有入组患者接受替雷利珠单抗联合白蛋白结合型紫杉醇和表柔比星/环磷酰胺(nab - P - EC)的联合治疗,共8个周期(每周期3周)。在每个周期的第1天给予替雷利珠单抗(200 mg)静脉注射。在前4个周期,每周的第1天给予白蛋白结合型紫杉醇(100 mg/m²,静脉注射),后4个周期则在每3周的第1天给予表柔比星(75 mg/m²,静脉注射)和环磷酰胺(600 mg/m²,静脉注射)。完成8个周期的联合治疗后,患者在2 - 4周内接受手术。手术方式由外科医生决定,包括乳腺肿块切除术或乳房切除术(针对乳腺病灶),以及前哨淋巴结活检或腋窝淋巴结清扫术(针对腋窝淋巴结)。主要终点为pCR,次要终点包括根据RECIST v1.1标准评估的ORR和安全性。
研究结果
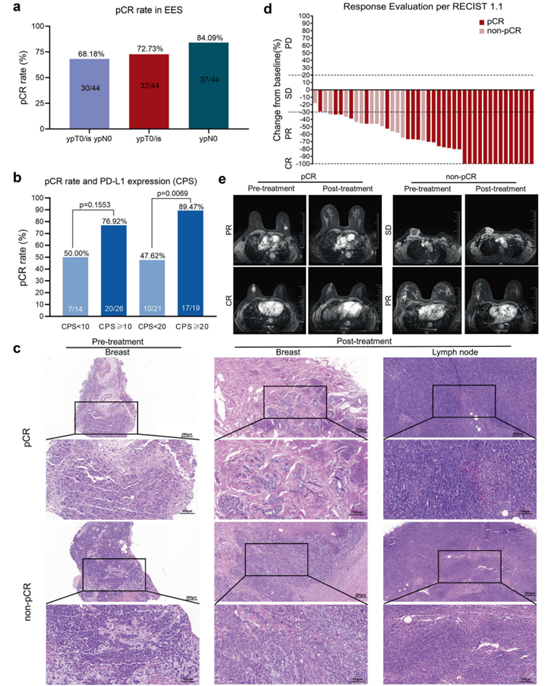
在EES中,pCR的主要分析结果显示,68.18%(30/44)的患者达到总pCR(tpCR,包括ypT0/Tis ypN0)。进一步评估原发性肿瘤(ypT0/Tis)或腋窝淋巴结(ypN0)的疗效发现,72.73%(32/44)的患者达到乳腺pCR(bpCR,ypT0/Tis),84.09%(37/44)达到ypN0。对于亚组分析以确定对新辅助替雷利珠单抗和化疗有积极反应的人群,按PD - L1的CPS对EES中的患者进行分组。在CPS截断值为10时,CPS高组和CPS低组之间的治疗反应无显著差异。然而,在CPS截断值为20时,89.47%(17/19)的CPS高患者达到tpCR,而CPS低组为47.62%(10/21)(p = 0.0069)。这些结果表明,高CPS(即>20)可能作为预测早期TNBC(eTNBC)患者新辅助免疫治疗疗效的生物标志物。
使用实体瘤疗效评价标准(RECIST)V1.1定义评估的次要终点客观缓解率(ORR)显示,在EES中,61.36%(27/44)的患者达到部分缓解(PR),31.82%(14/44)达到完全缓解(CR),ORR为93.18%,疾病稳定(SD)率为4.55%(2/44)。总体而言,疾病控制率(DCR = CR + PR + SD)为97.73%(43/44)。
安全性分析
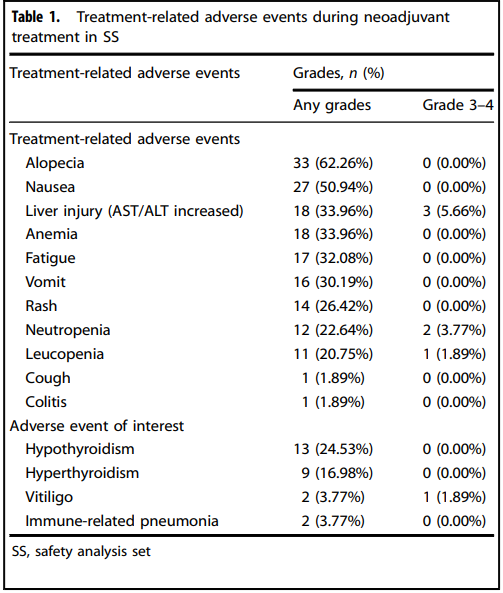
对SS中患者的安全性和毒性进行评估,包括所有等级的治疗相关不良事件(TRAEs)。结果显示,90.57%(48/53)的患者出现任何等级的TRAE,11.32%(6/53)的患者出现3 - 4级TRAE。在TRAE类型中,62.26%(33/53)的患者出现脱发,50.94%(27/53)出现恶心,33.96%(18/53)出现肝损伤,33.96%(18/53)出现贫血,32.08%(17/53)出现疲劳,30.19%(16/53)出现呕吐,22.64%(12/53)出现中性粒细胞减少,20.75%(11/53)出现白细胞减少,1(1.89%)出现咳嗽,26.42%(14/53)出现皮疹,1(1.89%)出现腹泻。甲状腺功能减退(24.53%,13/53)是最常见的免疫相关不良事件,其次是甲状腺功能亢进(16.98%,9/53)、白癜风(2,3.77%)和免疫相关肺炎(2,3.77%)。在严重TRAEs中,3(5.66%)例患者出现3 - 4级肝损伤(AST/ALT升高),2(3.77%)例出现3 - 4级中性粒细胞减少,1(1.89%)例出现3 - 4级白细胞减少,1(1.89%)例出现白癜风。最终,4(7.55%)例患者因TRAEs停止新辅助治疗。
结论
本研究结果表明,替雷利珠单抗联合白蛋白结合型紫杉醇和表柔比星/环磷酰胺的无铂、低剂量化疗作为TNBC的新辅助治疗方案,具有良好的疗效和可控的安全性。pCR率达到68.18%,且治疗相关的毒性反应在可接受范围内。免疫反应在pCR患者中早期被激活,新辅助治疗后CDKN1A + CD8 T淋巴细胞的富集可能与治疗获益相关。未来的随机对照试验对于进一步验证这些发现至关重要,有望为TNBC的治疗提供更精准、有效的治疗策略。
原始出处
Zhang, Q., Wang, M., Li, Y., Zhang, H., Wang, Y., Chen, X., Yao, L., Cui, M., Dong, H., Li, X., Liu, J., Zhu, B., & Xu, Y. (2025). Efficacy, safety and exploratory analysis of neoadjuvant tislelizumab (a PD-1 inhibitor) plus nab-paclitaxel followed by epirubicin/cyclophosphamide for triple-negative breast cancer: a phase 2 TREND trial. Signal Transduction and Targeted Therapy, 10(1), 169. https://doi.org/10.1038/s41392-025-02254-3.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)