首页 > 医疗资讯/ 正文
胰腺导管腺癌(PDAC)是一种恶性程度极高的癌症,由于诊断时多为晚期、手术切除率有限且复发频繁,患者预后较差。传统生物标志物(如CA19-9)和影像学技术通常难以检测到微小残留病灶(MRD)或早期复发。循环肿瘤DNA(ctDNA)作为一种有前景的非侵入性生物标志物,可能实现疾病复发的早期检测,为患者管理提供潜在改善。本研究旨在评估ctDNA作为PDAC患者预后工具的效用,尤其是在预测复发和总生存期(OS)方面的价值。 本回顾性研究分析了39例接受手术治疗的PDAC患者数据,采用Signatera™(一种tumor-informed多重PCR-NGS检测方法)监测ctDNA水平。术前和术后均采集血样,通过检测ctDNA水平评估MRD。研究对比了ctDNA与CA19-9在检测疾病复发中的敏感性、特异性、阳性预测值(PPV)和阴性预测值(NPV),并评估了ctDNA状态与无进展生存期(PFS)和OS等临床结局的相关性。
研究共分析了39例患者的153份血浆样本,其中17例患者ctDNA检测呈阳性。ctDNA检测复发的敏感性为91%,高于CA19-9的83%,联合检测时敏感性达98%。ctDNA阳性与OS和PFS显著缩短相关:ctDNA阴性患者的中位OS为37.6个月,而ctDNA阳性患者仅为13.4个月(p=0.003)。从ctDNA阳性到影像学确认复发的中位时间为81天。此外,ctDNA阳性还与更高的淋巴管血管侵犯率和手术切缘阳性相关,表明此类患者的肿瘤恶性程度更高。
ctDNA是检测PDAC患者MRD和预测复发的高敏感性和特异性生物标志物,性能优于CA19-9。ctDNA阳性与更差的预后(包括更短的OS和PFS)相关,可能有助于指导治疗决策。这些发现表明,ctDNA可能成为PDAC个性化管理的有价值工具,但仍需进一步前瞻性研究验证其在治疗分层中的临床作用。
研究背景
2019年,美国估计有56,770人新诊断为胰腺癌,约46,000人死于该疾病。尽管过去二十年中胃癌和结直肠癌的死亡率呈下降趋势,但胰腺癌的死亡率并未降低。目前,胰腺癌约占所有癌症诊断的3%和癌症相关死亡的7%。预计到2030年,胰腺癌将成为癌症相关死亡的第二大原因。
约80-90%的胰腺恶性肿瘤属于胰腺导管腺癌(PDAC)。PDAC死亡率高的一个主要原因是大多数患者确诊时已处于疾病晚期。确诊时,仅有一小部分(具体为15-20%)患者被认为适合手术干预。此外,即使接受切缘阴性手术的患者预后仍不理想,5年生存率仅为10-25%,中位生存期为10-20个月。美国国家综合癌症网络(NCCN)建议,可切除PDAC患者术后需接受6个月的辅助化疗以实现治愈意图。然而,超过75%的患者术后会出现复发。PDAC的总体5年生存率目前为12%,而转移性疾病患者的5年生存率则降至3%。值得注意的是,NCCN专家组和其他专业胰腺癌中心目前建议,极有可能出现早期转移迹象的患者需在手术干预前6个月接受新辅助治疗。美国临床肿瘤学会(ASCO)指南也建议,对于可切除但无法立即手术的PDAC患者应采用新辅助治疗。
治疗方案的优化依赖于识别高复发或进展风险的患者,这类患者最能从新辅助和辅助系统治疗中获益。近期前瞻性试验表明,辅助治疗适用于所有可切除或交界可切除的PDAC患者。然而,辅助治疗并非适用于所有接受手术切除的患者,主要原因是术后并发症发生率较高。此外,术后患者常需降低化疗剂量,这可能导致治疗效果下降。从这一角度看,新辅助治疗可能是更优选择,因为它可用于计划接受治愈性手术的更多患者,且治疗有效率更高。目前,临床医生通过综合临床症状、CA19-9和CT或MRI监测疾病。但CA19-9水平在癌症和非癌性疾病(如胆道炎症或梗阻)中均可能升高,因此其作为生物标志物的特异性不足。此外,传统影像学技术通常不足以敏感检测MRD——MRD定义为常规影像学或实验室检查无法检测到但可能导致复发的残留癌细胞。
ctDNA是一种能够在影像学检查前检测疾病复发的血液生物标志物。液体活检作为一种新兴技术,无需有创操作即可收集体内循环的肿瘤物质,其在各种胃肠道恶性肿瘤中的有效性正被广泛研究。预计该技术相比现有诊断标准具有实践和理论双重优势。近年来,游离DNA(cfDNA)、ctDNA、肿瘤来源外泌体和循环肿瘤细胞(CTCs)在PDAC中的应用备受关注。多项癌症研究表明,ctDNA是检测MRD和指导治疗决策的可靠技术。本研究使用Signatera™(一种特殊的多重PCR下一代测序(NGS)检测方法)动态追踪ctDNA水平,旨在验证ctDNA作为疾病监测工具的价值——评估围手术期治疗效果,并在随访中预测复发可能性。此外,研究者旨在确认ctDNA作为复发可靠指标的实用性,以优化治疗全程的患者风险分层。
研究方法
血浆样本于手术前后采集,用于ctDNA 检测;此外,在整个监测期内均进行 ctDNA 分析。初始ctDNA通常在术后14 -534日采集,中位时间为75日,之后每1 - 3个月采集1次,直至患者死亡或最后一次随访。采用 Signatera™多重 PCR-NGS 方法检测和定量组织特异性 DNA。对同一患者的血液 cfDNA 和肿瘤组织块进行全外显子测序,通过对肿瘤组织和匹配的正常组织(胚系)进行测序以识别患者特异性突变,从而设计定制化的个性化检测方案,该方案靶向肿瘤特异性克隆突变并过滤胚系突变。若血浆样本显示至少两种不同突变,则判定为ctDNA 阳性。ctDNA 定量通过计算每毫升血浆中肿瘤分子平均数(MTM)实现。
研究结果
患者特征:
本研究纳入39例PDAC患者(18例女性,21例男性),共分析153份血浆样本。患者诊断时的中位年龄为67岁(范围:41-83岁)。初始ctDNA阴性(ctDNA(-),N=22)和阳性(ctDNA(+),N=17)患者的基线特征具有可比性(见表1)。ctDNA(-)患者中可切除病灶比例更高(18/21),显著高于ctDNA(+)组(11/17)。接受手术切除的患者中,ctDNA(-)组的切缘阴性率更高(94% vs. 64%),而ctDNA(+)组的淋巴管血管侵犯(LVI)率显著更高(91% vs. 28%)。
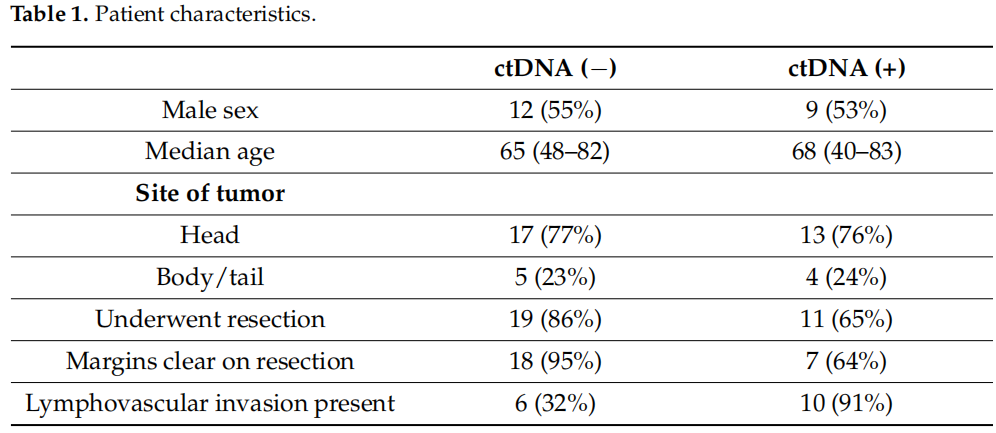
表1
ctDNA检测MRD:
29例接受PDAC手术的患者中,15例(52%)在MRD监测窗内(切除术后3个月内)采集了ctDNA样本,其中9例(60%)呈阳性。这9例患者均在后续影像学检查中确认疾病进展(检测率100%)。29例患者中26例接受了吉西他滨+白蛋白紫杉醇或FOLFIRINOX辅助化疗。2例ctDNA(-)患者在辅助治疗外还接受了新辅助化疗(见图1)。
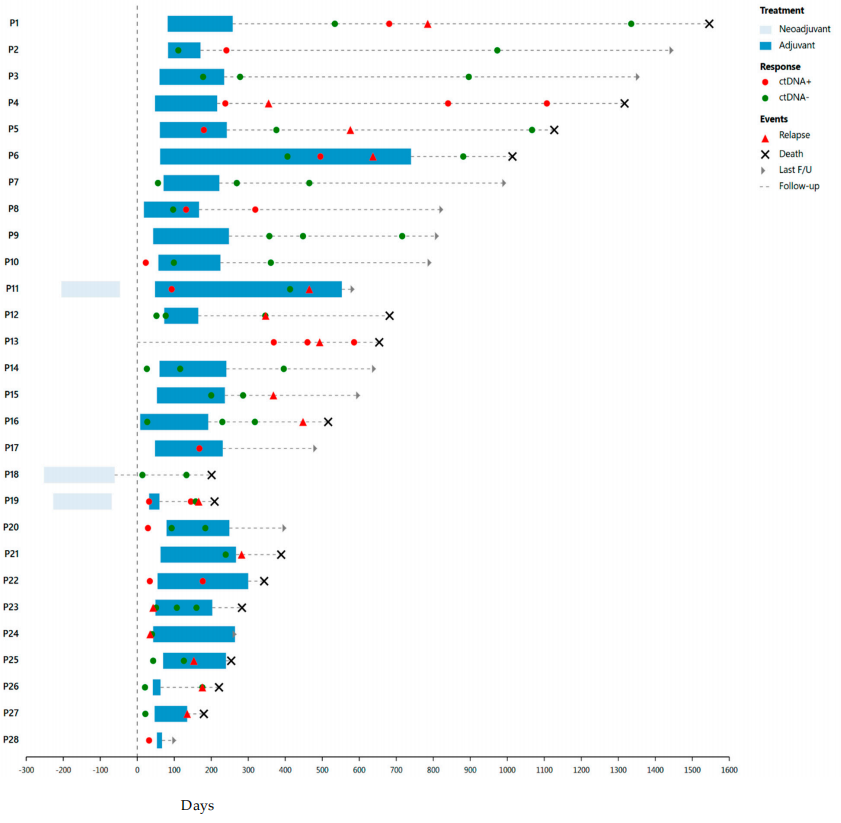

图1
与CA19-9相比,ctDNA检测的敏感性、特异性、阳性预测值和阴性预测值列于表2。简而言之,在这种情况下,阳性预测值是衡量ctDNA阳性结果表明残留PDAC的准确性。
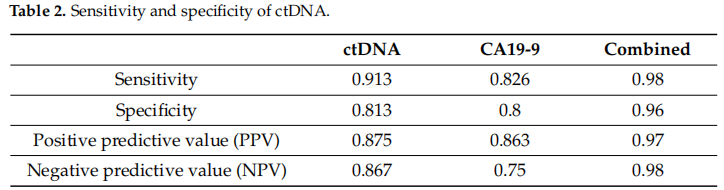
表2
ctDNA检测经CT确认的残留或进展性疾病的敏感性为91%(CI 72–99%),阴性预测值(NPV)为87%(CI 60–98%),均高于CA19-9(83% (CI 61–95%)和75% (CI 48–93%))。两者特异性相近(81% vs. 80%)。值得注意的是,联合检测时敏感性和特异性提升至98%和96%,阳性预测值(PPV)和NPV相应提高至97%和98%。
ctDNA作为预后标志物:
术后MRD监测窗内采集ctDNA的15例患者中,8例阳性、7例阴性。15例患者中14例(除1例接受新辅助化疗的ctDNA(-)患者外)接受了辅助化疗。接受手术切除的患者中,14例至少一次ctDNA阳性与疾病复发/进展相关,从ctDNA阳性到CT确认复发/进展的中位时间为81天(图1),凸显了ctDNA预测疾病进展的价值。
ctDNA(-)和ctDNA(+)组的中位随访时间分别为22个月和11个月(p=0.009)。初始ctDNA阴性患者(包括2例切缘阳性者)的中位无进展生存期(mPFS)为12.3个月(范围5.5–37.4个月),显著长于ctDNA(+)患者的8.7个月(范围1.1–26.2个月)。多数接受辅助化疗的患者在治疗期间出现进展(图1)。ctDNA(-)患者的中位OS为37.6个月(95% CI: 20.9–49.5),显著长于ctDNA(+)患者的13.4个月(95% CI: 6–21.8)(图2)。总体而言,初始ctDNA阳性患者的死亡风险是阴性患者的3.97倍(HR: 3.97, 95% CI: 1.61–9.80, p=0.003)。
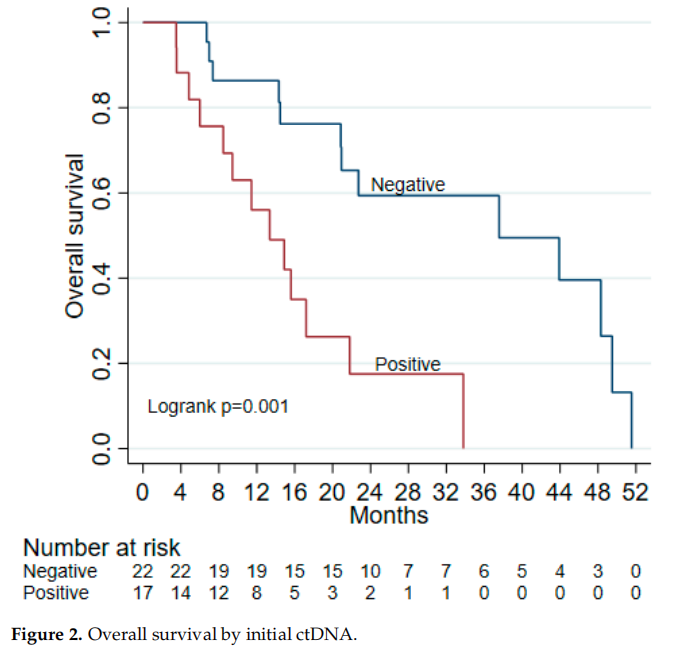
图2
讨 论
ctDNA阳性与胰腺癌切除患者的PFS和OS缩短相关。例如,一项研究显示,ctDNA可检测到组与不可检测到组的中位生存期分别为13.6个月和27.6个月,与本研究结果相似。与其他监测工具(如CA19-9或基于常见突变基因panel的ctDNA检测)相比,tumor-informed ctDNA被认为是敏感性和特异性更高、预后价值更强的检测方法。本研究通过分析本院患者的tumor-informed ctDNA样本,发现ctDNA(-)与ctDNA(+)患者的OS差异达24.2个月,进一步支持ctDNA作为PDAC预后生物标志物的价值。
辅助化疗适用于局限性胰腺癌,tumor-informed ctDNA可在MRD监测窗内作为预后工具,并在监测窗外用于复发监测。Lee等的Meta分析显示,基线和术后ctDNA阳性分别与总生存期降低(HR 2.27和HR 3.66)及更高的复发风险相关。本研究中,患者在MRD监测窗内外均接受了ctDNA检测。ctDNA阳性与年龄、性别或胰腺肿瘤位置无关,但ctDNA阴性与切缘阴性和无LVI相关,而这两者本身即为阳性预后因素。本研究中初始ctDNA阳性患者的高危特征(切缘阳性36% vs. 5%,LVI 91% vs. 32%)比例更高,提示该人群可能尤其需要辅助治疗。事实上,本研究及其他研究的数据均支持将ctDNA检测与其他预后因素结合,以预测患者结局并指导治疗决策。
与结直肠癌、胆管癌等其他胃肠道恶性肿瘤相比,PDAC的复发监测因缺乏敏感且特异的肿瘤标志物而更具挑战性。鉴于该疾病的高度侵袭性,长期以来亟需一种更敏感且易获取的检测方法。本研究显示,作为监测手段,ctDNA的敏感性高于常用的CA19-9。联合使用两者可在影像学检测前更敏感地监测生化疾病进展,提高敏感性和特异性。既往研究表明,ctDNA水平在治疗开始后显著下降,而在进展时升高,较CA19-9具有更早预警的优势。因此,ctDNA单独或与CA19-9联合可更可靠地追踪治疗反应,有望成为指导PDAC(包括局限性、交界可切除和转移性疾病)各阶段治疗决策的有力工具。持续ctDNA阳性提示肿瘤生物学行为侵袭,可能需要替代治疗方案,而阴性结果则可考虑降级治疗。
本研究存在一些局限性,包括样本量较小、回顾性单中心设计。尽管仅部分患者在MRD监测窗内进行了ctDNA检测,但结果表明,无论在诊断或手术何时发现ctDNA阳性,均与更差预后强烈相关,这有助于指导临床医生对高危患者进行更密切的监测和更积极的治疗。此外,切除患者缺乏术前ctDNA样本,未来研究可探索术后ctDNA水平变化的预后价值。尽管存在这些局限,本研究仍为ctDNA在PDAC管理中的作用提供了有价值的见解,支持其作为疾病监测和预后评估的潜在生物标志物。
目前亟需随机前瞻性试验评估ctDNA在PDAC新辅助和辅助治疗中的预后和风险分层价值。例如,CASPER试验(NCT05853198)旨在评估ctDNA作为可切除PDAC患者手术无效标志物的价值,终点为术后2年内复发。法国FRENCH.MRD.PDAC试验尚未开始招募,其目标是确定根治性手术和辅助化疗后的无病生存期(DFS)及ctDNA检测状态。总体而言,ctDNA有望成为PDAC患者个性化管理的重要工具。
参考文献:
Zhang, Y.; Esmail, A.; Hassanain, H.; Dhillon, V.; Abdelrahim, W.; Al-Najjar, E.; Khasawneh, B.; Abdelrahim, M. Correlative Analysis of Tumor-Informed Circulating Tumor DNA (ctDNA) and the Survival Outcomes of Patients with Pancreatic Adenocarcinoma. Biomedicines 2025, 13, 1124. https://doi.org/10.3390/biomedicines13051124

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)