首页 > 医疗资讯/ 正文
2025年6月2日,王福俤教授团队在铜离子代谢研究领域取得突破性进展:首次明确证实,人体严重缺乏铜不仅可导致经典性贫血,更可能诱发一类临床表现高度类似白血病的特异性血液系统疾病。这项研究历时十年,系统揭示了铜在生理、营养及分子层面上的复杂功能,标志着铜代谢研究进入系统性、跨学科的新阶段。研究结果发表在近日学术期刊《科学通报》(《Science Bulletin》)上。

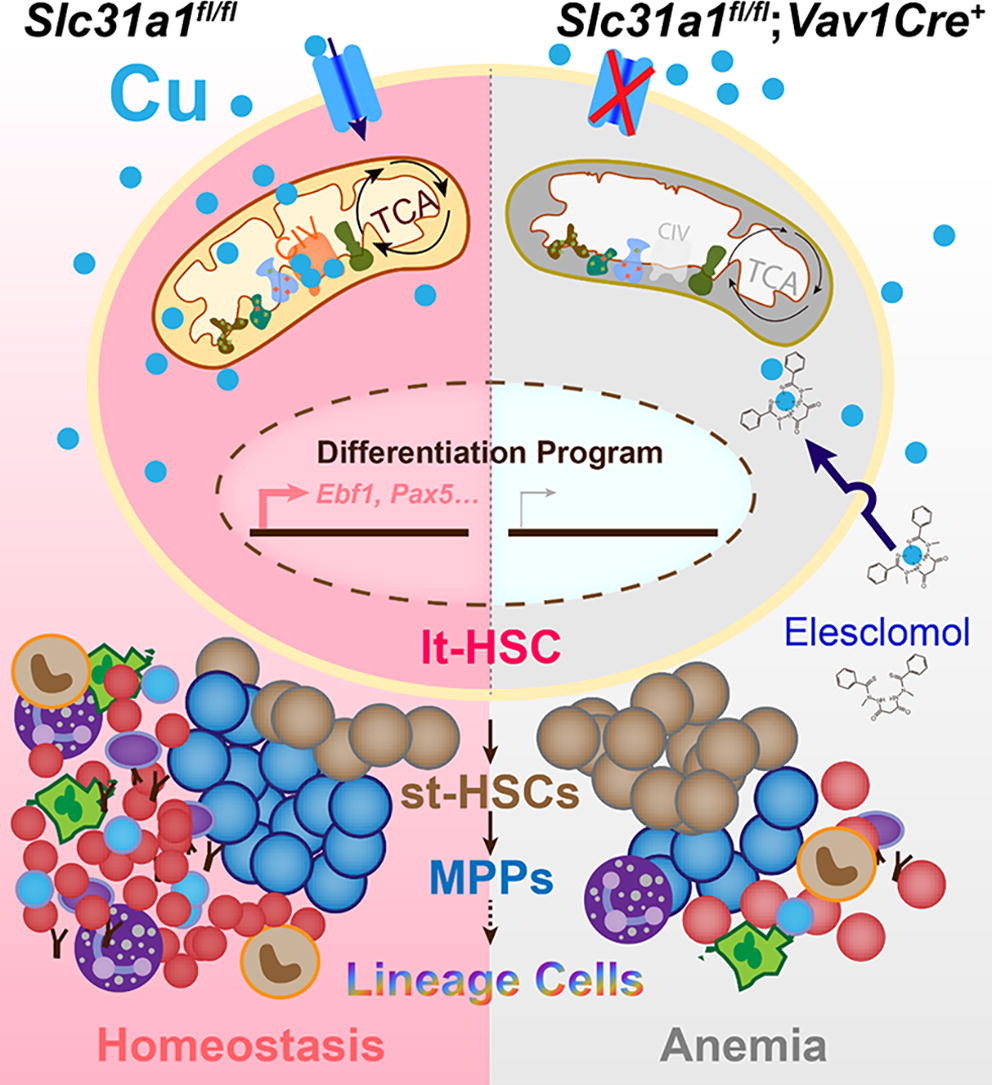
造血干细胞 (Hematopoietic stem cells, HSCs) 对于维持血液系统的稳态至关重要,它们通过自我更新和分化产生各种血细胞谱系。在稳态条件下,大部分HSCs处于休眠状态,代谢活性较低。当被激活并进行分化时,HSCs会经历代谢重编程,转向氧化磷酸化 (OXPHOS),进入细胞周期并启动分化程序。线粒体活性是HSCs分化和谱系定型的必要条件。
铁和铜等过渡金属离子是氧化还原反应(如OXPHOS)中的关键催化核心。铁代谢在造血中的作用已被广泛研究,但铜在造血中的确切作用尚不清楚。目前对铜在血液学中的理解主要来自铜缺乏患者的临床病例报告,这些患者通常表现为贫血和中性粒细胞减少。然而,铜稳态调控造血的具体机制,例如HSCs中哪个铜转运蛋白对造血至关重要,仍有待阐明。Slc31a1(也称为Ctrl1)是目前公认的定位在细胞膜上的高亲和力铜转运蛋白,在肠道和心脏等多种器官组织中负责铜的摄取。但SLC31A1是否在造血过程中发挥作用尚不明确。
此外,最近发现了一种新的程序性细胞死亡方式——铜死亡(cuproptosis),它与细胞内铜的积累和线粒体呼吸相关蛋白的脂酰化有关。Elesclomol是一种已知的铜离子载体,也被认为是潜在的铜死亡诱导剂。
本研究旨在通过饮食诱导的铜缺乏小鼠模型和造血特异性Slc31a1基因敲除小鼠模型,探讨膳食铜和Slc31a1在出生后造血过程中的作用及其机制,并评估elesclomol在铜缺乏相关造血缺陷中的潜在治疗作用。
二、研究的主要结果
-
膳食铜缺乏损害造血分化:
-
通过在怀孕后期及哺乳期给小鼠喂食缺铜饮食(CuD),成功建立了铜缺乏小鼠模型。这些小鼠表现出毛色变浅、骨髓、脾脏、心脏、肝脏和血清中铜含量降低、贫血(红细胞、血红蛋白、血细胞比容降低)、白细胞减少等症状,与铜缺乏患者的临床表现相似。
-
流式细胞术分析显示,CuD小鼠骨髓和脾脏中红系晚期细胞(R4,正染性红细胞母细胞)比例和数量显著降低,骨髓中B细胞(CD19+)比例和数量降低,而髓系细胞(Gr-1+CD11b+)比例和数量增加。胸腺中T细胞数量也显著降低。
-
在造血干/祖细胞(HSPCs)层面,CuD小鼠骨髓中Lin-细胞、多能祖细胞(MPPs)、共同淋巴祖细胞(CLPs)和粒/单核细胞祖细胞(GMPs)的比例和数量降低,而长期HSCs(LT-HSCs)和短期HSCs(ST-HSCs)数量增加,巨核/红系祖细胞(MEPs)比例和数量增加。这表明铜缺乏阻碍了HSCs向特定谱系祖细胞的分化。
-
-
造血细胞特异性敲除Slc31a1导致严重的造血缺陷:
-
构建了造血细胞特异性Slc31a1敲除小鼠(vKO小鼠,通过Vav1-Cre介导)。vKO小鼠在出生后两周开始出现生长迟缓,并在八周内全部死亡。
-
vKO小鼠表现出严重的贫血症状,包括红细胞、血红蛋白、血细胞比容、白细胞、网织红细胞和血小板数量显著降低,而平均红细胞体积(MCV)显著升高,与CuD小鼠表型一致。
-
vKO小鼠骨髓和脾脏中红系各阶段细胞、B细胞数量均显著减少,骨髓中髓系细胞比例增加,脾脏中T细胞数量减少。
-
vKO小鼠骨髓总细胞数显著降低,Lin-细胞、CMP、MEP、CLP、LT-HSC和MPP的比例和数量均降低,而ST-HSC的比例和数量增加。这表明Slc31a1对于维持ST-HSCs向MPPs的分化和定型至关重要。
-
骨髓移植实验表明,vKO小鼠的HSCs移植后无法有效重建受体小鼠的血液系统,证明Slc31a1在细胞内在性地维持HSCs的重建潜能。
-
-
Slc31a1通过其铜转运活性调控造血:
-
vKO小鼠的HSPCs中亚铜离子水平降低,而已知的铜缺乏反应基因(如Ccs, Sod1, Atp7a, Sco1)表达发生改变,表明Slc31a1缺失导致HSPCs铜缺乏。
-
体外实验显示,补充硫酸铜(CuSO4)或过表达野生型Slc31a1可以恢复vKO骨髓细胞的集落形成能力,而过表达无铜转运活性的Slc31a1突变体则不能。铜螯合剂BCS会抑制野生型骨髓细胞的集落形成能力。
-
-
Slc31a1和铜调控相似的HSC分化转录程序:
-
对vKO和对照组小鼠的LSK细胞(Lin-Sca1+c-Kit+,富含HSCs)进行RNA测序(RNA-seq)分析,发现大量差异表达基因,主要富集在细胞因子-细胞因子受体相互作用、细胞粘附分子和造血细胞谱系等通路。谱系决定性转录因子(如Ebf1, Pax5)和谱系细胞表面标志物(如CD19, IL7R)在vKO LSK细胞中表达下调。
-
对CuD和正常饮食(CuN)小鼠的Lin-cKit+细胞(富含HSPCs)进行RNA-seq分析,也发现了相似的通路变化和谱系相关基因的下调。
-
-
铜和Slc31a1维持HSPCs的线粒体活性和能量代谢:
-
蛋白质组学分析显示,在vKO和CuD小鼠的Lin-细胞中,与线粒体功能相关的蛋白(特别是线粒体呼吸链复合物IV的亚基,如Mtco1, Mtco2)表达下调。
-
vKO和CuD小鼠的HSPCs表现出线粒体形态异常(线粒体肿大、嵴结构破坏)、线粒体膜电位降低、线粒体质量增加(代偿性)、基础耗氧率和最大呼吸能力受损、ATP水平显著降低。
-
代谢组学分析显示,CuD小鼠的HSPCs中糖酵解、三羧酸循环和磷酸戊糖途径的多种中间代谢物水平升高,表明糖分解代谢紊乱。
-
用线粒体复合物IV抑制剂叠氮化钠处理野生型Lin-细胞,会导致MPP比例显著降低和集落形成能力受损,突显了复合物IV在HSC分化中的重要性。
-
-
Elesclomol(CuA1)在体外和体内挽救vKO小鼠的造血缺陷:
-
体内补充CuSO4未能延长vKO小鼠的寿命或改善贫血。
-
Elesclomol(ES,一种铜离子载体,研究者将其重命名为CupriActivitor1,简称CuA1)治疗vKO小鼠,可以部分恢复其生长、延长寿命、改善贫血症状(红细胞、血红蛋白、血细胞比容等指标改善)。
-
ES治疗部分恢复了vKO小鼠骨髓总细胞数、红系祖细胞和B细胞数量,以及HSPCs(包括Lin-细胞、LSK细胞、祖细胞和各阶段HSCs)的比例和数量。
-
ES治疗并未在vKO小鼠的HSPCs中诱导铜死亡(通过检测蛋白脂酰化水平判断)。
-
ES治疗部分恢复了vKO HSPCs中Mtco1和Mtco2的蛋白水平,降低了线粒体质量,提升了线粒体膜电位,增强了耗氧率和ATP水平。
-
然而,ES治疗未能改善CuD小鼠的血液学参数或HSPC的线粒体功能,这可能与CuD小鼠全身性铜缺乏,血清铜水平极低有关。
-
三、对结果的解读
-
膳食铜和铜转运蛋白Slc31a1对出生后造血至关重要: 本研究清晰地证明了充足的膳食铜摄入以及造血细胞自身通过Slc31a1摄取铜的能力,对于维持正常的出生后造血功能是不可或缺的。无论是全身性铜缺乏还是造血细胞特异性的铜摄取障碍,都会导致严重的贫血和造血衰竭。
-
铜通过维持线粒体功能调控HSC分化: 研究揭示了铜在HSC分化过程中的一个关键机制。Slc31a1介导的铜摄取主要通过维持线粒体呼吸链复合物IV(细胞色素c氧化酶,CCO)的亚基(特别是含铜亚基Mtco1和Mtco2)的稳定性和活性,从而保证线粒体正常的氧化磷酸化和ATP产生。线粒体功能受损会直接影响HSC向多能祖细胞(MPPs)的分化和后续的谱系定型,最终导致各类血细胞生成减少。
-
Elesclomol (CuA1) 作为铜离子载体的潜在治疗价值: Elesclomol能够将铜有效地转运到Slc31a1缺陷的造血细胞内,特别是线粒体中,从而部分恢复线粒体功能和造血功能。这一发现提示,对于因铜转运障碍(如Menkes病)或特定情况下细胞内铜利用障碍导致的疾病,Elesclomol可能具有潜在的治疗应用前景。重要的是,研究发现在这种挽救作用中,Elesclomol主要发挥的是铜离子载体的功能,而非诱导铜死亡。
-
铜缺乏对不同造血谱系的影响存在差异: 研究观察到,在铜缺乏或Slc31a1敲除的情况下,淋巴细胞谱系在祖细胞阶段就受到严重影响,红细胞谱系在祖细胞/前体细胞阶段也受到显著影响,而髓系细胞谱系相对不那么敏感。这提示不同血细胞谱系对铜的需求和依赖程度可能存在差异。
-
提出“铜学 (Cuprology)”新领域: 基于铜在生理和病理过程中复杂而关键的作用,作者提出建立一个新的交叉学科领域——“铜学”,以系统地研究铜在生物系统中的多方面功能,这将有助于更深入地理解铜在细胞存活和死亡中的双重角色,并促进针对铜相关疾病的创新治疗策略的开发。
总结
该研究深入探讨了铜稳态在出生后造血中的关键作用,明确了铜转运蛋白Slc31a1的核心功能,并揭示了铜通过调控线粒体能量代谢影响造血干细胞分化的分子机制。同时,研究还评估了铜离子载体Elesclomol在纠正铜相关造血缺陷方面的潜力,为理解和治疗铜相关血液疾病提供了新的视角和思路。
近年来,王福俤团队在铁死亡,铜死亡等领域做出巨大的贡献,发表了大量高水平的研究成果。以铁为例,“铁死亡”(ferroptosis)是近年来被广泛关注的一种新型程序性细胞死亡方式,其机制为过量铁离子催化脂质过氧化反应,引发细胞膜结构不可逆损伤,最终导致细胞破裂死亡。王福俤团队的研究显示,铁死亡机制与多种临床重大疾病密切相关,包括心血管疾病、慢性肝病、顽固性贫血、阿尔茨海默病、帕金森病及多种实体瘤等,构成了一个潜力巨大的治疗靶点网络。
在铁过载相关疾病(如地中海贫血、非酒精性脂肪肝)研究方面,团队研发的“铁死亡抑制剂”候选药物FOT1(Ferrroptosis Terminator 1)已进入II期临床试验阶段,显示出良好的安全性与治疗前景。
“人体微循环中静静流淌的金属离子,或许正是解锁生命密码的关键钥匙。”王福俤展望未来表示,随着“铜科学”、“铁科学”等新兴学科的持续推进,人类对微量金属元素的认知将不断深化,为重大疾病的机制研究与创新疗法开辟全新方向。
原始出处:
Integrative analysis of copper dysregulation and cuproptosis in postnatal hematopoiesis,https://doi.org/10.1016/j.scib.2025.05.019
猜你喜欢
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)