首页 > 医疗资讯/ 正文
胆道癌(BTCs)根据其解剖学起源进行分类,手术切除的可行性取决于肿瘤位置和进展程度。然而,对于不可切除的BTCs,全身治疗已被统一应用。吉西他滨和顺铂(GC)治疗及基于GC的治疗已被确立为BTC的一线标准治疗。然而,目前尚未确立高效的二线治疗方案,且预后仍然较差,这凸显了对进一步治疗进展的需求。与此同时,精准医学时代扩大了基因检测的应用,从而在BTC中识别出可干预的分子靶点。包括FGFR抑制剂和IDH1抑制剂在内的几种靶向疗法已被开发出来,为二线治疗提供了新的选择,并在适当的病例中具有一线使用的潜力。值得注意的是,这些基因变异的频率因肿瘤位置而异,表明BTC具有分子异质性。因此,人们已经认识到,为每位BTC患者制定个性化治疗方案可能比统一的全身治疗更有效。因此,尽管在开始全身治疗前进行常规基因检测目前受到医疗环境(如成本、可及性、地区差异)的限制,但ESMO指南推荐进行基因检测,并且该检测可能会越来越受到提倡。BTC存在广泛的基因变异,许多靶向疗法也在相应开发中。本综述概述了已报道的BTC基因变异、这些变异的频率以及相应的靶向疗法,强调了精准医学在BTC治疗中不断演变的作用。
研究背景
胆道癌(BTC)起源于沿胆道树分布的胆管细胞,从肝内胆管延伸至Vater壶腹。BTC 的分类高度多样化。根据解剖学起源,BTC 可分为肝内胆管癌(iCCA)或肝外胆管癌(eCCA)。eCCA可进一步细分为肝门部胆管癌(pCCA)、远端胆管癌(dCCA)或胆囊癌(GBC)。此外,Vater 壶腹癌(AVC)被视为一种独特的亚型,根据其细胞起源可归类为胆道癌、胰腺癌或十二指肠癌。尽管某些分类将 AVC 纳入 BTC 的子集,但其他分类则将其排除。尽管 BTC 是一种罕见的恶性肿瘤,但其全球发病率正在上升。
从历史上看,BTC 的分类一直与治疗目标一致。解剖学分类有助于评估肿瘤进展程度并确定合适的手术治疗方法。例如,需要肝切除术、肝外胆管切除术或胰十二指肠切除术的 BTC 已相应分组。然而,对于不可切除的 BTC,全身化疗已被普遍应用,将 BTC 视为起源于胆管细胞的单一实体。2010 年具有里程碑意义的 ABC-02 试验确立了吉西他滨和顺铂(GC)治疗作为 BTC 的标准治疗。GC 治疗对晚期 BTC 有效,并且已经测试了几种基于 GC 治疗的新疗法,其中一些疗法显示出更优的疗效。然而,目前尚未确立疗效充分的二线治疗方案,并且大多数报告显示晚期 BTC 的中位总生存期不足一年。
基因组分析的最新进展揭示了BTC 潜在的基因变异。特别是,由于能够获取足够的肿瘤样本进行分析,iCCA已成为基因组研究的焦点。研究揭示了可干预的突变,如 FGFR 和 IDH1/2 变异,导致了靶向疗法的开发,这些疗法已通过 II/III 期试验,并已在临床实践中广泛应用(表 1)。这些成功推动了对其他 BTC 亚型的进一步基因组研究,导致了更多可干预突变的识别和新靶向疗法的持续开发(表 1、表 2)。
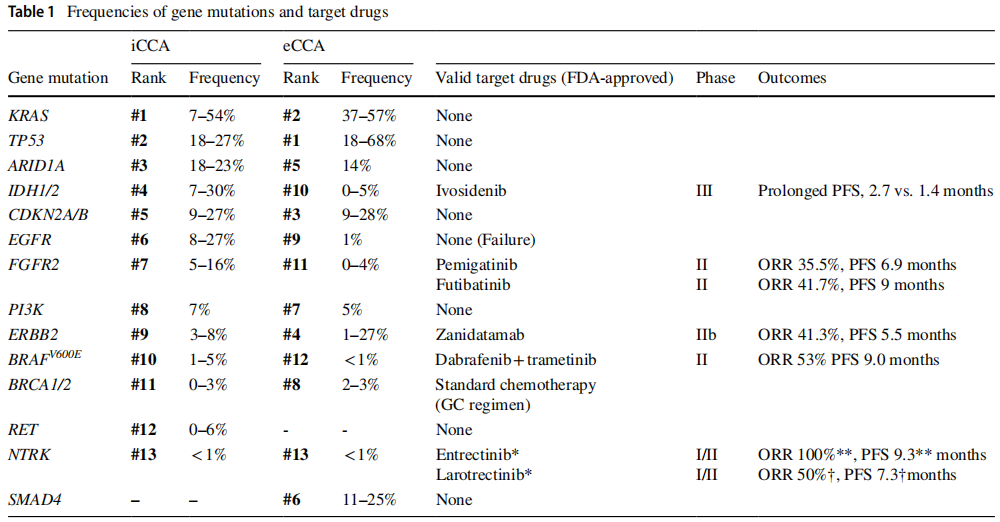
表1
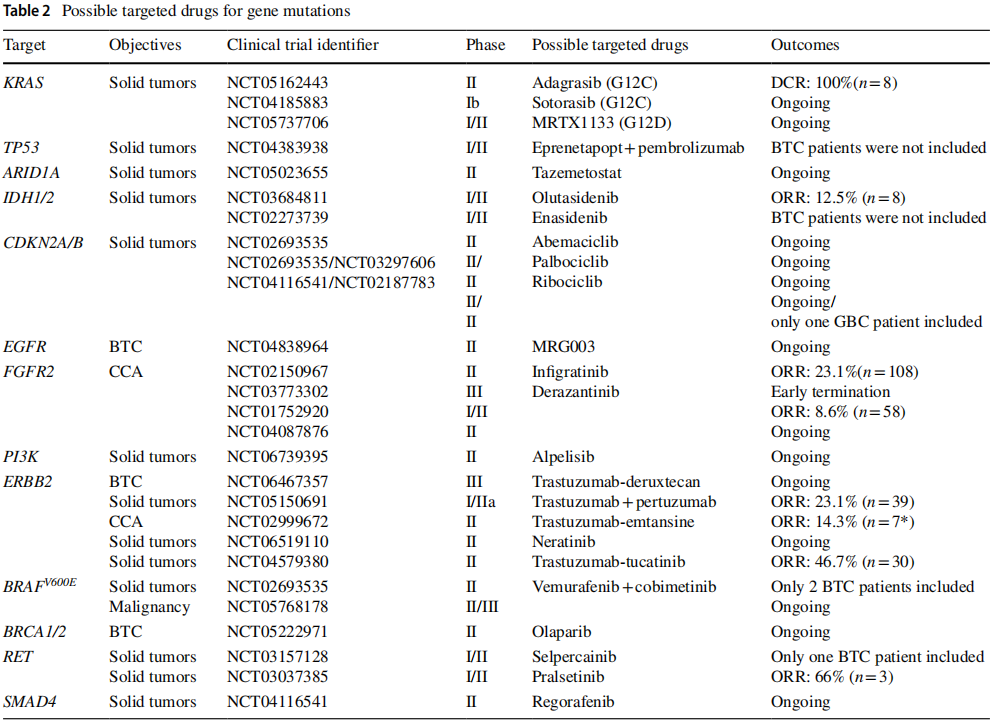
表2
有趣的是,BTC 解剖学分类亚型之间已揭示出不同的基因组特征(表 1)。这一发现可能表明,即使在起源于胆管细胞的癌症中,肿瘤位置和相关微环境在癌变过程中也起着重要作用。环境因素似乎也影响 BTC 的发病率,正如地理和种族差异所证明的那样。例如,BTC 的发病率在亚洲人中往往较高,尤其是在亚洲国家(亚洲发病率:3-10/10 万人口;欧美发病率:1-3/10 万人口)。
鉴于BTC 的异质性,一刀切的治疗方案的局限性已显而易见。精准医学,包括根据每位患者 BTC 的特定基因和分子特征选择合适的治疗方法,越来越被认为是必不可少的。在三分之一到一半的 BTC 病例中可识别出可干预突变。欧洲肿瘤内科学会(ESMO)在其 BTC 管理指南中提出了一种晚期 BTC 的治疗策略,即预先进行基因组检测,当存在可干预突变时优先选择靶向疗法。在没有此类突变的情况下,全身化疗仍然是标准治疗。NCCN 指南还建议对考虑进行全身化疗的 BTC 患者进行基因组检测。
因此,基因组检测和靶向治疗正迅速成为BTC 管理的核心。本综述的目的是总结基因组检测的现状、临床实践中可用的靶向疗法以及有前景的未来发展。
胆道癌亚型的基因组变异谱
为整合现有文献,本综述将BTC分为iCCA和eCCA,并对基因组突变研究结果进行总结。如表1所示,部分突变在亚型间共享,但iCCA与eCCA的突变频率存在显著差异。
iCCA:
iCCA的基因组突变已被广泛报道,相关文献数量逐年增加。不同研究中报道的突变类型和频率差异可能反映了流行病学、治疗环境及样本收集与保存条件的差异,但也存在显著共性。常见突变包括KRAS、TP53、ARID1A、IDH1/2、CDKN2A/B、EGFR和FGFR。较少见的突变,如PI3K、ERBB2和BRAF,也有报道。此外,尽管罕见,但NTRK融合和RET融合等可干预突变已有较多记录(表1)。
eCCA:
eCCA的基因组突变报道少于iCCA,但数量正在增加。eCCA常见突变包括KRAS、TP53和CDKN2A/B,而ERBB2突变在eCCA中频率较高,在iCCA中频率较低。IDH1/2突变和FGFR突变在eCCA中均罕见(表1)。
胆道癌中常见基因突变
IDH1/2突变:
IDH1突变见于7-30%的BTC,主要存在于iCCA(表1)。IDH1/2蛋白通常参与能量代谢,以NADP+为辅酶,将异柠檬酸转化为α-酮戊二酸(αKG)。然而,突变型IDH1/2蛋白无法产生αKG,反而以NADPH为辅酶,以αKG依赖的方式产生D-2-羟基戊二酸(D2HG)。这种功能改变会抑制αKG依赖的双加氧酶,破坏相关酶的活性,影响缺氧反应和表观遗传调控,从而促进肿瘤进展。最近,IDH1抑制剂(如艾伏尼布)已被开发出来,其在BTC中的疗效在III期试验(ClarIDHy试验,表1)中得到证实。由于其作用机制,IDH1抑制剂可对肿瘤产生广泛影响,与细胞毒性抗癌药物有根本区别,因此进一步研究其作为一线治疗或与现有疗法联合使用的潜力非常有前景。另一种IDH1抑制剂奥鲁他尼布(olutasidenib)已被批准用于治疗血液系统恶性肿瘤,在BTC中也显示出疗效(表2)。对于IDH2突变,恩西地平(enasidenib)已被开发并在实体瘤的临床试验中进行测试(表2)。然而,该试验未纳入BTC患者,仍有进一步研究的空间。未来,高度期待对BTC的IDH靶向治疗进行更多研究。
FGFR突变:
FGFR突变见于5-16%的BTC,主要存在于iCCA(表1)。这些基因产生的FGFR2融合蛋白以不依赖配体的方式激活酪氨酸激酶,导致FGFR通路的激活。FGFR通路的激活反过来激活下游通路,包括MAPK、PI3K-AKT和STAT通路,促进抗凋亡作用和细胞增殖。FGFR有五个亚基(FGFR1–5),几种FGFR抑制剂(佩米替尼,一种FGFR1–3抑制剂;英菲格拉替尼,一种FGFR1–5抑制剂;富替巴替尼(futibatinib),一种FGFR1–4抑制剂;和derazantinib,一种FGFR1-3抑制剂)已被开发出来,其治疗效果在II期试验中得到证实(表1,2)。临床试验表明,这些FGFR抑制剂作为单药治疗对标准治疗后有FGFR变异的患者有效。在这些药物中,佩米替尼和futibatinib已被FDA批准用于BTC。目前,正在进行国际III期试验,以比较这些药物与GC治疗作为一线治疗的效果(NCT03656536, NCT03773302和NCT04093362)。高度期待进一步的研究,如评估与现有抗癌药物的协同效应的研究。
ERBB2突变:
ERBB2变异在3–8%的iCCA病例和1–27%的eCCA病例中被发现(表1)。有ERBB2变异的癌细胞过表达HER2受体,增加配体敏感性并激活下游通路(如MAPK和PI3K-AKT通路)。BTC分子靶向疗法,如曲妥珠单抗、德曲妥珠单抗、帕妥珠单抗、图卡替尼和恩美曲妥珠单抗,最初是为HER2阳性乳腺癌开发的,已在II期试验中进行测试,结果良好(表2)。其中,泽尼达妥单抗(zanidatamab)已被FDA批准用于治疗HER2阳性BTC,在HERIZON-BTC-01试验中显示ORR为41.3%,PFS为5.5个月。进一步的临床试验正在进行中(表2),期待更多数据。
癌症中常见基因突变
KRAS突变:
目前,BTC中尚无获批的靶向KRAS突变的标准治疗方案。然而,由于KRAS突变在BTC中较为常见(7–57%,表1),相关靶向治疗的开发正在进行中。在BTC的KRAS突变中,G12C突变较为罕见(约1–2%),但KRAS G12C抑制剂(如阿达格拉西布和索托雷塞)已获FDA批准用于治疗非小细胞肺癌(NSCLC),目前正针对BTC开展临床试验(表2)。报告显示出有希望的治疗效果,未来适应症扩展值得期待。BTC中其他常见的KRAS突变包括G12D、G12V和G13D。靶向KRAS G12D的小分子抑制剂MRTX1133目前正在包括BTC在内的实体瘤临床试验中(NCT05737706),其进一步开发备受期待。
TP53突变:
iCCA和eCCA均频繁出现TP53突变(表1)。然而,目前尚无直接靶向TP53突变的药物,针对该突变的治疗仍处于开发阶段。TP53是抑癌基因,其突变在多种癌症中高度流行。TP53突变的多样性(错义突变、缺失和插入)以及p53蛋白的结构复杂性使得靶向治疗开发极具挑战性。尽管直接治疗手段有限,但间接策略正在探索中,例如通过小分子恢复突变型p53的功能。例如,APR-246(eprenetapopt)旨在通过结构稳定突变型p53并恢复其正常功能。目前,eprenetapopt与免疫检查点抑制剂的联合应用正在包括BTC患者的临床试验中进行研究(表2)。随着研究的进展,有望开发出针对TP53突变癌症的新型治疗策略。
ARID1A突变:
iCCA和eCCA均频繁出现ARID1A突变(表1)。ARID1A是SWI/SNF(Switch/Sucrose Nonfermentable)染色质重塑复合物的组成部分,属于抑癌基因。ARID1A突变会导致DNA修复缺陷和转录失调,促进肿瘤进展。目前尚无针对ARID1A突变的特异性靶向疗法,但多种间接治疗策略正在研究中。靶向DNA修复缺陷的PARP抑制剂和ATR抑制剂可能有效。此外,ARID1A突变可增加EZH2的活性,使EZH2抑制剂(如他泽司他)成为有前景的治疗选择。这些抑制剂正在BTC治疗的临床试验中进行评估(表2,NCT05023655)。Yoshino及其同事发现,ARID1A可降低胆管癌细胞中组蛋白H3K27乙酰化水平,提示其可能成为潜在治疗靶点。此外,携带ARID1A突变的肿瘤可能表现出高微卫星不稳定性(MSI-H)或高肿瘤突变负荷(TMB),可能对帕博利珠单抗和纳武利尤单抗等免疫检查点抑制剂敏感。
CDKN2A/B突变:
iCCA和eCCA均频繁出现CDKN2A/B突变(表1),但目前尚无直接靶向这些突变的治疗方法。CDKN2A是参与细胞周期调控的抑癌基因,编码p16(INK4A)和p14(ARF)蛋白,调控RB和p53通路。CDKN2A突变或缺失导致p16INK4A功能丧失,进而增加CDK4/6活性,引发细胞周期失控和肿瘤生长。因此,CDK4/6抑制剂(如派柏西利、瑞博西利和阿贝西利)成为潜在的间接治疗策略。这些抑制剂可诱导G1期细胞周期阻滞并抑制肿瘤增殖。目前,针对BTC的CDK4/6抑制剂正在临床试验中评估(表2,NCT02693535:TAPUR第4组、第17组,NCT04116541)。
EGFR突变:
EGFR突变在iCCA中频繁检测到(表1),但EGFR抑制剂(如西妥昔单抗、帕尼单抗、厄洛替尼)的临床试验尚未显示出足够疗效,目前尚无可用的靶向药物。靶向EGFR的药物MRG003正在针对EGFR过表达的BTC进行临床试验(表2,NCT04838964),其未来结果值得关注。
PI3K突变:
iCCA和eCCA偶见PI3K突变(表1),目前多种靶向PI3K突变的疗法正在开发中。PI3K突变会导致PI3K/AKT/mTOR信号通路失调,促进肿瘤生长和治疗耐药。该通路在多种癌症中频繁变异,PI3K抑制剂(包括选择性PI3K抑制剂阿培利司)已被开发,其中阿培利司基于SOLAR-1试验获FDA批准用于治疗PIK3CA突变的HR阳性、HER2阴性乳腺癌。目前,PI3K抑制剂在包括BTC在内的实体瘤中的临床试验正在进行中(表2,NCT06739395),期待治疗策略的进一步进展。
BRAF突变(V600E):
BRAF突变可见于多种癌症,其中V600E突变在黑色素瘤和结直肠癌中尤为常见。在BTC中,BRAF突变发生率低于5%,在iCCA中更为普遍(表1)。V600E突变导致MAPK通路在无配体刺激下异常激活,使其成为BRAF和MEK抑制剂的治疗靶点。达拉非尼(BRAF抑制剂)和曲美替尼(MEK抑制剂)在BRAF V600E突变BTC中的临床试验(ROAR试验)显示出良好结果,且这些药物已获FDA批准用于BTC治疗(表1)。维莫非尼与考比替尼的联合应用目前正在进行中的试验中评估(表2)。
BRCA1/2突变:
BRCA1/2基因突变在BTC中发生率为0-3%(表1),属于相对罕见突变。BRCA基因因与遗传性乳腺癌和卵巢癌相关而闻名,其突变会导致同源重组缺陷(HRD),引发DNA损伤积累并驱动癌变。携带BRCA1/2突变的癌细胞无法有效修复铂类化疗引起的DNA链间交联,预计可增强治疗效果。由于GC方案(吉西他滨+顺铂)是BTC的标准治疗,无论BRCA1/2突变状态如何,晚期BTC患者通常接受含铂治疗。此外,PARP抑制剂作为二线治疗有望延长疗效,相关临床试验正在进行中。
RET突变:
RET原癌基因编码跨膜受体酪氨酸激酶,RET突变可驱动多种癌症的致癌转化。在RET融合突变中,RET基因与伴侣基因(通常编码卷曲螺旋结构域)融合,导致不依赖配体的组成性二聚化和激酶激活。RET抑制剂塞普替尼和普拉替尼已在RET突变实体瘤患者中显示出治疗效果(表2)。尽管RET突变在BTC中相对罕见(0–6%,表1),但这些临床试验纳入了少数BTC患者,提示这些药物可能对RET突变的BTC患者有效。
NTRK突变:
尽管NTRK融合仅在0.2–0.7%的BTC患者中报道(表1),但它们被公认为多种肿瘤类型的致癌驱动基因。NTRK基因家族(NTRK1–3)编码TRK蛋白,在正常神经元发育中起关键作用。然而,TRK融合蛋白的形成会异常激活酪氨酸激酶活性,驱动肿瘤进展。两种口服NTRK抑制剂恩曲替尼和拉罗替尼目前已获批用于治疗晚期NTRK融合阳性实体瘤(包括BTC),两者在I/II期临床试验中均显示出临床获益。这些药物为NTRK融合的BTC患者提供了有前景的治疗选择。
SMAD4突变:
目前尚无针对SMAD4基因突变的特异性靶向疗法。然而,SMAD4是转化生长因子-β(TGF-β)信号通路的关键分子,该通路异常可见于多种癌症,因此正在研究靶向SMAD4突变间接影响通路的疗法。在FDA批准药物的临床试验中,MegaMOST试验的一部分正在评估瑞戈非尼在SMAD4双等位基因失活实体瘤中的应用(表2)。SMAD4突变在11-25%的eCCA患者中报道(表1),期待这些试验能为BTC开发出新的可干预药物。
讨 论
本综述总结了当前CCA基因组突变的频率及其靶向治疗潜力。有趣的是,IDH1突变很少与携带FGFR融合基因的病例重叠。NGS结果的聚类分析表明,根据IDH突变、FGFR突变、TP53突变和CDKN2A突变的存在,病例可分为四组。如果这些发现普遍成立,这些基因变异的累积频率表明,相当比例的BTC患者可能从这些靶向治疗中获益。目前,针对这些靶向疗法的多项临床试验正在进行中(表2),若取得积极结果,可干预基因组突变的比例预计在不久的将来显著增加,为改善预后带来希望。
当前主流基因组检测依赖肿瘤活检样本的NGS分析。然而,获取BTC(尤其是eCCA)的组织活检样本在安全性和确保足够组织质量以进行全面分子检测方面存在挑战,约70%的样本可产生足够肿瘤含量用于分析。对于样本不足的患者,血液来源的ctDNA分析已被应用。NCCN和ESMO指南建议首先考虑基于组织的基因组检测,若有困难则考虑ctDNA检测。ctDNA分析相比组织DNA测序具有侵入性小、可及性高的优势,对某些突变的诊断准确性较高(如一致性率:IDH1突变87%;BRAF V600E 87%)。但某些突变的一致性率较低,例如FGFR2融合,总体一致性率为18%,并因融合伴侣不同而异(FGFR2-BICC1融合58%,FGFR2-其他融合2.1%)。在临床实践中使用ctDNA时,需注意其局限性,同时该方法也具有实时监测基因组进化的潜力,期待进一步技术突破。
尽管靶向治疗前景广阔,但其局限性也逐渐显现。例如,靶向基因治疗的疗效通常在平均6-9个月后下降(表1),可能与赋予耐药性的继发突变有关。ctDNA分析显示,FGFR2基因存在新生点突变,可能在疾病进展时对BGJ398产生耐药性。Goyal及其同事在FGFR抑制剂英菲格拉替尼(BGJ398)的II期研究中报告了ctDNA分析在疾病监测和靶向治疗期间获得性耐药检测中的应用价值。在FIGHT-202试验中,Silverman及其同事利用组织或液体活检检测方法,对佩米替尼治疗FGFR重排的CCA患者报告了类似数据。因此,在靶向治疗中,无论是确定治疗资格还是预测疗效,使用血液样本分析ctDNA的价值预计将日益重要,凸显了该方法的重要性。
靶向治疗的突破与细胞毒性化疗的作用机制存在根本差异,可能产生更优疗效。此外,靶向药物与细胞毒性药物的联合可能产生协同、相加或拮抗效应,需要进一步探索最佳用药顺序和安全性。例如,作者证实FGFR抑制剂与吉西他滨存在潜在协同效应。另外,针对FGFR2抑制剂,新一代更强效的选择性FGFR抑制剂(如RLY-4008、KIN-3248)正在开发中,可能规避点突变引起的耐药性,其进展备受期待。表2主要列出了单独靶向治疗的试验,但化疗与靶向治疗联合的试验也日益增多,未来数据值得关注。
随着靶向治疗显示出显著疗效,需仔细评估其与手术干预结合的利弊。可能出现的策略包括:先启动靶向治疗,随后进行最小手术干预和辅助细胞毒性化疗(或免疫治疗)。
本综述概述了BTC基因组变异及相应靶向治疗的现状。未来,靶向治疗有望成为治疗规划的核心。随着治疗选择的日益复杂,利用人工智能(AI)进行治疗决策可能成为标准做法,但需要可靠数据和系统临床试验来有效训练AI系统。作者希望本综述为这些进展和最佳治疗框架的建立提供参考。
参考文献:
Yamada D, Kobayashi S, Doki Y, Eguchi H. Genomic landscape of biliary tract cancer and corresponding targeted treatment strategies. Int J Clin Oncol. Published online April 25, 2025. doi:10.1007/s10147-025-02761-x

猜你喜欢
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)