首页 > 医疗资讯/ 正文
高血压已成为全球面临的重大公共卫生挑战,与多种心血管并发症密切相关。目前临床常用的一线降压药包括ACEI、ARB、β受体阻滞剂、CCB和利尿剂这五大类。尽管选择多样,但传统靶点的广泛表达及代偿机制的激活使药物副作用和耐药性普遍存在,这使得许多患者的血压控制效果难如人意。因此,开发更精确和安全的新策略和新靶点,已成为当务之急。
瞬时受体电位香草酸4型(Transient receptor potential vanilloid 4, TRPV4)是一种广泛表达的非选择性阳离子通道,在血压调控中发挥关键作用,广泛分布于多种动脉的血管平滑肌细胞中。研究表明,Trpv4SMC−/−表现出较低的静息血压,这主要是由于通过α1肾上腺素能受体(α1AR)-TRPV4平滑肌细胞信号通路导致血管收缩增强,以及通过TRPV4 SMC-BK通道信号通路引起的血管舒张减弱所致。此外,TRPV4的活性受Ras同源蛋白A (Ras homolog family member A, RhoA)直接抑制,RhoA结合在TRPV4的ARD区域,限制其构象变化,从而稳定TRPV4通道处于关闭状态。因此,开发靶向TRPV4-RhoA复合物的拮抗剂,抑制钙离子内流,恢复血管收缩/舒张平衡,为高血压治疗提供新策略。
2025年6月16日,华东理工大学和华东师范大学药学院的李洪林/王蕊教授团队在Circulation上发表了题为“Inactivation of RhoA for Hypertension Treatment Through the TRPV4-RhoA-RhoGDI1 Axis”的研究论文。该研究综合运用冷冻电镜、邻近连接(PLA)技术及基因编辑模型,首次揭示了一种全新的非典型RhoA信号抑制模式—靶向“TRPV4-RhoA-RhoGDI1轴”,成功鉴定出天然产物AH001是该靶标轴的首个小分子抑制剂。同时,首次证实靶向TRPV4-RhoA-RhoGDI1轴可作为一种新型高血压疗法,为未来高血压机制研究与降压药物研发提供了新的思路和全新方向。

前期研究中,团队发现候选药物AH001具有抑制TRPV4通道的潜力。为了破解这个调控密码,研究团队借助冷冻电镜成功捕获到了TRPV4AH001-RhoA复合物的高分辨率结构,并详细分析了TRPV4和RhoA的结构状态。结果显示,当AH001结合时,TRPV4呈现闭合构象,而同时结合的RhoA处于GDP结合的失活状态。这一发现首次直观揭示了AH001如何诱导TRPV4与RhoA形成“共抑制”状态(图1)。
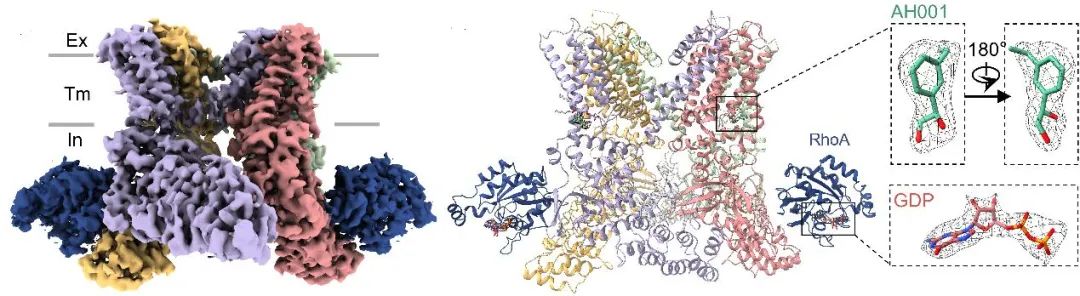
图1. hTRPV4AH001-RhoA冷冻电镜结构
为了更深入探究AH001如何影响TRPV4和RhoA的相互作用,研究团队在VSMCs和HEK293T细胞(高表达TRPV4和RhoA)中发现,AH001能够显著增强TRPV4与RhoA的结合,并有效抑制RhoA活性。然而,当TRPV4上的几个关键位点(D743E、K535A和D531A)发生突变时,AH001促进TRPV4-RhoA结合的能力被破坏,且对RhoA活性的抑制作用也大大减弱(图2A-D)。
考虑到RhoGDI1是RhoA的主要负调控因子,负责将无活性的RhoA-GDP隔离在细胞质中。本研究继续探讨了AH001对RhoGDI1和RhoA相互作用的影响。PLA分析显示,AH001促进了内源性RhoGDI1和RhoA之间的相互作用(图2E)。上述结果充分表明,AH001作用于TRPV4-RhoA-RhoGDI1轴,一方面增强TRPV4与RhoA的结合,另一方面促进RhoGDI1对RhoA的“管控”,双管齐下,最终实现对RhoA活性的有效抑制。
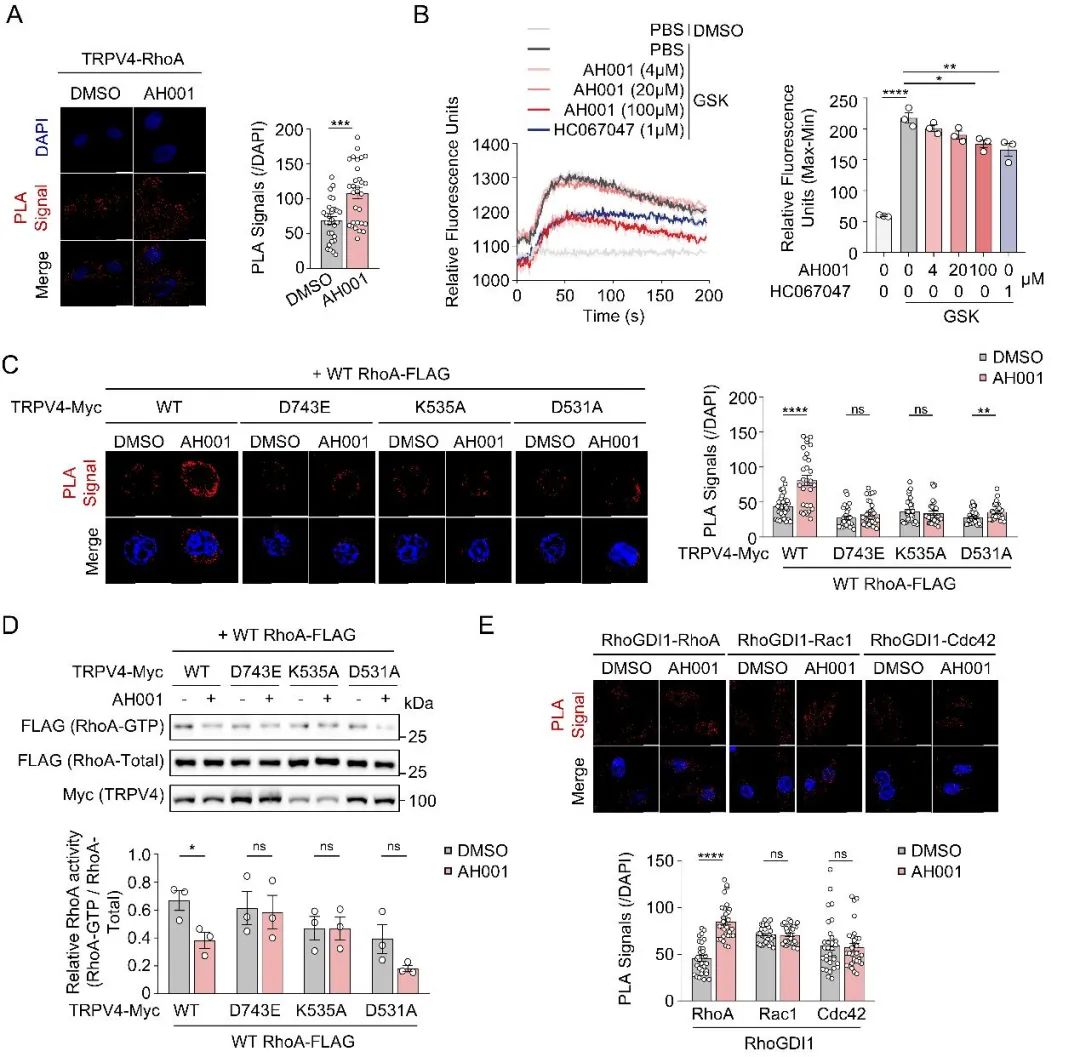
图2. AH001对TRPV4-RhoA相互作用的影响
在明确了AH001对VSMCs中TRPV4-RhoA的影响后,一个更关键的问题浮现:它能否通过调节血管功能,带来降压效果?为了解答这个问题,研究团队在多种高血压动物模型上进行了测试:包括血管紧张素II (Ang II)诱导的高血压小鼠、自发性高血压大鼠(SHR),以及作为对照的正常血压WKY大鼠。结果令人振奋,无论是单次给药还是长期治疗,AH001都展现出显著的即时和持续降压效果。更重要的是,它对血压正常的WKY大鼠没有影响,体现了其良好的安全性(图3-4)。
降压之外,研究还关注了血管重构的改善。组织检测发现,AH001能够有效改善高血压引发的血管重构:它降低了血管中膜厚度,并显著减少了关键的重构标志物(如vinculin、fibronectin和collagen I)及其上游调控因子SRF的表达(图3-4)。
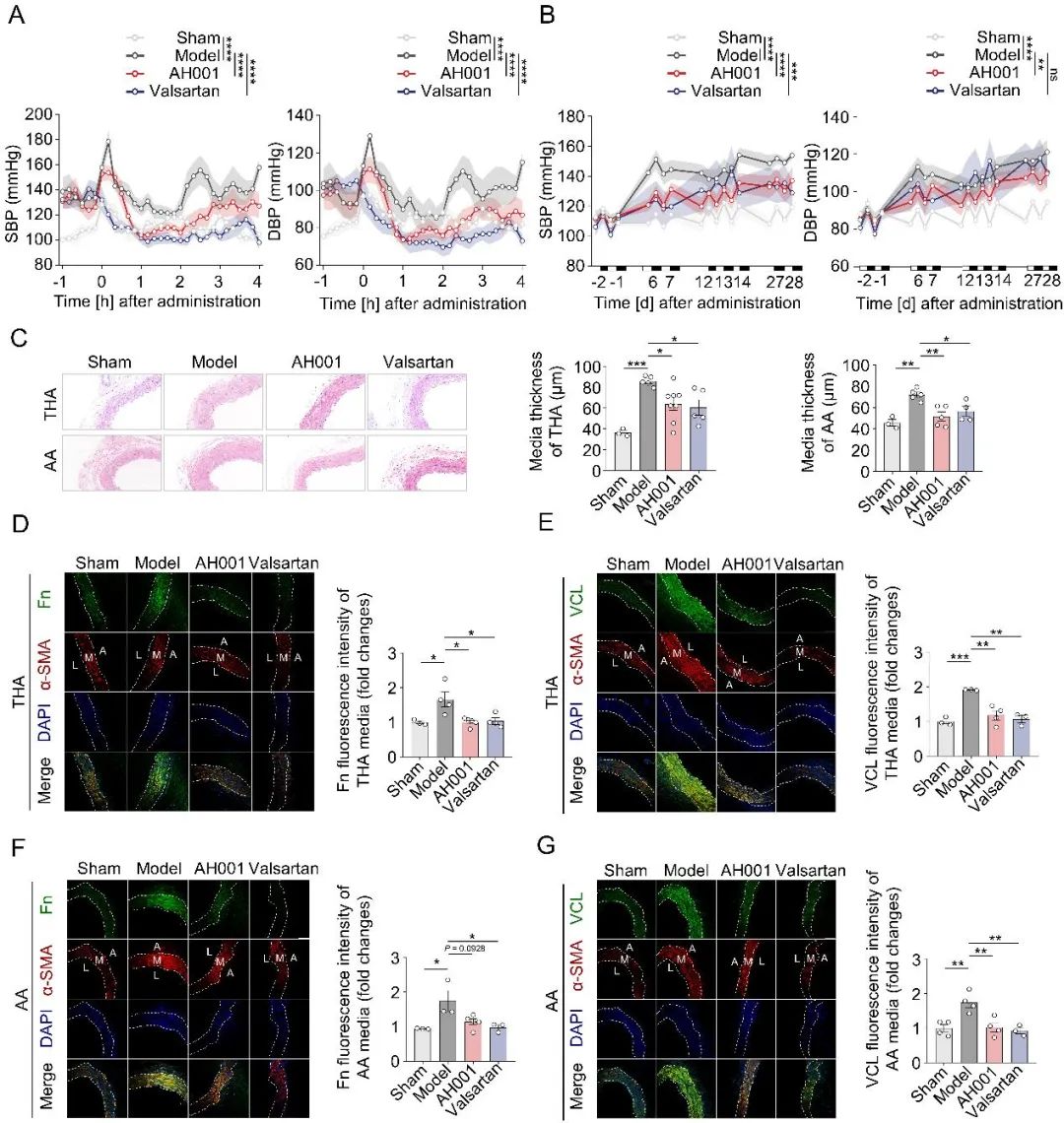
图3. AH001对Ang II诱导的高血压小鼠模型的降压效果
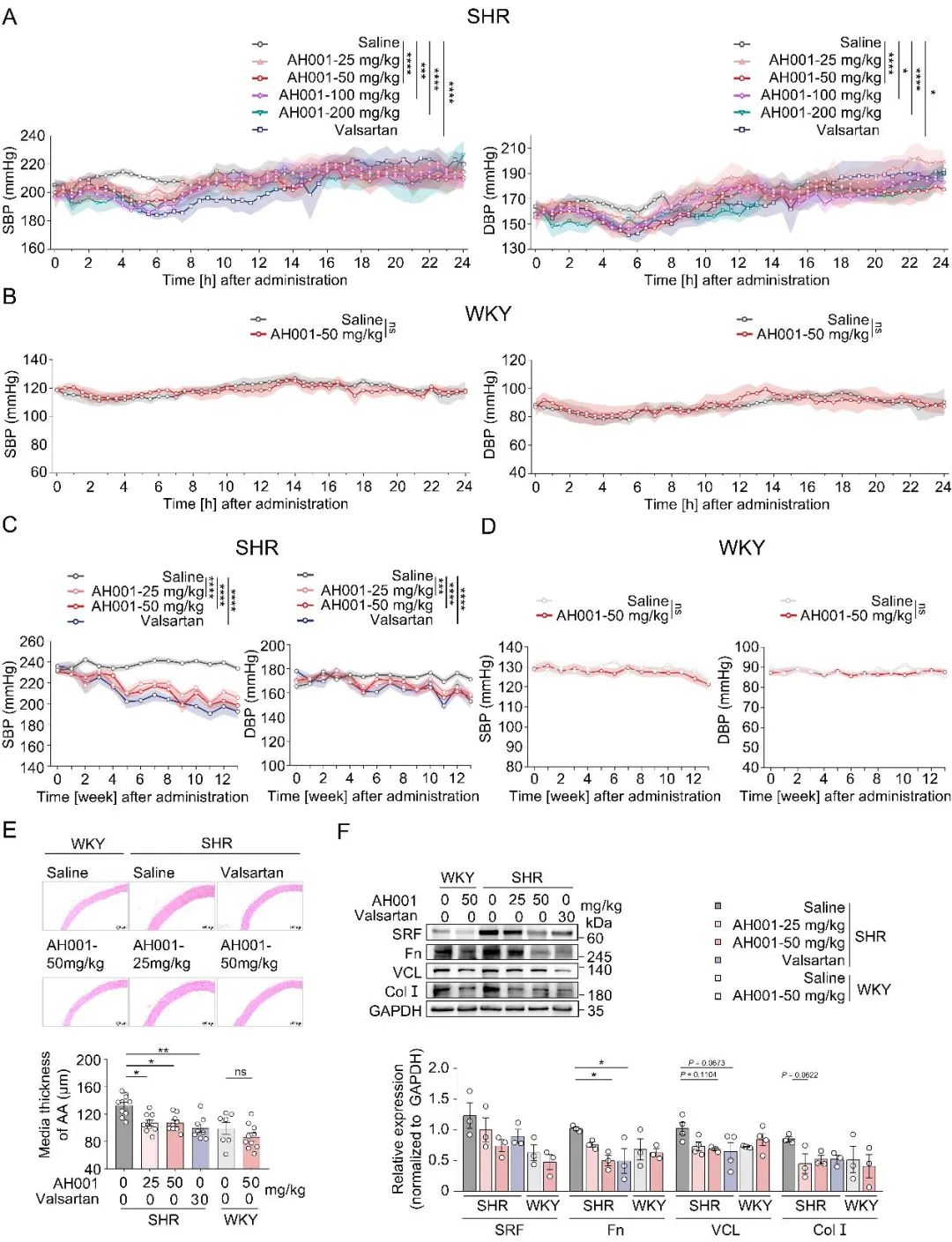
图4. AH001对SHR大鼠的降压效果
那么,TRPV4-RhoA-RhoGDI1轴是否就是AH001发挥降压作用的关键靶标呢?为了验证这一点,研究者构建了基因敲除模型—全身性敲除TRPV4小鼠(Trpv4⁻/⁻)和平滑肌特异性敲除RhoGDI1 (Arhgdia)小鼠,同样使用Ang II诱导高血压。结果非常明确:在这两种关键基因缺失的高血压小鼠上,AH001的降压效果和改善血管重构的能力都被显著削弱(图5-6)。这一有力的证据最终锁定了“TRPV4-RhoA-RhoGDI1轴”就是AH001发挥心血管保护作用的核心机制。
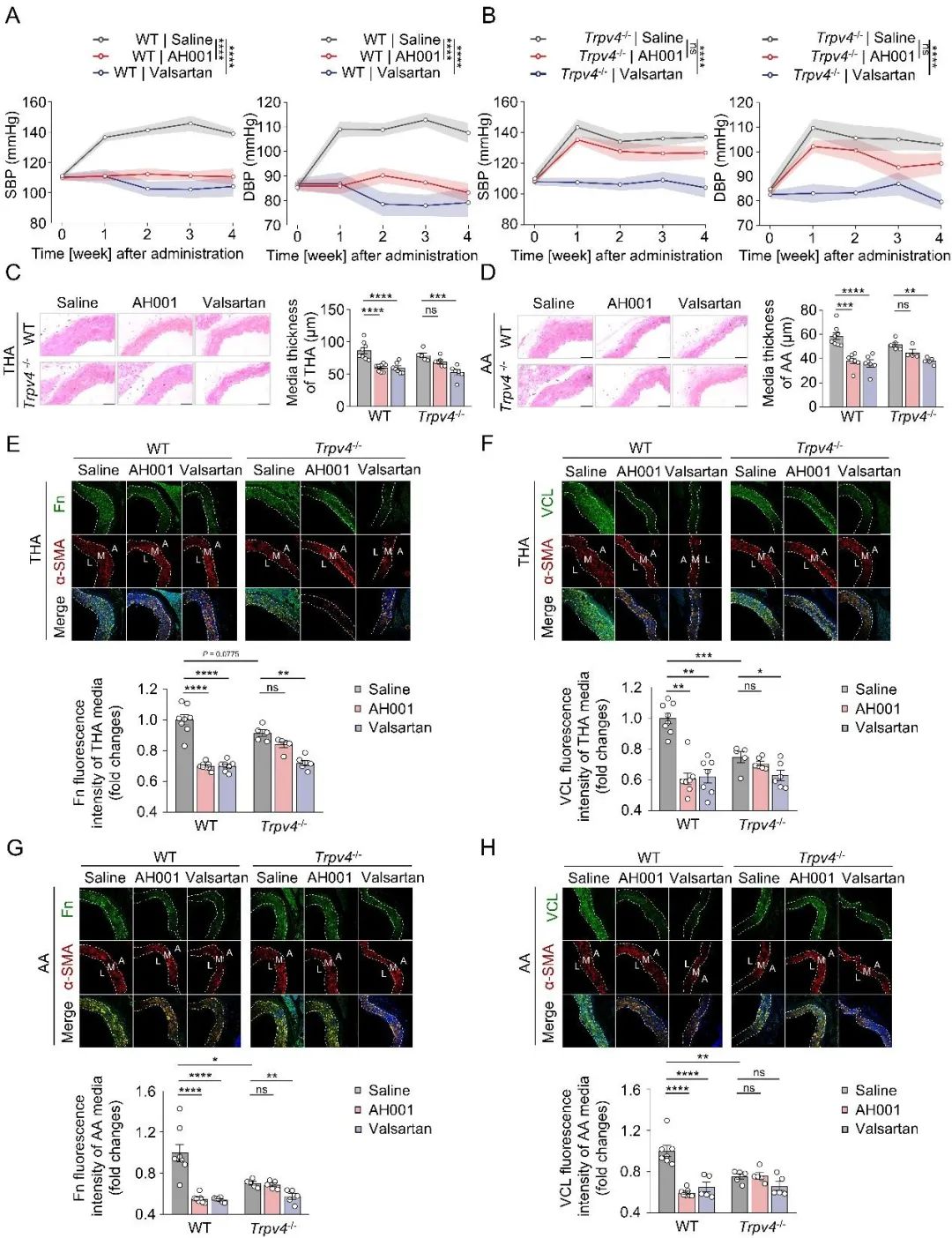
图5. 敲除TRPV4对AH001降压效果的影响
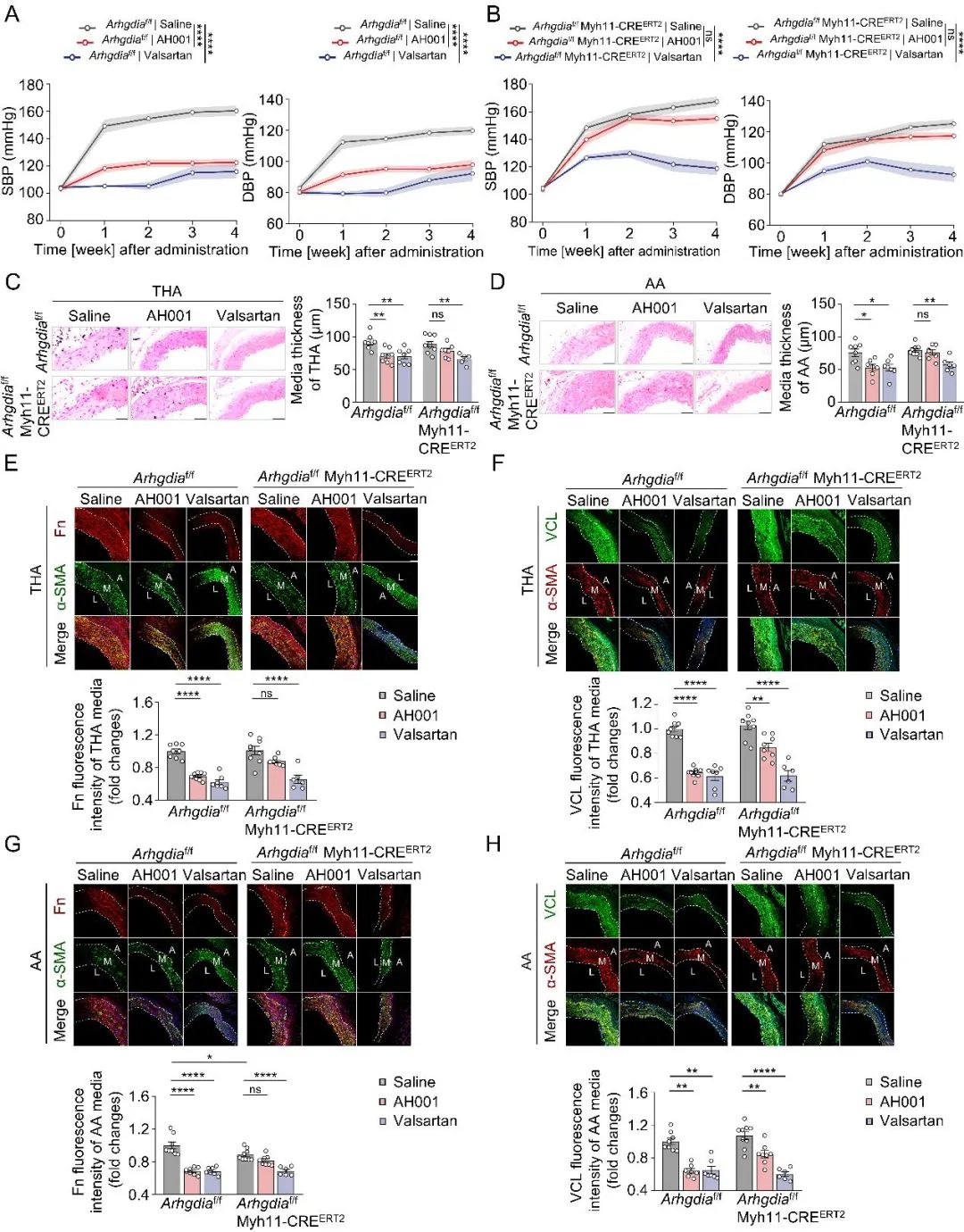
图6. 平滑肌特异性敲除RhoGDI1对AH001降压效果的影响
VSMC的异常收缩和向肌成纤维表型的转换,是高血压引发血管重构的关键环节。而RhoA-ROCK信号通路正是驱动这一过程的推手。那么,AH001是如何快速起效实现降压的呢?研究团队首先在离体血管(肠系膜动脉环)和细胞层面(胶原凝胶收缩实验)找到了答案:AH001能够显著抑制动脉和VSMC的收缩(图7B-C)。深入探究发现,它有效“关闭”了RhoA的活性开关,并阻断了其下游关键信号—MYPT1和MLC的磷酸化过程(图7D-E)。更重要的是,当用siRNA “沉默”VSMC中的TRPV4或RhoGDI1基因后,AH001抑制RhoA-ROCK通路及其导致的VSMC收缩能力被显著削弱(图7F-K)。这再次强调了TRPV4-RhoA-RhoGDI1轴的核心枢纽地位。
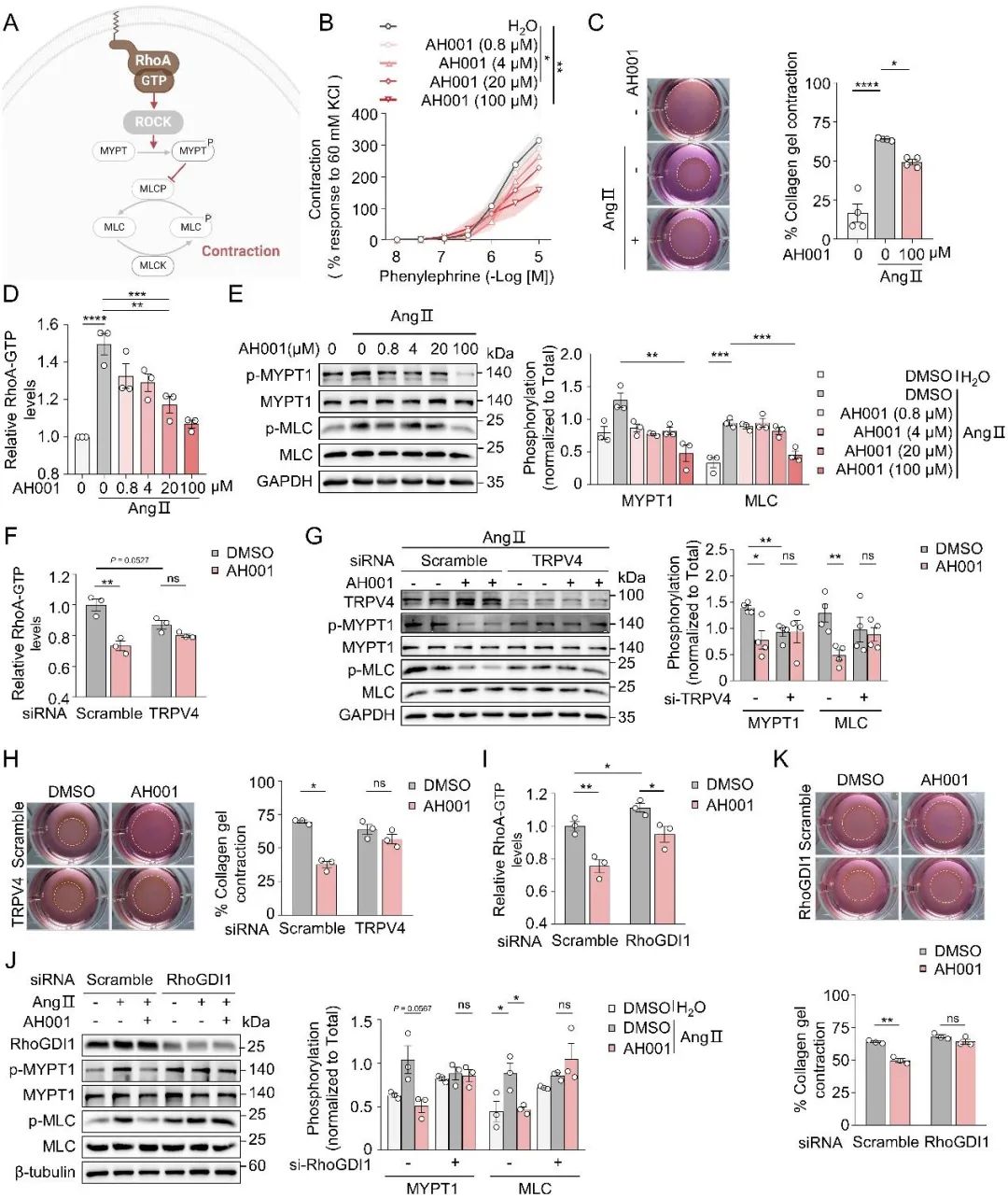
图7. AH001抑制VSMC收缩
信号传导并未在此停止。RhoA-ROCK被激活后,还会启动一串连锁反应:依次激活LIMK/cofilin,进而推动MRTF-A入核,与SRF结合,最终大量生产那些导致血管重构及VSMC表型发生转变的分子(如vinculin、fibronectin和collagen I)。AH001有效抑制了LIMK1和cofilin的磷酸化,并大幅降低了SRF及重塑标志物(vinculin, fibronectin, collagen I)的产量(图8B)。免疫荧光更直观的观察到AH001阻止了MRTF-A进入细胞核,并减少了细胞骨架蛋白F-actin的异常聚集(图8C-D)。同样关键的是,当TRPV4或RhoGDI1被siRNA“敲低”后,AH001对LIMK/cofilin/MRTF-A/SRF这条信号通路及其驱动的VSMC向肌成纤维表型转换的抑制作用,也被明显削弱(图8E-J)。
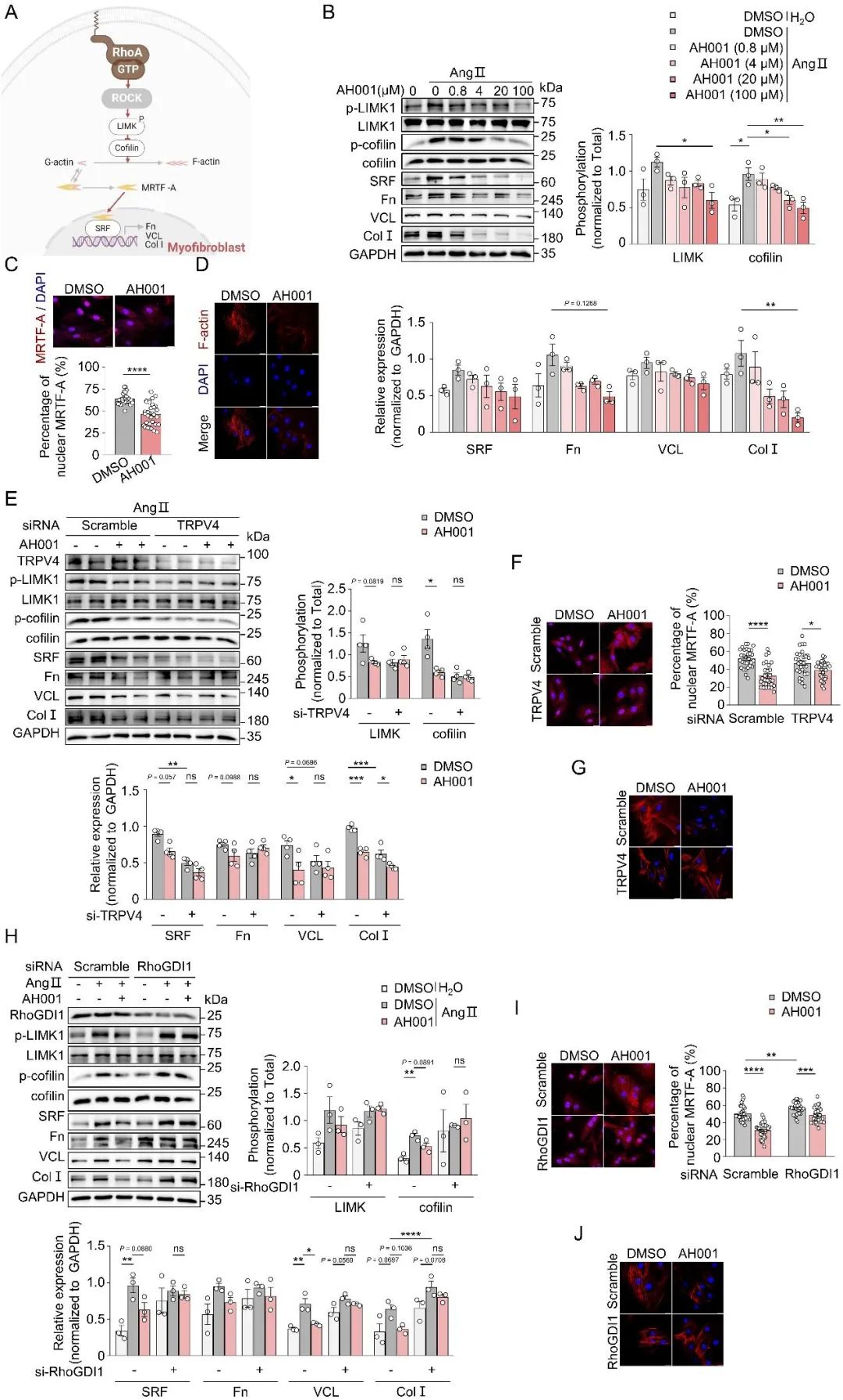
图8. AH001抑制VSMC向肌成纤维表型的转换
至此,机制蓝图完全绘就:AH001通过精准锁定TRPV4-RhoA-RhoGDI1这一核心调控枢纽,一方面增强TRPV4与RhoA的结合,另一方面促进RhoGDI1与RhoA的相互作用,从而有效阻断RhoA的GTP/GDP循环,抑制其活性。这不仅快速缓解了VSMC的“过度紧张”,实现即时降压;更从源头上破坏了VSMC向肌成纤维表型的“转型之路”,为对抗高血压血管重构筑起了双重防线(图9)。
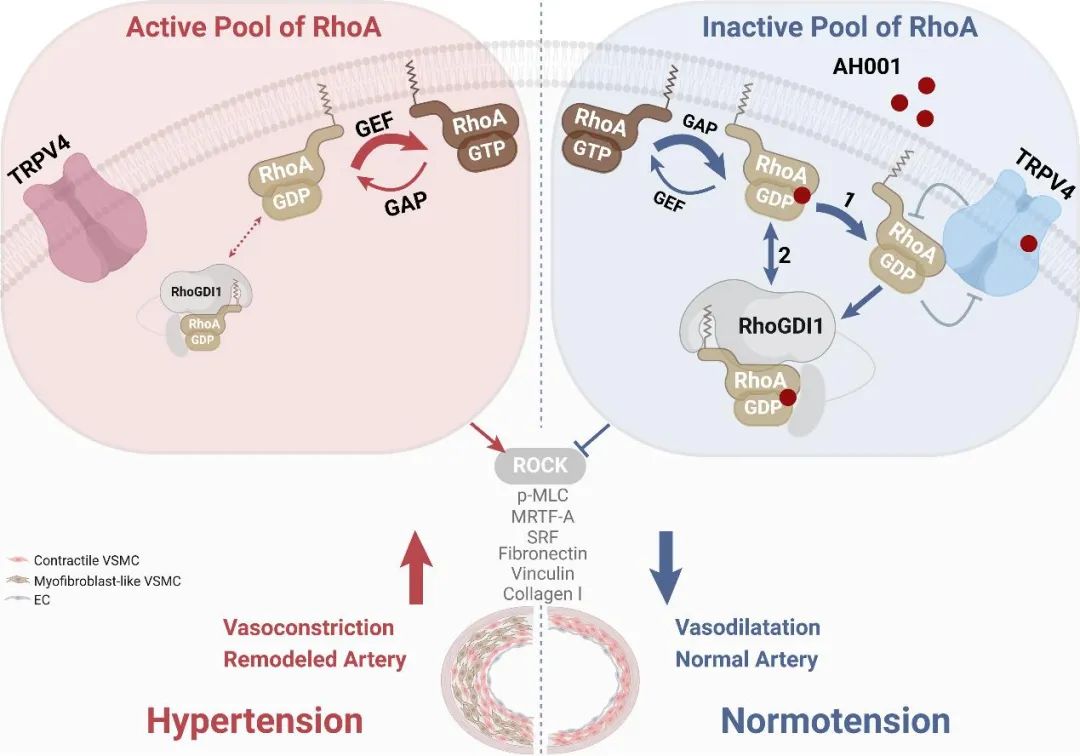
图9. 高血压治疗新策略—靶向TRPV4- RhoA-RhoGDI1轴
华东理工大学药学院博士生王佳雯和袁珍为文章共同第一作者。华东理工大学/华东师范大学药学院李洪林、王蕊、李诗良教授为该文章的通讯作者。该工作得到了浙江工业大学沈寅初院士的悉心指导,研究团队感谢瑞金医院上海高血压研究所的高平进教授、李晓东教授、陈晓卉教授、陈栋睿教授,中科院脑科学与智能技术卓越创新中心叶铮研究员,中科院上海药物所陈笑艳研究员和宫丽崑研究员的大力支持和帮助。
该工作得到了国家杰出青年基金延续项目(82425104)和国家重点研发计划(2022YFC3400501)等项目资助。
原文链接:
https://doi.org/10.1161/CIRCULATIONAHA.124.071884
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)