首页 > 医疗资讯/ 正文
炎症性肠病(IBD)是一种以肠道慢性非特异性炎症为特征的难治性疾病,全球发病率逐年攀升,严重威胁患者生命、降低生活质量。IBD发病机制复杂,与肠道菌群失衡、肠道屏障受损、免疫失调及氧化应激过度激活密切相关。目前,益生菌疗法因能调节肠道菌群、修复屏障功能被寄予厚望,但其临床应用受存活率低、靶向性弱两大瓶颈制约。解决益生菌在胃肠道中的存活难题,实现对炎症部位的精准递送,或可为IBD疾病治疗提供全新的精准化、协同化策略。
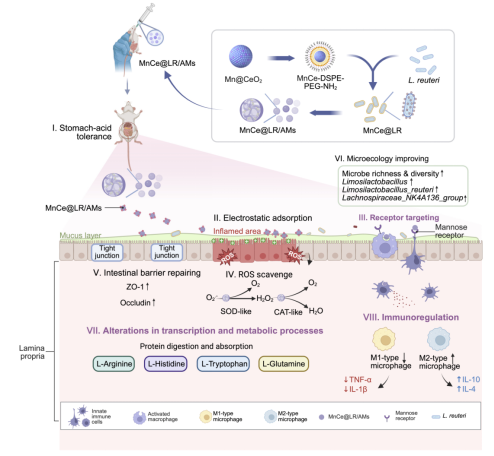
图1:MnCe@LR/AMs的合成流程与治疗机制。MnCe@LR/AMs 具有以下特性:(A)耐胃酸能力;(B-C)通过静电作用和甘露糖受体(MR)靶向作用黏附于炎症部位;(D)清除活性氧(ROS);(E)修复肠道屏障;(F)改善微生态;(G)改变转录与代谢过程;(H)免疫调节作用。
基于此,南京大学医学院附属金陵医院普通外科王新颖教授团队和南京大学现代工程与应用科学学院魏辉教授团队合作,创新性地将纳米酶(Nanozyme)技术与益生菌疗法结合,研发出兼具“保护、靶向、抗氧化”三重功能的新型益生菌递送系统MnCe@LR/AMs。该系统将锰掺杂的氧化铈纳米酶(Mn@CeO₂)修饰于罗伊氏乳杆菌(L.reuteri)表面,再使用海藻酸钠微球(AMs)包裹。其中,Mn@CeO₂纳米酶具有出色的抗氧化活性,能有效清除肠道内过量的活性氧(ROS),减轻氧化应激损伤(图1D);海藻酸钠微球不仅能保护益生菌免受胃酸、消化酶等的破坏(图1A),还凭借其负电荷特性及与炎症部位高表达的甘露糖受体的特异性结合,实现对肠道炎症部位的双重靶向递送,提高益生菌在炎症区域的定植率(图1B-C)。
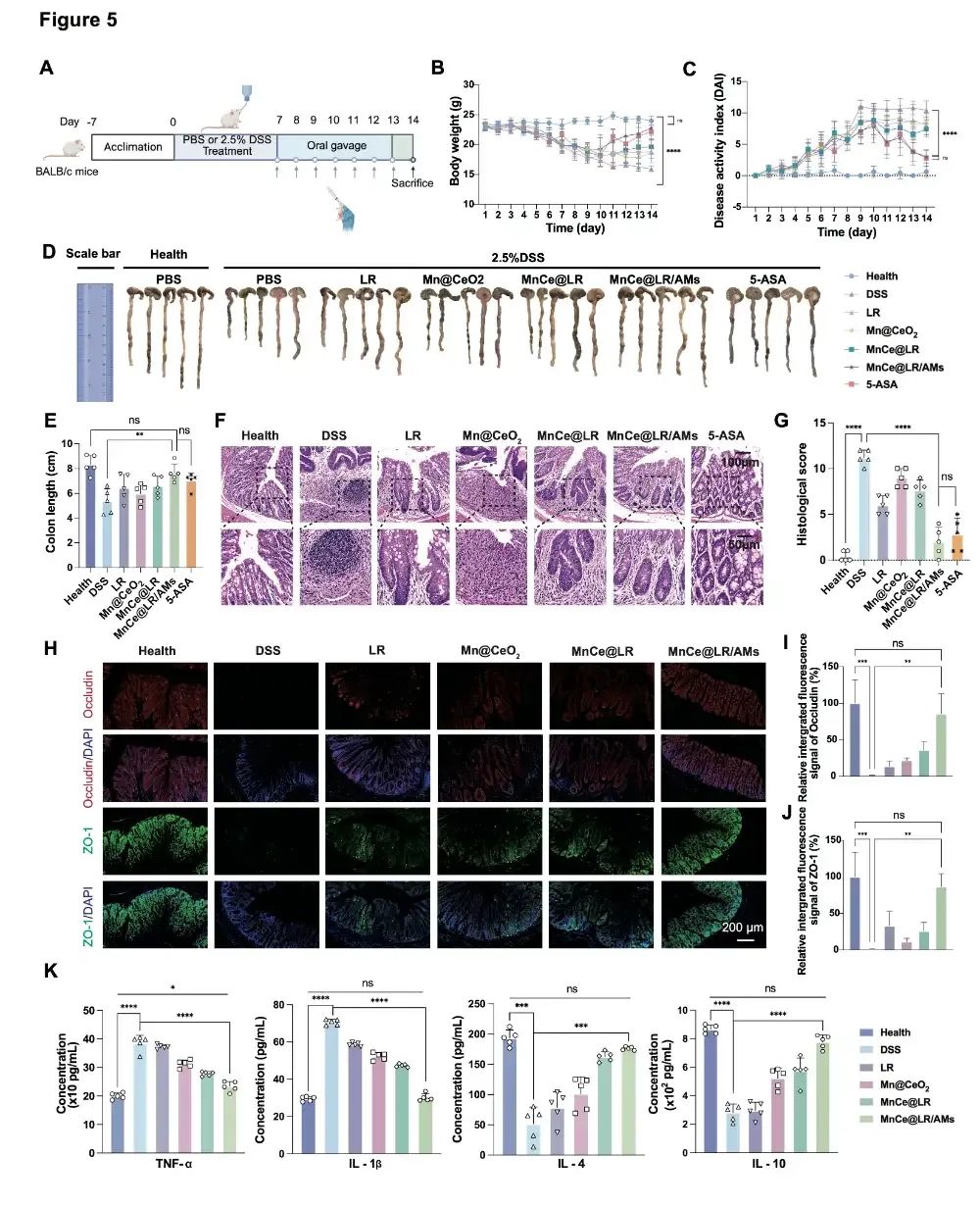
图2:MnCe@LR/AMs对DSS诱导的小鼠急性结肠炎的治疗效果。(A)结肠炎小鼠造模流程图;(B)结肠炎诱导及治疗 14 天期间的体重变化;(C)各组每日疾病活动指数(DAI)评分变化;(D)结肠组织图像;(E)各组结肠长度统计结果。(F)各组结肠组织的代表性 H&E 染色图像。(G)各组结肠组织的组织病理学评分。(H)各组结肠组织中 ZO-1 和 occludin 的代表性免疫荧光图像。(I-J)结肠组织中 occludin和ZO-1免疫荧光图像的相对荧光强度统计分析。(K)小鼠血清中TNF-α、IL-1β、IL-4和IL-10的浓度。
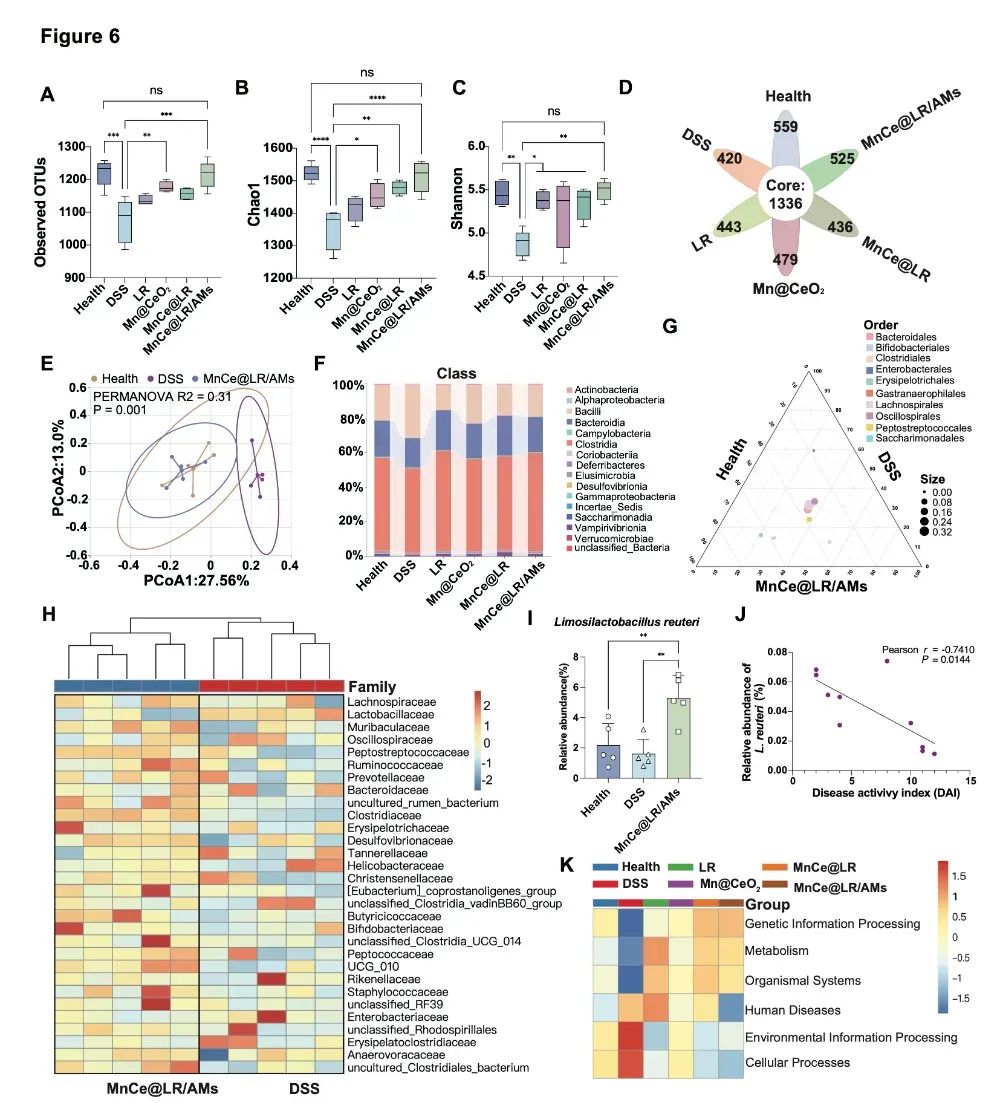
图3:MnCe@LR/AMs 对肠道微生态的调节作用。(A-D)各组肠道菌群的α多样性比较。(E)各组肠道菌群的β多样性比较。(F)各组在纲水平的相对丰度。(G)MnCe@LR/AMs 在目水平对菌群组成的影响。(H)DSS 组和 MnCe@LR/AMs 组在科水平的相对丰度。(I)健康组、DSS 组和 MnCe@LR/AMs 组中L. reuteri相对丰度的比较。(J)第 14 天 DSS 组和 MnCe@LR/AMs 组DAI与L. reuteri相对丰度的线性回归图及Pearson相关性分析。(K)基于 KEGG 通路的各组肠道菌群功能预测热图。
在动物实验中,MnCe@LR/AMs展现出显著的治疗效果。在 DSS 诱导的溃疡性结肠炎小鼠模型中,该系统可显著降低疾病活动指数(DAI),恢复结肠长度,减轻肠道黏膜损伤(图2F-G);通过修复紧密连接蛋白(ZO-1、occludin)的表达,肠道屏障完整性得到有效恢复,AB-PAS 染色显示杯状细胞数量恢复至健康水平(图2H-J);同时,它能调节肠道菌群平衡,增加双歧杆菌、梭菌等有益菌丰度,降低促炎菌如大肠杆菌的比例(图3),并通过促进氨基酸吸收、调控巨噬细胞向抗炎表型(M2 型)极化,全面改善肠道代谢与免疫功能。
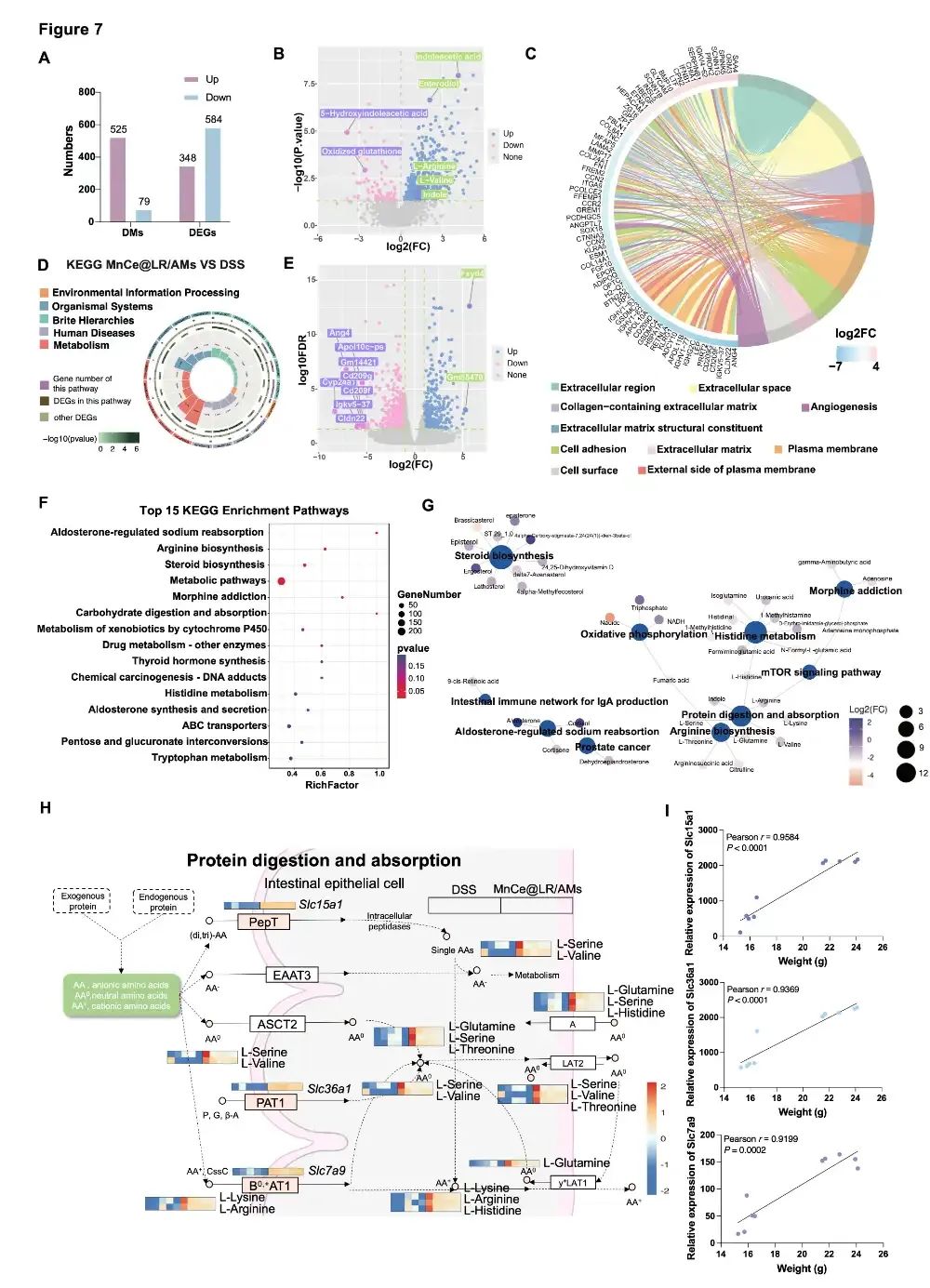
图4:MnCe@LR/AMs治疗急性结肠炎的代谢组学与转录组学联合分析。(A)MnCe@LR/AMs组与DSS组相比,差异表达基因(DEGs)和差异代谢物(DMs)的数量。(B)MnCe@LR/AMs组与DSS组之间DMs的火山图。(C)基于GO的DEGs通路富集弦图。(D)基于KEGG的DEGs通路富集环形图。(E)DEGs的火山图。(F)基于KEGG的DMs通路富集气泡图。(G)差异修饰代谢物与富集通路的网络图。(H)蛋白质消化吸收通路中关键基因和代谢物变化的示意图。(I)第14天DSS组和MnCe@LR/AMs组中小鼠体重与Slc7a9、Slc15a1及Slc36a1相对表达量的线性回归图及Pearson相关性分析。
该团队进一步通过多组学联合分析发现,MnCe@LR/AMs能够调控肠道代谢及基因转录,进而改善 IBD 相关营养吸收障碍和代谢紊乱。代谢组学分析显示,与DSS模型组相比,MnCe@LR/AMs 处理后,肠道内色氨酸代谢物(如吲哚-3-乙酸)和氨基酸(如精氨酸、组氨酸)的丰度显著升高,而氧化型谷胱甘肽等应激代谢物减少(图4B)。这些变化有助于增强肠道抗氧化能力,调节免疫平衡。转录组学研究发现,该系统可上调Slc15a1、Slc36a1、Slc7a9等基因的表达,这些基因分别调控中性氨基酸转运体及阳离子氨基酸转运体,促进肠道对丝氨酸、精氨酸等氨基酸的吸收(图4E)。同时,氨基酸代谢通路(如精氨酸、色氨酸代谢)被显著激活,提升蛋白质消化与吸收效率(图4F-G)。相关性分析表明,肠道氨基酸水平与小鼠体重恢复呈正相关,提示其通过改善营养吸收缓解 IBD 引起的体重下降,为疾病治疗提供了代谢层面的新机制(图4I)。
综上所述,此项研究创新性地将纳米酶的抗氧化特性、海藻酸钠的保护递送功能与益生菌的微生态调节作用有机结合,构建了“清除ROS-修复屏障-平衡菌群-调节代谢免疫-改善营养吸收”的多维度治疗体系,不仅解决了传统益生菌疗法的技术瓶颈,更打破了IBD的病理恶性循环,为 IBD 的精准治疗提供了全新的临床转化方向。
该成果以“Dual-Targeting Mn@CeO2 Nanozyme-Modified Probiotic Hydrogel Microspheres Reshape Gut Homeostasis in Inflammatory Bowel Disease”为题发表于ACSNano,第一作者为南京大学硕士研究生周品闻、博士研究生孙琦和黄龙昌,通讯作者为王新颖教授和魏辉教授。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.5c08999
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)