首页 > 医疗资讯/ 正文
论坛导读:帕金森病(Parkinson’s Disease, PD)步态障碍是导致跌倒、残疾和生活质量下降的核心问题。药物治疗及深部脑刺激对轴性症状改善有限,代偿策略已成为重要的非药物干预手段。感觉增强策略(如节拍器、视觉线索)通过激活替代神经通路(小脑-运动皮层)补偿基底节功能缺陷;动作策略调整(如踏步训练、增大步幅)则促进运动程序再学习;而认知策略(如双重任务训练)优化了注意力资源分配。研究表明多模态策略组合效果优于单一策略,个性化适配是临床转化关键。未来研究需结合神经影像、生物标志物及人工智能技术,构建精准化、智能化的步态代偿干预体系。
帕金森病(Parkinson's disease, PD)是第二常见的神经退行性疾病,随着人口老龄化的迅速增加,与衰老有关的PD患病率在未来30年内预计将翻一番。冻结步态(Freezing of Gait, FOG)是帕金森病及其他神经系统疾病患者常见的致残性运动症状,表现为步态突然中断,显著增加跌倒风险并损害生活质量。超过 60% 的晚期帕金森病患者会受到步态冻结的影响,这显著增加了跌倒风险,限制了行动能力,并损害了生活质量。在步态冻结的亚型中,转弯诱发的冻结尤为常见,占所有发作的 48.4%。尽管多巴胺能药物和脑深部电刺激(DBS)可以缓解与转弯相关的冻结,但效果往往不够理想。
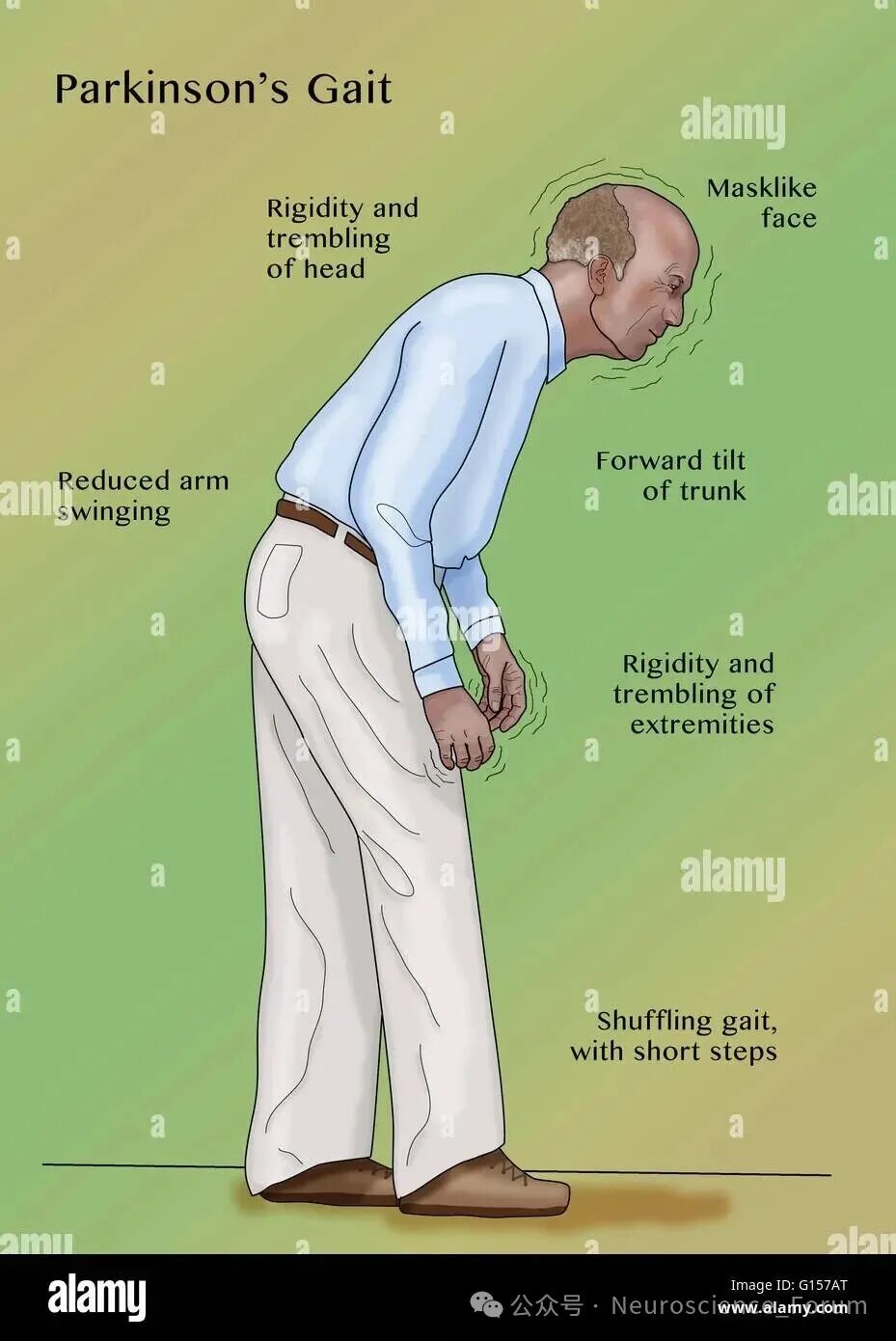
国际MDS姿势和步态障碍学组将帕金森病步态障碍分为两种类型:①持续性步态障碍,指步态缓慢,拖曳步态,走路时手臂摆动减少或完全消失;②间歇性步态障碍,包括慌张步态和冻结步态。冻结步态的定义为尽管有行走的意愿,但前进过程中步伐出现短暂性、发作性中止或减少。冻结步态每次发作通常持续数秒,偶尔超过30s。帕金森病患者中冻结步态的患病率约为50.6%,且患病率随着帕金森病病程延长而增加。荟萃研究显示疾病严重程度、左旋多巴的早期服用的较高剂量、症状波动、姿势不稳与步态障碍症状严重、会增加FOG的发生风险。焦虑、认知障碍和嗅觉减退等非运动因素也可能与FOG相关。针对PD患者的临床特征制定个体化的治疗方案将有助于减少FOG的发生。

研究证明帕金森病患者在转身时出现的冻结现象具有特定阶段的电生理异常。在正常转弯的转弯前阶段和冻结转弯的转弯开始阶段,PMC-STN的相干性增强,其中转弯前的α波抑制和相干性可预测冻结持续时间。药物治疗使这些异常振荡恢复正常,并改善了转弯情况。通过将转身动作分段,研究者发现运动前皮质的α波功率显著降低,准备阶段α活动的减少可预测冻结持续时间。此外,该阶段运动前皮质与丘脑底核之间的α波相干性增强也可预测冻结持续时间。尽管多巴胺能药物可部分纠正这些异常模式,但仍存在残留异常,这凸显了进行针对性神经调控的必要性。

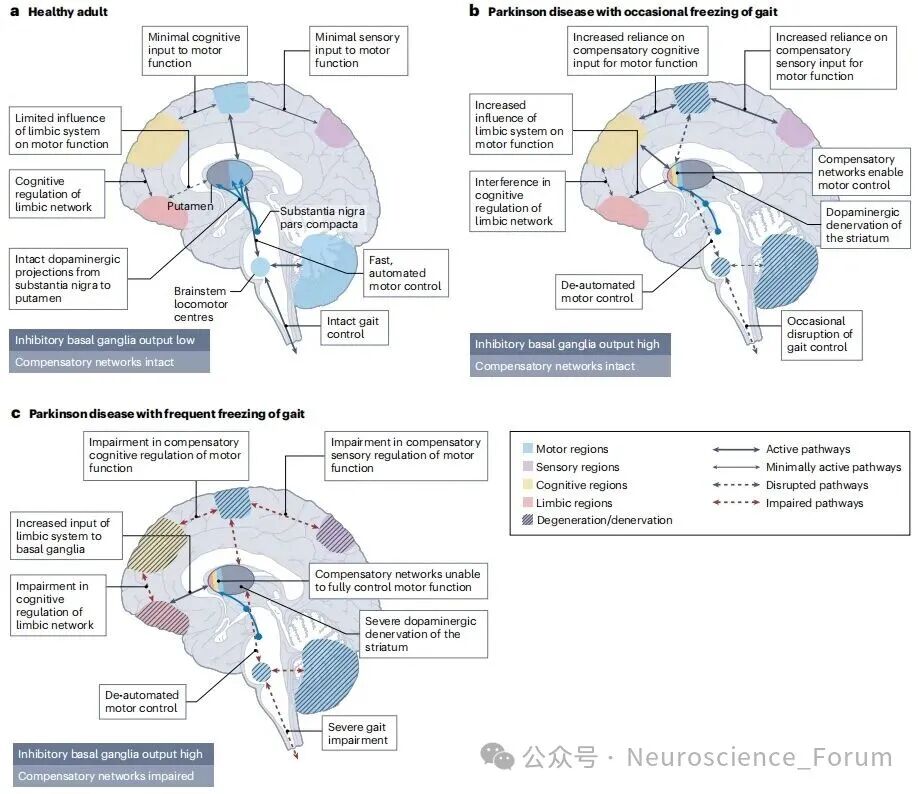
FOG的病理生理机制复杂,涉及基底神经节抑制性输出增加和大脑代偿网络功能失调。在健康成人中,步态控制依赖自动化的运动调节(图a);而在帕金森病患者中,基底神经节过度抑制导致步态自动化丧失,需依赖代偿性认知和感觉输入(图b)。随着疾病进展,代偿网络进一步受损,FOG发作更频繁(图c)。
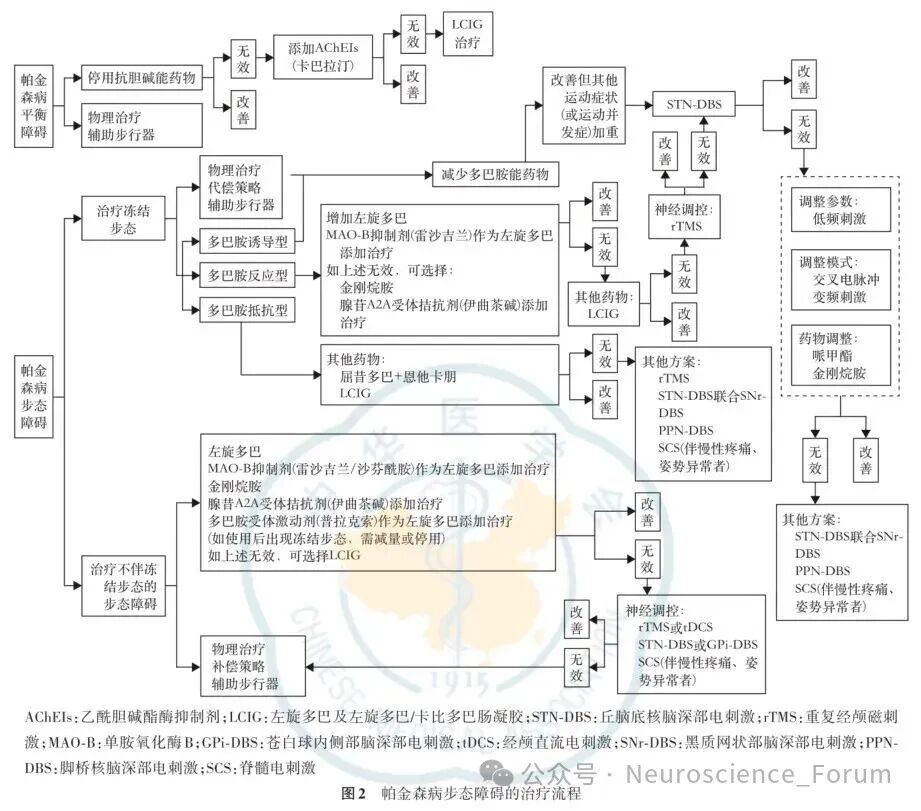
根据FOG对多巴胺能药物的反应,可将其分为以下类型:关期FOG多巴胺能药物可改善症状,推荐优化左旋多巴治疗或添加MAO-B/COMT抑制剂。假开期FOG药物剂量不足导致,需增加多巴胺能药物剂量。多巴胺无反应性FOG药物效果有限,需考虑非药物干预。对于药物效果不佳的患者,可考虑脑深部电刺激(DBS)或输注疗法。DBS靶向丘脑底核(STN)或苍白球内侧部(GPi)可显著改善关期FOG,而脚桥核(PPN)DBS效果不一致。左旋多巴-卡比多巴肠凝胶输注(LCIG)也可减少关期FOG发作。
一项研究共识别了四种FOG患者的动态功能连接模式:一种频繁且连接稀疏的网络(状态I),一种不频繁但高度同步的网络(状态IV),以及视觉网络和感觉运动网络之间连接方向相反的两个网络(状态II为正相关,状态III为负相关)。与非FOG组相比,FOG患者在状态II中的停留时间显著减少,而在状态III中的停留时间增加。状态III中的较长停留时间与更严重的FOG症状相关。状态III的窗口分数( fractional window)于与FOG患者的视空间和执行功能障碍相关。此外,FOG患者大脑状态之间的转变较少,局部效率的变化较小,表明其大脑相对“僵化”。研究强调了视觉运动网络动态功能连接与帕金森病患者FOG症状的关系,为理解FOG的病理生理机制提供了新的见解。
目前认为冻结步态可能涉及背部运动环路的局部神经功能障碍及整个代偿网络的失调,皮质和小脑向基底神经节、脑干运动区的投射功能异常也会加剧冻结步态症状发作。伴随着PD病情进展,外部感觉输入和认知控制开始维持步态控制,步态控制中的干扰风险变得更高,进而引发冻结步态的频繁发作。由于冻结步态具体触发因素因人而异,有效的干预可能需要在个体层面上识别和定位这些特征的异质性。
研究表明年老化会增加认知-运动干扰效应,在工作记忆、语言和解决问题的任务中认知-运动干扰效应最高。目前研究所采用的认知任务、不同运动类型、不同运动强度、认知储备的个体差异导致运动训练对脑功能影响产生了不同的结果。认知-运动双任务行走不仅是PD等神经退行性疾病早期识别的特征,且通过认知-运动双任务行走训练可有效改善这类疾病患者的康复效果。因此,亟需通过临床研究识别PD冻结步态在不同类型的认知-运动干预中受益差异性及探索个体化最佳强度和方法,确定运动干预措施是否能够协同互动及运动训练对步态和认知能力的单独影响。
帕金森病中晚期出现较严重且具有特征性的步态障碍,如慌张步态和冻结步态,这些严重的步态障碍成为帕金森病患者跌倒、残疾及生活质量下降的主要影响因素。帕金森病中晚期还会出现姿势平衡异常,表现为全身呈前倾屈曲体态,行走时缺乏上肢联动及姿势反射减少直至平衡丧失。帕金森病步态障碍的治疗包括药物治疗,侵入性与非侵入性神经调控,物理治疗和代偿策略。
非药物干预旨在通过增强代偿网络功能改善步态。早期运动训练可延缓FOG发生,推荐个性化运动计划。针对平衡和步态的专项训练(如跑步机训练、虚拟现实双任务训练)可减少FOG发作。对于频繁FOG患者,建议使用助行器或轮椅。视觉或听觉提示(如激光鞋、节拍器)补偿策略可暂时改善步态。认知功能完好的患者可通过动作观察训练学习步态重启技巧。
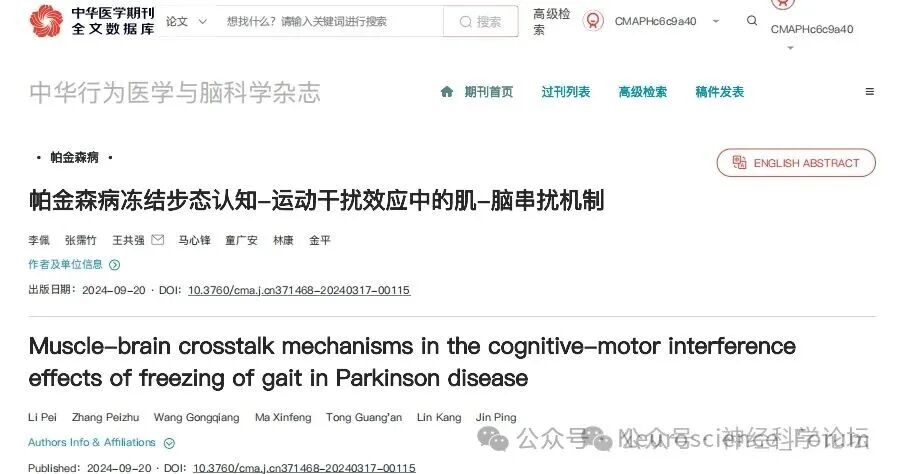
近年来,越来越多的研究表明运动可以通过肌-脑串扰机制发挥脑保健功能,即运动中骨骼肌通过分泌肌动蛋白因子透过血脑屏障,促进脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)的产生,从而增强神经发生、记忆和学习。焦虑、抑郁和认知障碍可能加重FOG。双任务步态训练和认知行为疗法可改善执行功能,但后者对FOG的直接效果有限。抗抑郁药物(如SSRIs)的效果尚不一致,需个体化评估。
目前FOG的评估工具尚不统一,新发布的Giladi协议有望改善这一问题。运动锻炼被大脑感知的事实表明,肌肉诱导的外周因素使得肌肉和大脑功能之间通过肌-脑串扰能够直接对话,运动可以促进骨骼肌中肌动蛋白的分泌,对肌脑两者的功能都表现出有益的影响。运动时肌肉分泌的细胞因子介导了肌-脑串扰及神经保护以响应运动和相关过程,肌肉协调性的差异可能反映运动的神经控制差异。未来研究需进一步探索非多巴胺能药物(如甲基苯丙胺、尼古丁酒石酸盐)和新型神经调控技术(如脊髓刺激、迷走神经刺激)的疗效。
参考文献
-
Anouk Tosserams, et al. Management of freezing of gait - mechanism-based practical recommendations. Nat Rev Neurol. 2025 Jun;21(6):327-344.
-
李佩,张霈竹,王共强,等. 帕金森病冻结步态认知-运动干扰效应中的肌-脑串扰机制[J]. 中华行为医学与脑科学杂志,2024,33(09):813-818.
-
Su D, et al. Altered Visuomotor Network Dynamics Associated with Freezing of Gait in Parkinson's Disease. Mov Disord. 2025 Jun;40(6):1112-1122.
-
中华医学会神经病学分会帕金森病及运动障碍学组, 中国医师协会神经内科医师分会帕金森病及运动障碍学组. 中国帕金森病步态障碍管理专家共识[J]. 中华神经科杂志, 2025, 58(3): 228-243.
-
Zhang Q, et al. Neural signatures of turn-induced freezing of gait in Parkinson's disease: insights from phase-specific cortico-subthalamic dynamics. NPJ Parkinsons Dis. 2025 Oct 23;11(1):305.
-
Alshimemeri S, et al. Clinical predictors of freezing of gait in patients with Parkinson's disease: A systematic review. Clin Neurol Neurosurg. 2025 May;252:108848.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)