首页 > 医疗资讯/ 正文
【导语】
过去30年间,全球超重与肥胖率急剧上升,已有超过三分之一的人口被归为超重或肥胖,且肥胖率随年龄增长呈上升趋势。肥胖不仅是MAFLD的病因,更是其重要危险因素。随着年龄增长,人体脂肪组织发生结构性重塑,这一变化与MAFLD的发生和发展密切相关。
在2025年“NSFC-RGC青年学者论坛:乙型肝炎合并脂肪肝——病毒与代谢的对话”上,香港理工大学郑竞业教授作“Metabolic-associated Fatty Liver Diseases in Obesity and Ageing”学术报告,深入探讨了MAFLD患者的脂代谢异常机制,并阐释了E3泛素连接酶MDM2在脂肪组织衰老及MAFLD发病中的关键作用。“脂肪肝学苑”第61期将精彩内容整理成文,以飨读者。
一 MAFLD患者中的脂代谢异常
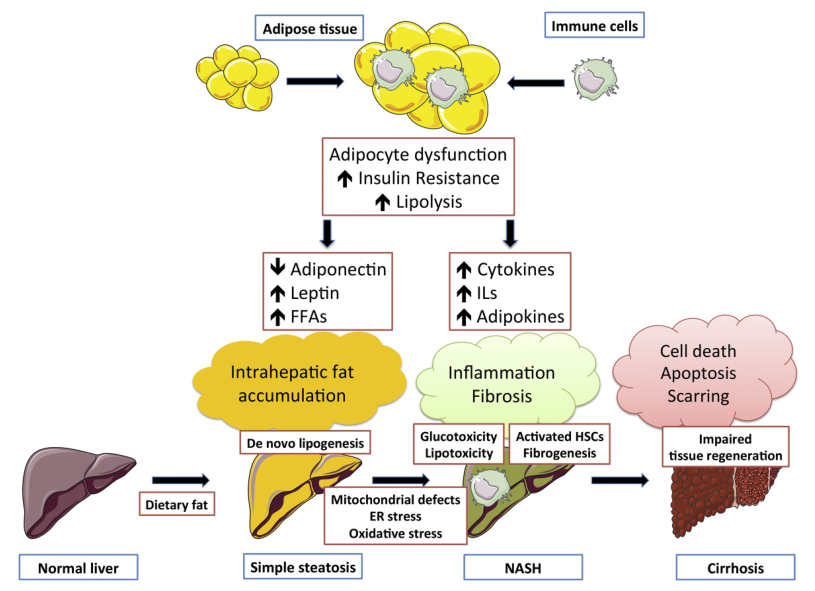
在MAFLD患者中,脂代谢异常主要表现为肝脏甘油三酯过度积累,其发生机制涉及多个代谢通路和细胞过程。肥胖通过引起脂肪组织功能紊乱和胰岛素抵抗,增强脂解作用,提高循环中游离脂肪酸水平,进而促进肝内脂肪沉积。同时,脂肪组织扩张伴随免疫细胞浸润及炎症因子释放,进一步加剧肝脏脂毒性和胰岛素抵抗[1]。
肝细胞内脂质代谢有以下四种途径[2]:
1)饮食或脂肪组织来源的循环脂肪酸摄取增加;
2)肝脏新生脂肪生成(DNL)增强;
3)脂肪酸氧化减少;
4)极低密度脂蛋白(VLDL)组装与分泌障碍。
(引自Metabolism, 2023)
VLDL分泌能力对肝细胞脂质稳态具有关键调节作用。若VLDL分泌受限——可能由于VLDL生成关键蛋白(如APOB、MTTP、TM6SF2)突变、胰岛素抵抗、磷脂酰胆碱缺乏、多不饱和脂肪酸(PUFA)减少或内质网应激,甘油三脂将储存于脂滴中,加重肝脂肪变性。临床研究表明,随着MAFLD进展,VLDL分泌及相关血脂异常现象与肝脏脂肪变性同步增强,在脂肪性肝炎阶段达到平台期;而在肝硬化等晚期肝病中,因功能性肝细胞丧失,VLDL分泌再次降低[3]。
在肝脂肪变性向脂肪性肝炎(MASH)进展的过程中,脂毒性和糖毒性通过诱导线粒体功能障碍、内质网应激和氧化应激,推动炎症反应和肝细胞损伤。持续炎症激活肝星状细胞,启动肝纤维化进程,严重时可发展为肝硬化,反映肝细胞再生修复机制衰竭。
二 脂肪细胞MDM2/p53信号轴在代谢稳态中的重要作用
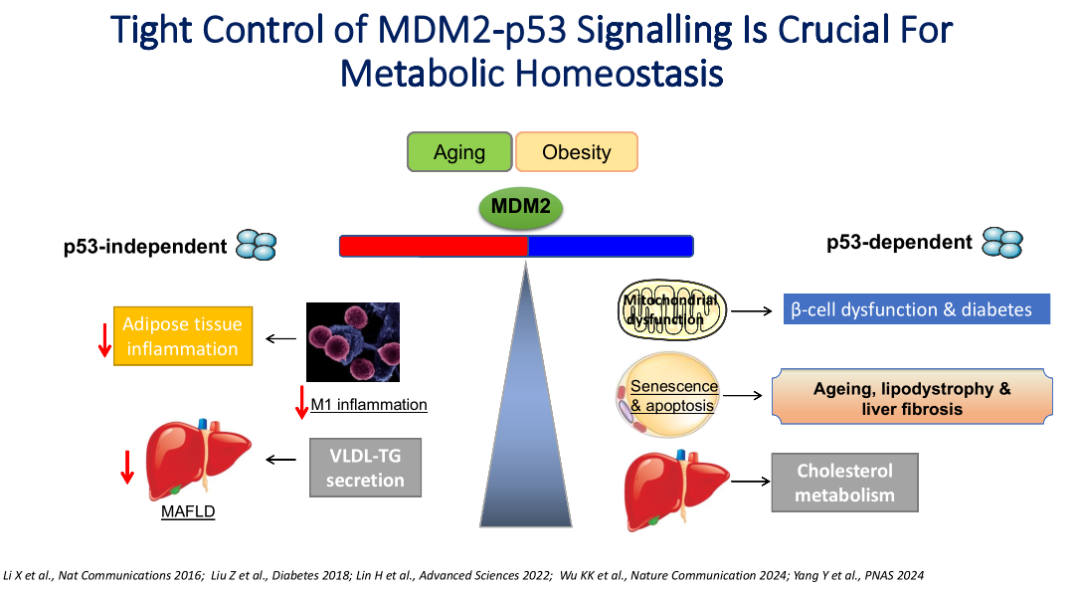
脂肪组织的代谢紊乱是增龄相关MAFLD的核心环节。研究表明,随着年龄增长,脂肪组织中MDM2的表达显著下降,这会激活p53信号通路,诱发脂肪细胞凋亡、衰老相关分泌表型(SASP),最终导致脂肪营养不良和全身性代谢紊乱,包括胰岛素抵抗、2型糖尿病和MAFLD[4]。
研究进一步通过构建不同解剖位置(皮下sWAT和内脏vWAT)脂肪组织中特异性敲除MDM2小鼠模型。发现sWAT中敲除MDM2,激活p53通过内分泌途径(如高表达Galectin-3)促进肝脏炎症和纤维化,而vWAT中p53激活则未引起明显改变。
进一步机制研究表明,Galectin-3作为sWAT来源的关键因子,可激活肝星状细胞、诱导细胞外基质沉积及凋亡,使用其抑制剂TD139能显著缓解肝脏炎症和纤维化。研究强调MDM2-p53信号通路在代谢稳态中的核心作用,也阐明皮下脂肪组织功能障碍,通过内分泌途径促进MAFLD进展,为干预衰老相关代谢性疾病提供了新的靶点。
三 靶向肝细胞MDM2可缓解MAFLD
在严重MAFLD肥胖患者及小鼠模型的肝脏中,MDM2的表达显著上升,且其表达量与血液中载脂蛋白ApoB(VLDL的关键组成部分)浓度呈负相关。通过在小鼠模型中特异性敲除肝脏MDM2,能够有效抑制高脂高胆固醇饮食引发的肝脂肪变性和炎症反应,并显著提高肝脏中TG-VLDL的分泌水平。
主要机制是,MDM2作为一种E3泛素连接酶,可直接通过与ApoB的蛋白互作,促进其经蛋白酶体途径降解,进而抑制肝细胞的TG-VLDL分泌功能。应用小分子化合物Nutlin3a可干扰MDM2与ApoB之间的结合,从而恢复肝脏ApoB表达,增强TG-VLDL分泌,并显著缓解饮食所致的脂肪性肝炎和肝纤维化。
值得注意的是,MDM2对肝脏VLDL代谢及MAFLD的调控并不依赖经典的MDM2-p53信号通路。MDM2是MAFLD中ApoB水平及TG-VLDL分泌的负向调控因子。通过基因手段或药物抑制MDM2,可在MAFLD小鼠模型中发挥保护效应,改善肝脏脂肪变性、炎症和纤维化[5]。
四 反义寡核苷酸(ASO)特异性抑制肝细MDM2
反义寡核苷酸(ASO)是一种经化学修饰的单链寡核苷酸,通过碱基互补配对原则与特定的靶信使RNA(mRNA)结合,从而抑制其翻译或促进其降解,实现对靶基因表达的调控。
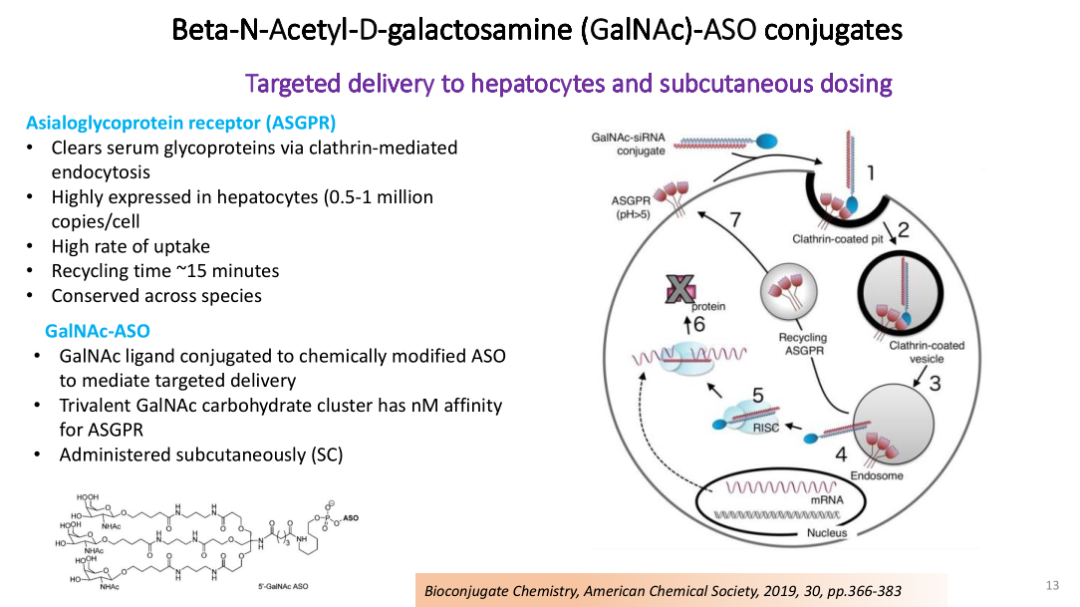
研究团队开发了一种肝细胞特异性MDM2 ASO,其创新性地采用了靶向递送技术。该ASO与β-N-乙酰氨基半乳糖(GalNAc)配体共价连接,形成GalNAc-ASO偶联物。GalNAc能特异性识别并高效结合肝细胞表面高表达的去唾液酸糖蛋白受体(ASGPR)。
该受体具有内化效率高、循环快(约15分钟)且种属保守的特点。通过皮下给药后,三价GalNAc糖簇与ASGPR以纳摩尔级的高亲和力结合,通过网格蛋白介导的内吞作用将ASO精准递送至肝细胞内,极大提高了药物的肝靶向性和治疗效率,并减少了对肝外组织的影响。
实验数据表明,特异性抑制肝细胞MDM2的ASO能显著降低肝脏MDM2 mRNA表达(可低至对照组的17%),并在肥胖诱导的代谢相关脂肪性肝病(MAFLD)模型中显示出多重治疗效益:包括改善葡萄糖代谢(增强糖耐量和胰岛素敏感性)、促进甘油三酯清除、恢复脂质稳态、减少肝脏胆固醇及毒性脂质积累、减轻炎症反应和纤维化。这种GalNAc-MDM2 ASO策略为治疗肥胖相关MAFLD及代谢疾病提供了一种高效的靶向治疗新途径。
(引自Bioconjugate Chemistry, 2019)
五 总 结
MDM2-p53信号通路的精确调控对维持代谢稳态具有关键作用。该通路通过p53依赖和非依赖两种机制参与多种代谢过程的调节。在p53非依赖途径中,MDM2参与巨噬细胞极化和VLDL-TG分泌等过程。而在p53依赖途径中,该通路调控β细胞功能障碍、细胞衰老、衰老相关脂肪营养不良等重要过程。这一信号通路为MAFLD发病机制和开发靶向药物提供了重要理论基础。
(引自会议幻灯)
【参考文献】
[1] Polyzos SA, Kountouras J, Mantzoros CS. Obesity and nonalcoholic fatty liver disease: From pathophysiology to therapeutics[J]. Metabolism, 2019, 92: 82-97. doi: 10.1016/j.metabol.2018.11.014
[2] Grefhorst A, van de Peppel IP, Larsen LE, et al. The Role of Lipophagy in the Development and Treatment of Non-Alcoholic Fatty Liver Disease[J]. Front Endocrinol (Lausanne), 2020, 11: 601627. doi: 10.3389/fendo.2020.601627
[3] Heeren J, Scheja L. Metabolic-associated fatty liver disease and lipoprotein metabolism[J]. Mol Metab, 2021, 50: 101238. doi: 10.1016/j.molmet.2021.101238
[4] Liu Z, Jin L, Yang J-K, et al. The Dysfunctional MDM2-p53 Axis in Adipocytes Contributes to Aging-Related Metabolic Complications by Induction of Lipodystrophy[J]. Diabetes, 2018, 67(11): 2397-2409. doi: 10.2337/db18-0684
[5] Lin H, Wang L, Liu Z, et al. Hepatic MDM2 Causes Metabolic Associated Fatty Liver Disease by Blocking Triglyceride-VLDL Secretion via ApoB Degradation[J]. Adv Sci (Weinh), 2022, 9(20): e2200742. doi: 10.1002/advs.202200742
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)