首页 > 医疗资讯/ 正文
分化疗法通过诱导肿瘤细胞分化为正常或接近正常细胞,逆转其恶性增殖、侵袭和转移特性,展现出高安全性和强特异性的独特优势。其中,全反式维甲酸(ATRA) 与三氧化二砷联用的方案在急性早幼粒细胞白血病临床治疗中可使完全缓解率超过90%,显著优于传统化疗方案。然而,其在神经母细胞瘤、肝细胞癌等实体瘤中的疗效却有限。究其原因是由于ATRA水溶性差,肿瘤靶向性不足,还易被细胞色素P450酶(尤其是CYP26A1)迅速代谢,导致其血液半衰期短(仅为30 ~ 45分钟),无法在肿瘤部位有效积累。
针对以上问题,四川大学生物医学工程学院/国家生物医学材料工程技术研究中心聂宇/金蓉蓉团队成功开发出一种叶酸修饰的脂质复合物(FRA/siCYP26A1),利用ATRA衍生物构建脂质纳米颗粒(RA)共同递送ATRA和siCYP26A1,为实体瘤的分化治疗带来新希望。相关工作以“ATRA derived lipid nanoparticles for co-delivery of siCYP26A1 to overcome metabolic limitations of differentiation therapy in solid tumors”发表在Journal of Controlled Release上。
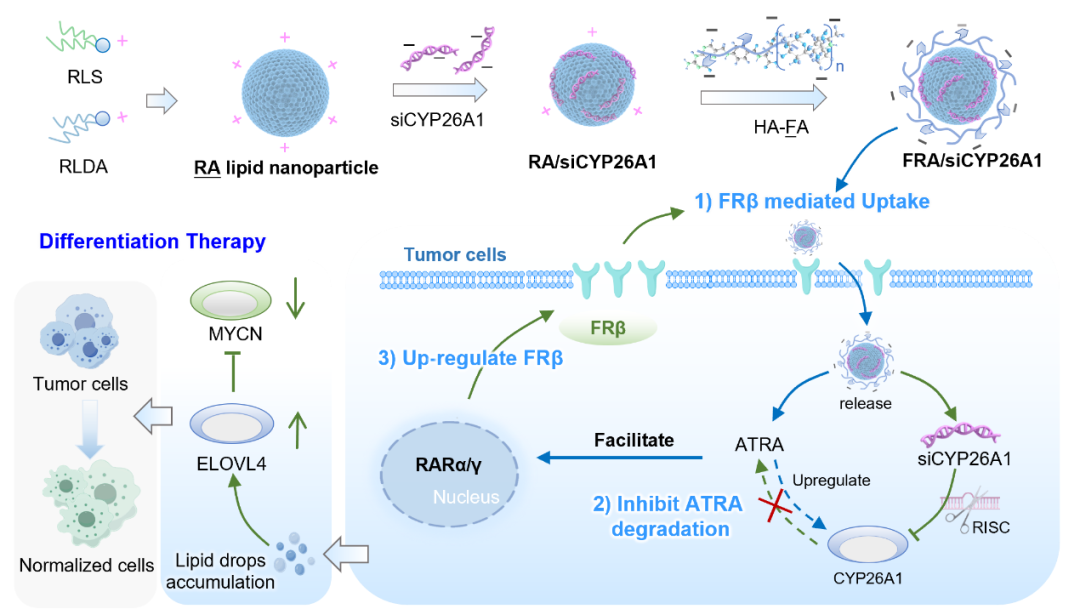
该系统利用ATRA衍生物作为核心载体构建脂质纳米颗粒RA,表面包覆叶酸修饰的透明质酸(HA)涂层,实现了ATRA与抑制CYP26A1代谢酶的siRNA(siCYP26A1)的高效共同装载与同步递送。该系统巧妙利用叶酸介导的靶向作用引导纳米颗粒进入肿瘤细胞,释放的ATRA能上调细胞叶酸受体β(FRβ)的表达,形成纳米颗粒摄取正反馈,持续驱动后续纳米颗粒的内吞吸收,实现药物在肿瘤细胞内的循环累积。同时,共递送的siCYP26A1可精准抑制关键代谢酶CYP26A1的表达,有效阻断ATRA在细胞内的快速代谢。
实验结果表明,经FRA/siCYP26A1处理的肿瘤细胞,其胞内ATRA浓度可达到临床用药13-顺式维甲酸和游离ATRA的10倍以上。肿瘤细胞分化标志物表达峰值获得数量级提升,并伴随显著的细胞形态转变,证实其有效逆转了肿瘤细胞的恶性表型。在动物模型上,FRA/siCYP26A1对神经母细胞瘤异种移植物的生长抑制率高达90.2%,对原位肝细胞癌的抑制率亦达77.4%,疗效显著。
该研究构建了共同递送ATRA与siRNA以精准调控肿瘤细胞内药物浓度的治疗新策略,通过“增强靶向摄取与循环累积”和“抑制关键代谢酶”的双效协同机制,突破了ATRA在实体瘤治疗的核心瓶颈。这一成果不仅为神经母细胞瘤和肝癌等实体瘤提供了极具前景的新疗法,更为实体瘤提供“去恶性化”而非“细胞杀伤”的治疗新思路。
四川大学聂宇教授、金蓉蓉副教授为论文通讯作者,四川大学博士研究生杨焕为第一作者。研究受到了荷兰莱顿大学张贺阳老师,澳门大学陈美婉教授,四川大学华西医院张巍教授的指导和帮助。此外,本研究得到了国家自然基金、四川省科技计划项目等的支持。
猜你喜欢
- PNAS:清华大学陈默团队研究发现靶向TUT1耗竭三小核核糖核蛋白池以抑制剪接过程和胰腺癌细胞的存活
- JAMA:无需每天,仅周末运动,护心效果与每天运动一样
- 女性治疗鼻炎,只需要记住这一招
- 黑救护车抢地盘“死磕”真救护车
- 近60%患者肿瘤几乎完全消失!JAMA:复旦肿瘤领衔“最毒乳腺癌”中国方案
- 您知道怎么在 ECMO 期间使用血管加压药和强心药物吗?
- ESH 专访|A. Daiber教授:光污染与血压调控机制:一场跨学科的精彩对话
- JAMA子刊:接受创伤后应激障碍循证治疗的退伍军人的自杀风险调查研究
- Neurology:突破CLN3型神经元蜡样脂褐质沉积症治疗困局!Miglustat长期应用显成效,或减缓运动功能退化
- LV:终止与吴亦凡合作 终止合作的公司多达十几家
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)